胃癌组织中SPARC、MMP-9的表达及意义
2015-12-02李杨吴继锋赵文娣张红秦蓉王道斌
李杨,吴继锋,赵文娣,张红,秦蓉,王道斌
(1安徽医科大学附属安庆市立医院,安徽安庆246002;2安徽医科大学)
研究发现,富含半胱氨酸的酸性分泌蛋白(SPARC)可参与组织重建、形态生长、细胞迁移和增殖,从而调节机体的生理和病理过程[1];其在某些肿瘤中异常表达并可诱导某些基质金属蛋白酶(MMP)的表达[2]。本研究探讨胃癌组织中SPARC、MMP-9在胃癌发生、发展中的作用。
1 资料与方法
1.1 临床资料 收集1999年3月~2005年5月安徽医科大学第一附属医院诊治的胃癌患者108例,均经手术病理检查证实诊断,男77例、女31例,年龄29~77岁、中位年龄58岁。其中乳头状腺癌14例,管状腺癌33例,低分化腺癌29例,印戒细胞癌19例,黏液腺癌13例;TNM分期Ⅰ期9例,Ⅱ期19例,Ⅲ期68例,Ⅳ期12例;分化程度为高分化18例,中分化29例,低分化61例。术前均未接受化疗及放疗。取其手术切除的胃癌组织(观察组),同时取89例距肿瘤组织>5 cm的胃黏膜组织(对照组)。
1.2 SPARC、MMP-9表达检测 采用免疫组化SP法。组织标本均经4%甲醛固定,石蜡包埋,切片;常规脱蜡、水化后,枸橼酸缓冲液水浴抗原修复;滴加鼠抗人 SPARC即用型单克隆抗体(浓度为1∶1 200,美国Zymed公司)或兔抗人MMP-9单克隆抗体(即用型,北京中杉生物技术有限公司),常规免疫组化方法染色。SPARC以人正常皮肤组织为阳性对照,MMP-9以人乳腺癌组织为阳性对照,均以PBS代替一抗作为阴性对照。结果由两名医师独立阅片并评定结果。间质细胞胞质和(或)细胞核出现黄色或黄褐色颗粒为SPARC阳性细胞;癌细胞胞质出现黄色或棕黄色颗粒为MMP-9阳性细胞;无着色或阳性细胞数<10%为阴性,阳性细胞数≥10%为阳性[3]。分析SPARC、MMP-9表达与胃癌临床病理参数的关系及胃癌组织SPARC与MMP-9表达的关系。
1.3 统计学方法 采用SPSS10.0统计软件。计数资料比较采用四格表χ2检验、行×列表χ2检验或Wilcoxon秩和检验;相关性分析采用Spearman秩相关法。P<0.05为差异具有统计学意义。
2 结果
2.1 两组SPARC、MMP-9表达比较 SPARC主要表达于间质细胞,MMP-9主要表达于癌细胞。观察组、对照组 SPARC阳性表达率分别为 88.0%、14.1%(P <0.01),MMP-9 阳性表达率分别为69.4%、19.1%(P <0.01)。
2.2 SPARC、MMP-9表达与胃癌临床病理特征的关系 胃癌组织SPARC表达与淋巴结转移、TNM分期有关(P均<0.05),MMP-9与组织学类型、分化程度、浸润深度、淋巴结转移、TNM分期有关(P均<0.05),二者与性别、年龄、肿瘤大小、肿瘤部位及远处转移均无关(P均>0.05)。见表1。
2.3 胃癌组织中SPARC与MMP-9表达的关系胃癌组织中MMP-9与SPARC表达呈正相关(r=0.561,P <0.01)。
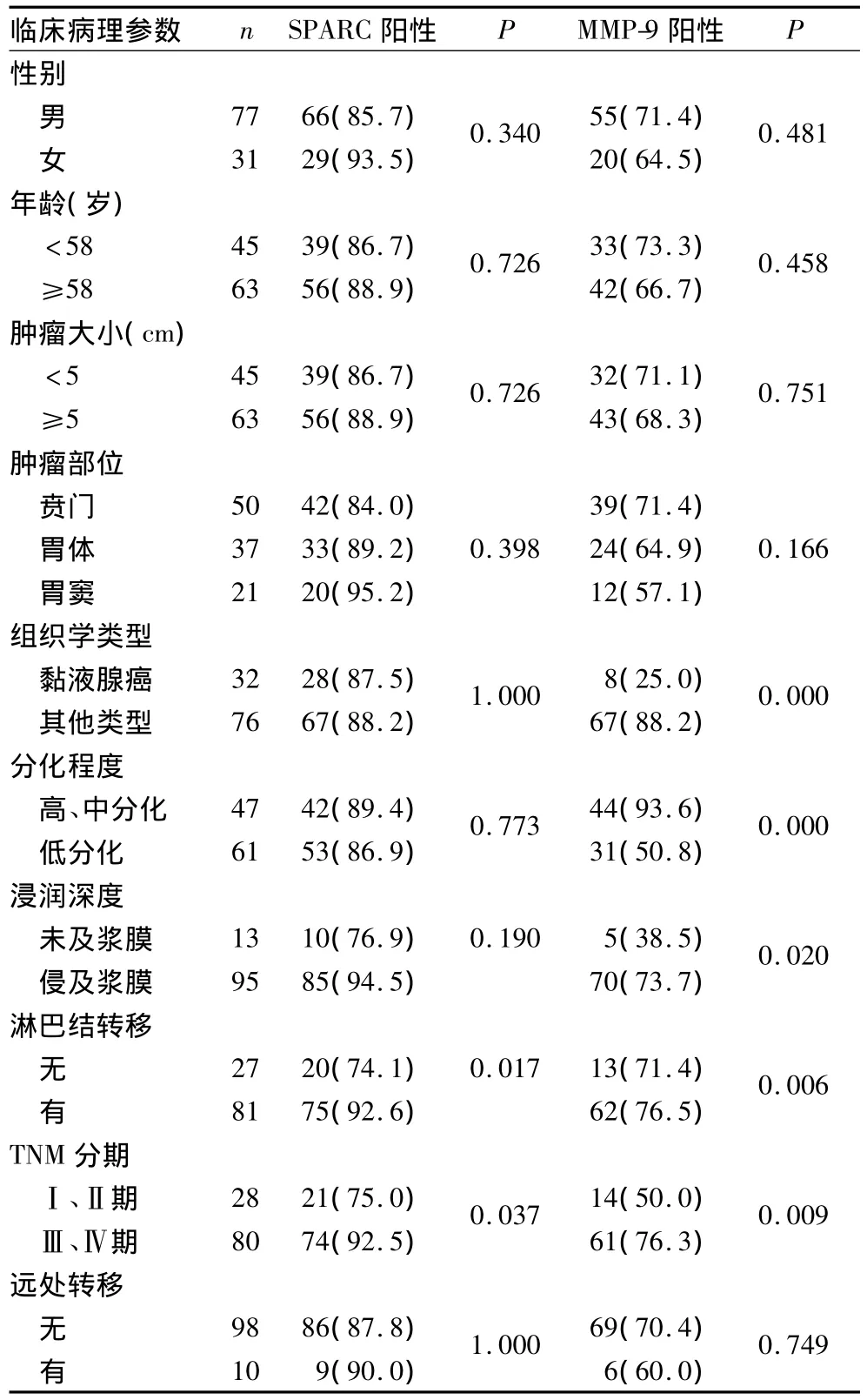
表1 SPARC、MMP-9表达与胃癌临床病理特征的关系[例(%)]
3 讨论
研究发现,在不同类型肿瘤中SPARC表达的细胞有所不同[4,5]。本研究显示,SPARC 主要表达于间质细胞,少数表达于胃癌细胞,推测可能是间质细胞合成的SPARC被肿瘤细胞内化[6]。SPARC与恶性肿瘤生物学行为密切相关的可能机制:①SPARC直接抑制一些基质蛋白的合成,改变间质的成分和结构;②间接上调基质降解酶类的合成,从而使癌细胞易于突破淋巴管和血管的基底膜而向脉管浸润;③诱导细胞变圆,发挥抗黏附作用,从而增加肿瘤细胞的侵袭能力[7,8]。SPARC 的水解产物——钙离子结合肽能刺激血管生成和细胞生长,外源性SPARC还可以降低血管生成抑制剂的浓度,促进血管生成[9]。本研究结果显示,胃癌间质细胞SPARC的阳性表达率显著高于正常胃黏膜组织,与相关文献一致[10,11],提示 SPARC 可能参与了胃癌的发生;同时,SPARC表达与淋巴结转移、TNM分期有关,提示其与胃癌的进展有关。研究证实,MMP-9参与多种肿瘤的浸润、转移,可能机制为:①去除侵袭的机械性屏障;②影响细胞间的粘连;③水解蛋白质释放某些生物活性物质;④影响多种生长因子的活性[12]。本研究发现,MMP-9表达与胃癌的组织学类型、分化程度、浸润深度、淋巴结转移、TNM分期有关,提示MMP-9与胃癌的发生、发展有关,与相关文献结论一致[13]。
肿瘤的浸润、转移涉及复杂的细胞之间以及细胞与间质之间的反应。目前认为间质成分并不是被动的,而是主动地参与肿瘤的生物学行为。SPARC作为细胞外基质成分之一,发挥抗黏附作用,使肿瘤细胞间的黏附特性消失、相互分离,更易于浸润周围组织和远处转移。SPARC能够介导外周血单核细胞表达MMP-1和MMP-9,介导成纤维细胞表达 MMP-1、MMP-3、MMP-9。车轶群等[14]报道,在乳腺癌细胞中SPARC通过上调MT1-MMP进而活化MMP-2。但在SPARC敲除小鼠腹腔内注入卵巢癌细胞后,与野生型小鼠相比可观察到MMP-2和MMP-9上调,人基质金属蛋白酶组织抑制因子1(TIMP-1)及 TIMP-2下调[15]。本研究也发现胃癌组织SPARC与MMP-9表达呈正相关。因此,我们认为胃癌组织间质细胞分泌的SPARC可能通过上述机制上调肿瘤细胞MMP-9表达,使基底膜及细胞外基质降解而发生浸润、转移。因此,进一步研究SPARC及MMP-9的相互作用及调节机制,可为阐明胃癌实质与间质之间的相互作用提供有力依据,进而为抑制胃癌的浸润和转移提供有效的途径。
[1]Rotllant J,Liu D,Yan YL,et al.Sparc(osteonectin)functions in morphogenesis of the pharyngeal skeleton and inner ear[J].Matrix Biol,2008,27(6):561-572.
[2]Arnold S,Mira E,Muneer S,et al.Forced expression of MMP9 rescues the loss of angiogenesis and abrogates metastasis of pancreatic tumors triggered by the absence of host SPARC[J].Exp Biol Med(Maywood),2008,233(7):860-873.
[3]Michael IK,Alexandra G,Rolf AB,et al.Enhanced expression of SPARC/Osteonectin in the tumor-associated stroma of non-small cell lung cancer is correlated with markers of hypoxia/acidity and with poor prognosis of patients[J].Cancer Res,2003,63(17):5376-5380.
[4]Thomas R,True LD,Bassuk JA,et al.Differential expression of osteonectin/SPARC during human prostate cancer progression[J].Clin Cancer Res,2000,6(3):1140-1149.
[5]戴芳芳,于国华,张居民,等.结直肠癌组织 SPARC和MMP-2及VEGF的表达临床意义分析[J].临床肿瘤学杂志,2014,19(3):411-416.
[6]Yiu GK,Chan WY,Ng SW,et al.SPARC(secretend protein,acidic and rich in cysteine)induces apoptosis in ovarian cancer cells[J].Am J Pathol,2001,159(2):609-622.
[7]Rotllant J,Liu D,Yan YL,et al.SPARC(Ostenonectin)function in morphogenesis of the pharyngeal skeleton and inner ear[J].Martrix Biol,2008,27(6):561-572.
[8]姬瑞,周永宁,任涛文,等.MMP-9在胃癌及其淋巴结组织中表达的临床意义[J].中国肿瘤临床,2010,37(7):377-380.
[9]毕薇薇.富含半胱氨酸的分泌型酸性蛋白与肿瘤的关系[J].国外医学:临床生物化学与检验学分册,2005,26(8):551-552.
[10]Maeng HY,Song SB,Choi DK,et al.Osteonectin-expressing cells in human stomach cancer and their possible clinical significance[J].Cancer Lett,2002,184(1):117-121.
[11]Wang CS,Lin KH,Chen SL,et al.Overexpression of SPARC gene in human gastric carcinoma and its clinic-pathologic significance[J].Br J Cancer,2004,91(11):1924-1930.
[12]王医术,倪惠杰,董晓明,等.肾癌中MMP-9、MMP-11与细胞增殖活性和血管生成的关系[J].中国实验诊断学,2009,13(5):646-648.
[13]姬瑞,周永宁,任涛文,等.MMP-9在胃癌及其淋巴结组织中表达的临床意义[J].中国肿瘤临床,2010,37(7):377-380.
[14]车轶群,王海,齐军.乳腺癌中SPARC基因差异表达分析[J].中国现代妇产科学杂志,2005,2(2):97-99.
[15]Arnold S,Mira E,Muneer S,et al.Forced expression of MMP9 rescues the loss of angiogenesis and abrogates metastasis of pancreatic tumors triggered by the absence of host SPARC[J].Exp Biol Med(Maywood),2008,233(7):860-873.
