冬季大亚湾微表层浮游植物群落结构与DNA指纹的日变化
2015-12-02马长江王朝晖梁建新
马长江, 王朝晖, 杨 雪, 梁建新
(暨南大学 生态学系 水体富营养化与赤潮防治广东普通高校重点实验室, 广东 广州 510632)
海洋微表层是位于海洋与大气之间的薄层(≤1000 μm), 与其他水层相比, 具有独特的物理、化学和生物性质, 同时也在海洋与大气之间的热量与气体交换、颗粒循环及微生物圈上扮演着重要角色[1-4]。作为海洋与大气之间相互作用的一个重要界面, 微表层对营养盐、有机化合物、重金属以及微生物、浮游生物等均具有明显富集作用[5-7]。微表层浮游植物的光合作用能改变海-气物质交换, 其群落结构则对生物地化循环产生影响[8]。由于许多无脊椎浮游动物依赖微表层浮游植物生存, 微表层浮游植物能对浮游动物产生上行效应[9]。
微表层位于水体表面, 直接与阳光接触, 水温较高, 环境因子的日变化变动剧烈[10-11], 浮游植物群落结构也会产生一定变化以适应微表层特殊、多变的环境。本课题组前期研究结果显示微表层浮游植物群落结构与水层具有一定差异, 耐高温的蓝细菌数量明显增加[2,12]。Falkowska等[13]通过对南波罗的海微表层、次表层叶绿素 a含量的日变化研究得出, 太阳辐射和紫外辐射能明显抑制叶绿素 a含量,在正午及午后叶绿素 a的含量明显降低。但是目前尚未有对微表层浮游植物群落结构及遗传多样性日变化的研究报道, 本文通过对大亚湾大鹏澳海域微表层、次表层浮游植物群落结构的日变化进行分析,并利用PCR-DGGE技术研究了浮游植物DNA指纹图谱, 以揭示微表层以及次表层浮游植物群落结构的日变化规律。
1 材料与方法
1.1 采样位点的设置与样品的采集
在大亚湾海域设置了 3个采样位点(图 1), 于2013 年 12 月 3 日清晨(6:00)、正午(12:00)、傍晚(18:00)采集了微表层和次表层水样, 三个站位的微表层和次表层样品分别以W1、W2、W3以及C1、C2、C3表示。微表层样品的采集采用筛网法, 将孔径为1.0 mm的不锈钢网筛镶在40 cm×50 cm的铝框中, 将筛网取样器水平没入海面下, 然后轻轻提起, 将筛网垂直竖起, 附在网格上的水膜逐渐脱离网格, 微表层水样流入样品瓶中。重复此过程直至收集到所需的水样体积, 取样量除以取样次数和筛板表面积可得微表层厚度(200 μm±10 μm)。次表层水样用 5LWB-PM有机玻璃采水器采集离水面0.5 m的水样。

图1 大亚湾采样点的设置Fig.1 Sampling stations in Daya Bay
采集微表层、次表层水样500 mL, 用4%的福尔马林固定, 经沉淀浓缩至20 mL, 用于进行浮游植物定性定量。采集水样 3 L, 用 1.5%的鲁格试剂固定,用孔径1.2 μm的Millipore RTTP滤膜进行抽滤, 滤膜保存于-20℃, 用于浮游植物总DNA的提取。
1.2 环境参数的测定
用ProPlus型YSI仪以及Digital Luxmeter ZDS-10W照度仪现场测定水温、盐度、溶解氧、电导率、pH值以及光照强度。
1.3 浮游植物的分析鉴定
浮游植物的定性定量分析是在莱卡 DMIRB显微镜下进行, 取 0.1mL经过固定浓缩的样品, 根据海洋浮游植物分类学相关资料[14-15], 对浮游植物进行定性定量分析, 大部分浮游植物鉴定至种, 不能确定的种类鉴定至属。每个样品至少观察两次, 计数100个以上细胞, 浮游植物细胞密度以个/L表示。
1.4 浮游植物总DNA的提取与PCR扩增
采用上海生工的 UNIQ柱式植物基因组提取试剂盒提取浮游植物总DNA, 经Nanodrop 2000/2000C检测 DNA的浓度及纯度, 用 1%的琼脂糖凝电泳胶检测提取效果后4℃保存备用。
PCR扩增区域为18S rDNA V3区片段, 用真核生通用引物对18S rDNA进行PCR扩增, 上下游引物分别为 Euk1209f-GC(5'-CGCCCGGGGCGCGCCC CGGGCGGGGCGGGGGCACGGGGGG-3')和Uni1392r(5'-ACGGGCGGTGTGTA C-3')[16], 由上海生工生物工程技术服务有限公司合成。PCR反应在 Applied Biosystems verityTMPCR仪中进行, 反应体系为40 μL,包括 4 μL 10×反应缓冲液、0.8 μL上、下游引物(10 μmol/L)、1.2 μL dNTPs(10 mmol/L)、0.6 μL Taq DNA 聚合酶(5 U/μL)、模板量 1.5 μL, 最后以 ddH2O补足体积。本实验采用降落PCR, 反应条件为94℃1 min, 94℃变性1 min, 65℃退火2 min, 72℃延伸2 min,共10个循环(每个循环退火温度降低1℃); 94℃变性7 min; 55℃退火 1 min, 72℃延伸3 min, 20个循环,最后72℃延伸7 min。用1%的琼脂糖凝电泳胶检测PCR产物, 其目的片段大小为210 bp, 大小均一, 符合DGGE电泳扩增范围(200~600 bp)。
1.5 DGGE分析
在 Bio-Rad公司的 DcodeTM通用突变检测系统对PCR产物(40 μL)进行DGGE分析。条件为: 丙烯酰胺质量分数8%, 变性梯度30%~70%(100%的变性剂浓度为 7 mol/L尿素和质量分数 40%去离子甲酰胺), 先用100 V电压电泳2 min, 然后再用100 V电压电泳16 h, 缓冲液为1×TAE, 电泳结束后用SYBR GREEN I染色30 min, 用 Bio-Rad公司凝胶成像系统(Gel Doc 2000TM)进行拍照。
1.6 计算与数据分析
1.6.1 富集系数与富集率
微表层浮游植物的富集系数(Enrichment factor,EF)定义为微表层浮游植物细胞密度与同一站位次表层浮游植物细胞密度之比, 富集率则为富集系数大于1.0的样品所占的百分比。
1.6.2 数据处理与分析
DNA指纹图谱用Quantity one软件进行带型分析, 条带光密度值强度低于 0.05被排除。将浮游植物细胞密度进行了自然对数转换, 用SPSS19软件采用组间联接、平方Euclidean距离的度量方法对3个站位微表层、次表层样品进行聚类分析, 并对清晨、正午、傍晚及微表层与次表层浮游植物群落结构进行显著性差异分析。
2 结果
2.1 环境参数的变化
由表 1可以看出, 光照强度遵循一天中由弱到强到弱的变化趋势, 微表层光强远高于次表层(P<0.05), 由于采样时间的不一致, 清晨最后采样的St.3光照强度明显高于其他两个站点, 而傍晚则以St.1的光强最高。三个站点水温相近, 正午最高, 清晨较低, 为 18.8~20.3℃之间; 微表层的盐度和电导率明显低于次表层, 溶解氧含量明显高于次表层,其余参数在微表层和次表层之间没有明显变化。

表1 大亚湾海域微表层和次表层水环境参数的日变化Tab.1 Daily changes of the environment parameters in the surface microlayer (SML) and subsurface water (SSW) from Daya Bay
2.2 DNA指纹图谱
DNA指纹图谱清晰, 各站位不同时间浮游植物DNA指纹条带基本相近, 同时又具有一定差异(图2)。DGGE图谱带型图则能更清楚地反映各站位DNA指纹条带数以及优势种的分布规律(图3), 其中傍晚条带数最为丰富, 共有 41个条带, 清晨和正午的条带数分别为23条、28条。
在同一时刻样品中的优势种和常见种基本上相近, 如条带1、2、4、5、9、18是清晨样品中的常见条带, 在所有站位中均大量出现(图 3A); 正午样品的DNA指纹较为丰富, 条带4、7、14、15、20为常见优势条带(图 3B); 傍晚条带更为丰富多元, 条带2、4、6、13、25为常见优势条带(图3C), 条带16、19、23和27也在所有样品中出现。样品DNA指纹条带数为 12~28条(图 4), 微表层略高于次表层, 平均分别为18.8条和18.1条, 其中W2的条带数较为丰富。傍晚条带较为丰富, 为 19~28条, 平均为 22条, 明显高于清晨与正午(P<0.05); 正午与清晨DNA 指纹条带相近, 差异不显著 (P>0.05), 平均条带数分别为17.8条和15.7条。
2.3 浮游植物群落结构
在本次调查中, 共分析观察到浮游植物 79种,微表层和次表层浮游植物种分别为61种、68种, 清晨、正午和傍晚观察分别为 49种、61种、51种。每个样品观察到 26~40种, 其中微表层和次表层平均分布为32.3种和33.9种, 两者之间没有明显差异(P>0.05); 清晨、正午和傍晚每个样品所观察到的种类数也没有明显差别(P>0.05), 平均分别为30.8种、35.2种、33.3种。
硅藻是本次调查的绝对优势类群, 优势硅藻主要包括角毛藻(Chaetocerosspp.)、中肋骨条藻(Skeletonema costatum)、丹麦细柱藻(Leptocylindrus danicus)、菱形海线藻(Thalassionema nitzschioides)以及拟菱形藻(Pseudo-nitzschiaspp.)等, 其中角毛藻的种类较丰富, 主要为扭链角毛藻(Chaetocerostortissimus)、洛氏角毛藻(C. lorenzianus)、扁面角毛藻(C. compressus)、窄隙角毛藻(C. affinis)等。优势甲藻主要为原甲藻类, 如反曲原甲藻(Prorocentrum sigmoides)和海洋原甲藻(P.micans)等。
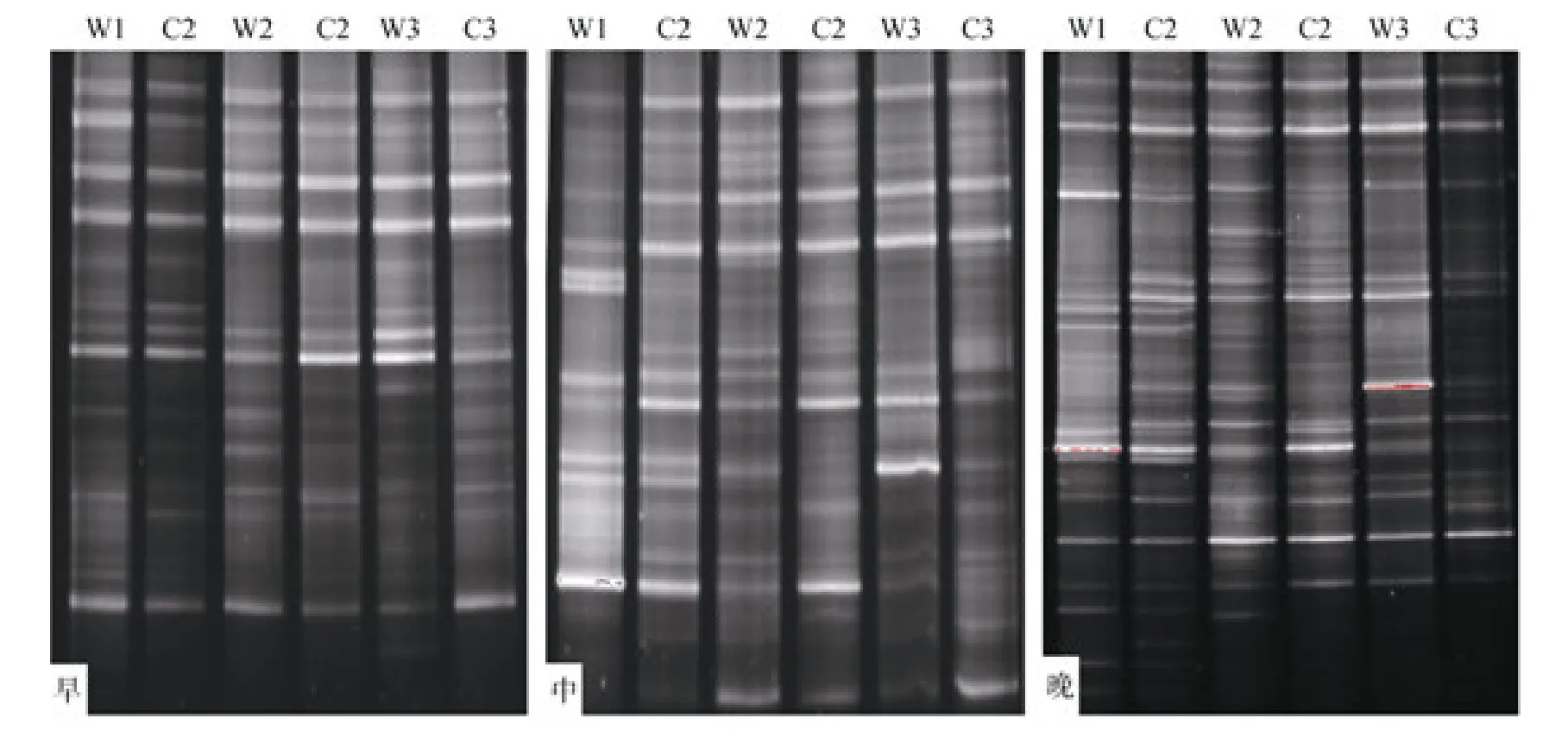
图2 大亚湾微表层和次表层浮游植物18S rDNA V3 区DGGE图谱Fig.2 The DGGE fingerprints of V3 region of 18S rDNA of phytoplankton in the SML and SSW from Daya Bay

图3 浮游植物DGGE图谱分析带型图Fig.3 DGGE profiles of 18S rDNA V3 region of phytoplankton
在一天的调查中, 浮游植物密度变化范围在4.6×105~4.0×106个/L, 平均为 1.5×106个/L。浮游植物细胞密度的日变化不显著(P>0.05, 图5), 清晨、正午和傍晚的平均细胞密度分别为1.2×106、1.6×106、1.6×106个/L; 微表层和次表层间差异也不显著(P>0.05), 平均细胞密度分别为 1.7×106个/L 和1.2×106个/L。本次调查中, 虽然正午和傍晚微表层浮游植物细胞密度高于次表层, 特别是 W3正午细胞密度明显高于其余样品, 但微表层和次表层之间无显著性差异(P>0.05)。
微表层和次表层浮游植物均以硅占据绝对优势,硅藻所占比例均在98%以上。此外还有少量的甲藻,而其他类别的浮游植物甚少出现(图 6)。整体来说,清晨 6: 00的样品中硅藻百分比含量较高, 达到99.6%, 基本上没有其他类别的浮游植物出现; 正午和傍晚甲藻出现的数量增加(图 6A)。微表层硅藻的百分比含量也高于次表层(图 6B), 甲藻和其他藻类在次表层百分比含量增加。
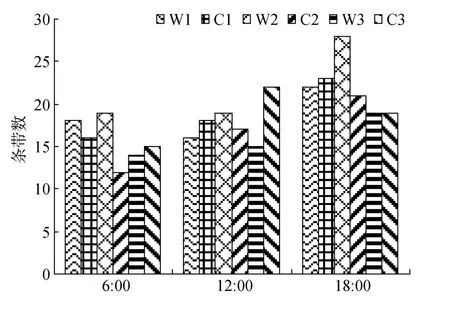
图4 浮游植物DNA指纹条带数的日变化Fig.4 DNA fingerprints of 18S rDNA V3 region of phytoplankton

图5 大亚湾微表层和次表层浮游植物总细胞密度的日变化Fig.5 Cell density of total phytoplankton in the SML and SSW from Daya Bay
2.4 浮游植物群落聚类分析
图7为浮游植物群落结构的聚类分析图, 清晨(图 7A)、正午(图 7B)和傍晚(图7C)浮游植物聚类结果都可明显看出St.1和St.2的微表层与次表层样品分别聚集在一起, 而St.3则单独成一类。在全天的浮游植物聚类中(图 7D), 大部分站位的微表层和次表层样品以较小的距离聚集成一大类, 但是 St.3的 5个样品未与其余样品聚在一起, 特别是 W3正午和傍晚样品与其他样品距离较远。结果说明大亚湾海域微表层和次表层浮游植物群落结构比较相近, 站位间的差异大于微表层和次表层之间的差异, 而且相对较为离岸的St.3与近岸的St.1和St.2差异较大。
2.5 微表层对浮游植物的富集作用
由表2可以看出, 微表层对总浮游植物、硅藻以及优势硅藻种类的富集系数均在1.0以上, 富集率均超过了 66.7%; 但是微表层仅在清晨对甲藻具有较高的富集作用, 在正午和傍晚均无富集作用。角毛藻、中肋骨条藻和丹麦细柱藻是大亚湾海域优势硅藻, 在所有样品中均出现, 它们对浮游植物总数的贡献超过了 70%, 微表层对这三种优势硅藻均具有明显的富集作用, 其中对中肋骨条藻和丹麦细柱藻的富集系数分别高达 4.20和 5.47, 富集率均为100%。

图6 大亚湾海域各类别浮游植物的数量百分比组成Fig.6 The quantitative percentages of different groups of Phytoplankton
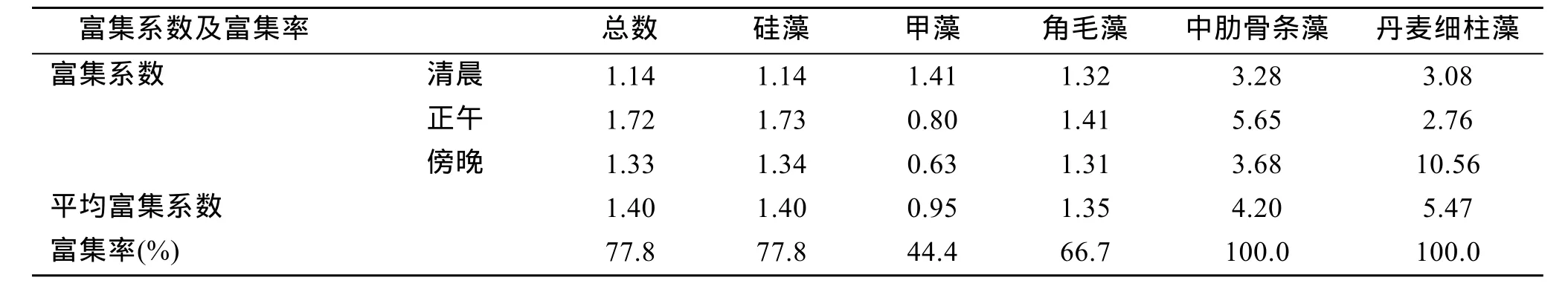
表2 大亚湾海域微表层对浮游植物的富集系数与富集率Tab.2 The enrichment factor (EF) and enrichment frequency (%) of the SML on phytoplankton

图7 浮游植物群落结构的聚类分析Fig.7 Clustering dendrogam of sampling stations based on phytoplankton community
2.6 浮游植物种类与DNA指纹条带的比较
图8对浮游植物DGGE指纹条带数以及显微镜下观察分析的浮游植物种类数进行了比较。结果显示, 所有站位样品中, DNA指纹条带数均低于显微镜下观察分析得到的浮游植物种类数, 并且正午和傍晚浮游植物种类数和DNA指纹条带数较为丰富。微表层平均 DNA指纹条带数 18.9条, 平均种类为32.3种; 次表层平均DNA指纹条带数为18.1条, 平均种类33.9种, 条带数仅为种类数的60%左右。
如果剔除数量上小于 0.1%的浮游植物种类数,种类数仍高于 DNA 指纹条带数(图 8); 如果剔除数量上小于 0.5%的浮游植物种类数, 则指纹条带数与优势种的种类数相近; 如果剔除了在数量上小于1%的浮游植物种类数, DNA指纹条带数高于优势浮游植物种类数, 而且各样品之间优势浮游植物种类数相差不大。DNA指纹条带数、浮游植物种类数以及>0.1%、>0.5%、>1%浮游植物优势种种类数的平均值分别为22条、33种、27种、16种、11种。
3 讨论
与前期研究结果相近[2], 大亚湾浮游植物种类和数量均较为丰富, 一天调查分析中就鉴定出浮游植物 79种, 平均细胞密度为 1.5×106个/L。由于大亚湾地处亚热带海域, 冬季水温较高, 同时临近大亚湾和岭澳两个核电站, 温排水的排放也致使大亚湾冬季水温的上升[17], St.3由于更靠近核电站, 水温均高于其他站位。有研究表明, 较高的水温在冬季更有利于浮游植物的生长[18], 本研究中 St.3细胞密度均高于其他两个站位, 而前期研究也显示大亚湾海域浮游植物密度几乎在每年在冬季都出现高峰值[19]。
微表层被认为是在海洋表面的一种亲水性胶质膜[20-21], 风浪容易导致微表层胶质膜的破裂, 使微表层与次表层产生混合[22]。在本研究中, 微表层和次表层浮游植物群落结构较相近, 无显著性差异(P>0.05), 而且在聚类分析中同一站位或者相近站位会聚集在一起, 说明大亚湾海域微表层和次表层浮游植物混合均匀。小型鞭毛藻类和硅藻被认为是温带近岸海域微表层浮游植物的主要组成成分[9]。在本研究中, 硅藻也是大亚湾微表层和次表层的绝对优势种类, 而甲藻等鞭毛藻类则在微表层出现较少。

图8 DNA指纹条带数与浮游植物种类数的比较Fig.8 Comparison between DNA fingerprints and species richness of phytoplankton.
微表层对有机物、重金属、营养盐、生物代谢物以及细菌、光合色素等具有很强的富集作用, 对某些物质的富集系数甚至高达几个数量级[23]。在本研究中,微表层对总浮游植物、硅藻以及角毛藻、中肋骨条藻、丹麦细柱藻等优势硅藻均具有明显的富集作用, 而对甲藻没有富集作用。分析其原因, 首先是因为大亚湾海域的浮游植物是一个由硅藻占据绝对优势的群落, 在以往的大量调查中硅藻的年均百分比含量均超过90%,而且常常形成冬季硅藻水华; 其次, 微表层中较高的营养盐以及光照强度也是其对小型硅藻产生富集作用的重要原因[23]; 此外本研究是通过光学显微镜观察来分析浮游植物种类和数量, 可能有少数小型鞭毛藻类(<10 μm), 由于体型过小, 在显微镜分析中被忽略。
虽然有文献报道正午和下午高强度辐射以及紫外辐射能对微表层和次表层浮游植物的色素体产生伤害作用, 导致在正午和午后微表层和次表层叶绿素a含量的下降[13]。但在本研究中, 清晨、正午和傍晚浮游植物种类及数量没有明显差别(P>0.05), 浮游植物日变化不明显; DNA指纹条带数也仅在清晨明显较低(P<0.05), 然而正午微表层对总浮游植物以及硅藻的富集系数较高。出现这种现象可能是由于本次调查为冬季, 正午日照强度虽然也较高, 微表层光强达到820~1196 μE, 但由于其紫外强度较弱, 高强度日照时间较短, 尚未达到抑制浮游植物生长的程度, 此外次表层正午甲藻数量的增加也在一定程度上说明正午的高日照强度促进了浮游植物的生长。
大亚湾冬季浮游植物 DNA指纹条带比较丰富,但是DNA指纹条带数均远低于显微镜下观察分析得到的浮游植物种类数, 条带数仅为种类数的 60%左右。一方面可能是因为在利用Quantity one软件分析DNA指纹图谱时, 会将光密度值强度低于0.05的条带剔除。另一方面可能是因为DNA在PCR扩增过程中, 一些稀有种类的 DNA含量少, 浮游植物优势种类对其产生屏蔽作用, 而且在电泳过程中容易发生共迁移现象[24]。在本调查中, 浮游植物群落均是由一种或者两种硅藻占据绝对优势, 从而导致在PCR-DGGE分析中对其他非优势种的屏蔽作用相对更强。但是如果剔除数量上小于0.5%的浮游植物种类数,指纹条带数则与优势种的种类数相近, 结果说明PCR-DGGE技术能较大程度地反映浮游植物优势种群的组成, 而对于相对含量较少的物种可能会由于优势种的屏蔽作用而被掩盖, 对浮游植物种类的检测灵敏度为优势度0.5%。此外尚需结合荧光定量PCR以及切胶测序等方法对浮游植物群落结构进行定性定量分析。由此说明PCR-DGGE技术在分析浮游植物群落结构上具有一定的可行性, 但传统的显微镜分析方法仍是浮游植物群落结构研究中最为可靠的方法之一。
微表层的采样有很多种方法[25-26], 包括玻璃板法(采集厚度 40~60 μm)、金属筛网法(200~400 μm)、平滑采样器(1 000~2 000 μm)以及转筒采样器(70~100 μm),取样方法的不同, 所取得的样品厚度也有所不同,可能会对分析结果产生一定的影响[17]。但是研究显示, 不同的采样方法对芳香烃[25]及多氯联苯类[26]在微表层的富集没有明显影响, 其中筛网法可以适应不同的气候条件, 是较为理想的微表层采样方法[26]。在本研究中采用筛网法采集微表层水样, 采集的是厚度为200 μm以内的微表层水样, 这部分微表层水样中不仅包括浮游植物, 也包括了浮游细菌以及一些小型浮游动物。此外, 风浪也影响微表层膜的形成,风速为5~10 m/s下对微表层影响不大, 但是超过12 m/s的风速可以破坏微表层, 水华也可导致微表层的破坏[22]。大亚湾属于半封闭内湾, 风浪较小, 在没有降雨和藻华的情况下微表层应保存完好。
4 结论
1) 大亚湾海域浮游植物种类、数量以及 DNA指纹均较丰富, 硅藻占据绝对优势; 清晨、正午和傍晚浮游植物种类和数量无明显差异, 浮游植物群落结构日变化不明显。
2) 虽然微表层与次表层浮游植物群落结构相近,但微表层对浮游植物具有较好的富集作用, 对硅藻以及优势硅藻种类的富集作用较为明显, 其中对中肋骨条藻及丹麦细柱藻的富集率高达100%, 而对甲藻的富集作用却不明显。
3) 传统的显微镜分析方法仍是浮游植物群落结构研究中最为可靠的方法之一, 但是一些微微型浮游植物很难在显微镜下准确鉴定, PCR-DGGE技术能快速、准确地反映数量百分比在0.5%以上的浮游植物优势种的DNA指纹图谱。
[1] Liss P S, Duce R A. The Sea Surface and Global Change[M]. Cambridge: Cambridge University Press, 1997.
[2] Wang Z H, Song S H, Qi Y Z. A comparative study of phytoneuston and the phytoplankton community structure in Daya Bay, South China Sea[J]. Journal of Sea Research, 2014, 85: 474-482.
[3] Wurl O, Holmes M. The gelatinous nature of the sea-surface microlayer[J]. Marine Chemistry, 2008,110(1): 89-97.
[4] Reinthaler T, Sintes E, Herndl G J. Dissolved organic matter and bacterial production and respiration in the sea-surface microlayer of the open Atlantic and the western Mediterranean Sea[J]. Limnology and Oceanography, 2008, 53(1): 122-136.
[5] 王朝晖, 杨宇峰, 宋淑华, 等. 大亚湾海域营养盐的季节变化及微表层对营养盐的富集作用[J]. 环境科学学报, 2011, 31(2): 307-315.
[6] Joux F, Agogué H, Obernosterer I, et al. Microbial community structure in the sea surface microlayer at two contrasting coastal sites in the northwestern Mediterranean Sea[J]. Aquatic Microbial Ecology, 2006, 42(1): 91-104.
[7] Cincinelli A, Stortini A M, Checchini L, et al. Enrichment of organic pollutants in the sea surface microlayer (SML)at Terra Nova Bay, Antarctica: influence of SML on superficial snow composition[J]. Journal of Environmental Monitoring, 2005, 7(12): 1305-1312.
[8] Frew N M, Bock E J, Schimpf U, et al. Air- sea gas transfer: Its dependence on wind stress, small- scale roughness, and surface films[J]. Journal of Geophysical Research: Oceans (1978-2012), 2004, 109(C8).
[9] Montes-Hugo M A, Alvarez-Borrego S. Differences in photosynthetic pigment signatures between phytoneuston and phytoplankton communities in a coastal lagoon of Baja California[J]. Marine Biology, 2007, 151(4): 1225-1236.
[10] Kuznetsova M, Lee C, Aller J, et al. Enrichment of amino acids in the sea surface microlayer at coastal and open ocean sites in the North Atlantic Ocean[J].Limnology and oceanography, 2004, 49(5): 1605-1619.
[11] Lindroos A, Szabo H M, Nikinmaa M, et al.Comparison of sea surface microlayer and subsurface water bacterial communities in the Baltic Sea[J].Aquatic Microbial Ecology, 2011, 65(1): 29-42.
[12] 宋淑华, 王朝晖, 付永虎, 等. 大亚湾大鹏澳海域微表层浮游植物群落研究[J]. 海洋环境科学, 2009,28(2): 181-185.
[13] Falkowska L, Pryputniewicz D, Magulski R, et al. The impact of solar radiation on changes in chlorophyll a concentration in the sea surface microlayer in the southern Baltic[J]. Oceanological and Hydrobiological Studies, 2005, 34: 109-123.
[14] 郭玉洁, 钱树本. 中国海藻志[M]. 第 5卷. 北京: 科学出版社, 2003: 11-447.
[15] Fukuyo Y, Takano H, Chihara M, et al. Red tide organisms in Japan: an illustrated taxonomic guide[M].Tokyo: Uchida Rokakuho, 1990.
[16] van Hannen E J, van Agterveld M P, Gons H J, et al.Revealing genetic diversity of eukaryotic microorganisms in aquatic environments by denaturing gradient gel electrophoresis[J]. Journal of Phycology, 1998, 34(2): 206-213.
[17] Tang D L, Kester D R, Wang Z, et al. AVHRR satellite remote sensing and shipboard measurements of the thermal plume from the Daya Bay, nuclear power station, China[J]. Remote Sensing of Environment,2003, 84(4): 506-515.
[18] 王朝晖, 陈菊芳, 徐宁, 等. 大亚湾澳头海域硅藻、甲藻的数量变动及其与环境因子的关系[J]. 海洋与沼, 2005, 02: 186-192.
[19] Zhaohui W, Jiangang Z, Zhang Y, et al. Phytoplankton community structure and environmental parameters in aquaculture areas of Daya Bay, South China Sea[J]. Journal of Environmental Sciences, 2009, 21(9): 1268-1275.
[20] Sieburth J M N. Microbiological and organic-chemical processes in the surface and mixed layers[M]//Air-sea exchange of gases and particles. Springer Netherlands,1983: 121-172.
[21] Wurl O, Holmes M. The gelatinous nature of the sea-surface microlayer[J]. Marine Chemistry, 2008,110(1): 89-97.
[22] Wurl O, Wurl E, Miller L, et al. Formation and global distribution of sea-surface microlayers[J]. Biogeosciences,2011, 8(1): 121-135.
[23] 王文涛. 中国东海、黄海和渤海微表层营养盐分布及富集研究[D].青岛: 中国海洋大学.2013.
[24] Neilson J W, Jordan F L, Maier R M. Analysis of artifacts suggests DGGE should not be used for quantitative diversity analysis [J]. Journal of microbiological methods, 2013, 92(3): 256-263.
[25] Guitart C, Garcı́a-Flor N, Dachs J, et al. Evaluation of sampling devices for the determination of polycyclic aromatic hydrocarbons in surface microlayer coastal waters[J]. Marine pollution bulletin, 2004, 48(9): 961-968.
[26] Garcıa-Flor N, Guitart C, Bodineau L, et al. Comparison of sampling devices for the determination of polychlorinated biphenyls in the sea surface microlayer[J].Marine environmental research, 2005, 59(3): 255-275.
