多维度动态增强核磁共振乳房区域全自动分割
2015-12-02
(杭州电子科技大学生命信息与仪器工程学院,浙江 杭州310018)
0 引 言
乳房影像是检测和诊断乳腺癌的主要方法。乳房动态对比增强磁共振成像(Dynamic Contrastenhanced Magnetic Resonance Imaging,DCE-MRI)具有乳房腺体及脂肪组织的对比度高以及能够将乳房的三维结构特性呈现等优点,使其在乳腺癌影像检查方面得到了广泛的应用。研究表明,计算机辅助诊断分析能够利用乳房MRI 图像中的大部分信息[1-2],而该方法首要的问题便是乳房区域的分割。乳房区域分割主要难点有:首先,从影像角度来看,腺体组织与胸大肌之间的信号强度相似,使得精确定位乳房与胸大肌的分界面的位置变得很困难;其次,当腺体组织与胸大肌相粘连时,会导致双乳与胸大肌的分界面难以准确定位。针对乳房核磁共振图像(Magnetic Resonance Imaging,MRI)的分割问题,许多学者做了大量的工作,多种乳房分割方法已见报道[3-4]。文献[5]提出在二维水平面中,用交互方式选取垂直于乳房的平面,在此基础上进行分割。该方法处理简单,效果稳定,但缺点是需人机交互。文献[6]根据乳腺MRI 灰度阈值和梯度大小绘制的直方图来分割乳腺组织。但该方法分割得到的边界不清晰且需准确定位乳头位置。综合各学者提出的乳房分割方法,针对乳房核磁共振(Magnetic Resonance,MR)序列图像的特点以及目前分割方法存在的不足,本文提出一种将乳腺MRI 水平面与矢状面相结合的乳房区域全自动分割的方法。
1 成像设备与实验材料
本文进行实验的乳腺DCE-MRI 影像数据由浙江省肿瘤医院放射科提供,利用西门子公司3.0T的MRI 扫描设备及专用乳腺相控阵线圈进行DCE-MRI 图像的采集。检查过程中,患者取俯卧位,双手平放在身体两侧,双侧乳房充分暴露,自然垂入乳房相控阵线圈。平扫采用轴位、矢状位常规FSE 序列T1WI(非脂肪抑制模式和脂肪抑制模式)及脂肪抑制FSE 序列T2WI。由于非脂肪抑制序列图像中脂肪的灰度值比腺体和肌肉组织的高,且灰度均一性较好,所以包含大量脂肪的乳房区域在非脂肪抑制序列图像上易于分割提取。实验所用数据共24例病例,都是在非脂肪抑制序列上进行的。
2 分割方法
在进行核磁共振扫描时,病人被要求取俯卧位趴在刚性支撑平台上进行检查;故双乳之间前胸区域由于与刚性支撑平台挤压导致皮肤呈现一个规则的平面形态,在影像上表现为该区域与空气的边界处通常呈直线形。基于此,本方法根据前胸的边缘位置引用分区思想将原始图像分成乳房区域和胸腔区域,两部分要处理分割方法不同,因此需要在两个区域内进行相应独立的处理。乳房分割流程如图1所示。在乳房上边缘提取时,由于灰度对比明显,分割难度小,因此采用快速简单的灰度阈值处理完成。在乳房与胸大肌分界面提取上,由于各组织灰度值接近,分割难度大,分割方法复杂,将在下面详述。
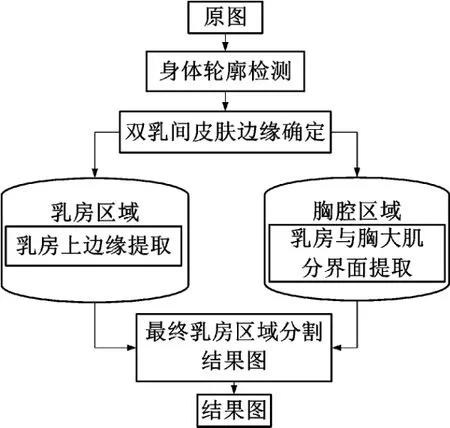
图1 乳腺分割流程图
2.1 乳房外边缘提取
由于乳房外边缘附近区域空气灰度值远小于乳房和胸腔灰度值,根据乳房外边缘附近的灰度直方图选取阈值,确定乳房外边缘。
2.2 乳房与胸大肌分界面提取
乳房与胸大肌分界面提取流程如图2所示。
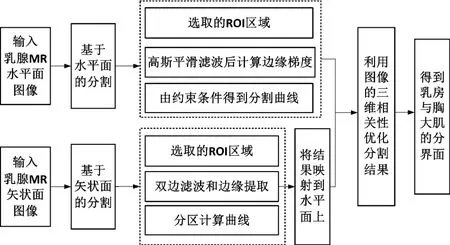
图2 乳房与胸大肌分界面提取流程
2.2.1 乳腺MR 水平面分割
乳腺MR 水平面分割的步骤如下:1)读入乳腺MR 水平面图像;2)双乳间皮肤边缘检测,确定感兴趣区域(Region of Interest,ROI)范围;3)高斯平滑滤波后计算边缘梯度;4)根据乳房与胸大肌分界面的特点设定约束条件得到分割曲线。
2.2.1.1 双乳间皮肤边缘检测确定ROI范围
在进行核磁共振扫描时,病人被要求以俯卧位趴在刚性支撑平台上进行检查;故双乳之间前胸区域由于与刚性支撑平台挤压导致皮肤呈现一个规则的平面形态,在影像上表现为该处通常呈直线形(记为HL),因此,用霍夫变换在该处检测出HL,然后将HL 上移若干个像素,得到ROI的上限位置。ROI的下限位置根据设定的宽度参数α 得到,如图3(a)所示。经过大量实验表明,当α为150时,选取的ROI 区域能够包含所有病例乳房与胸大肌分界面的范围,如图3(b)所示。再经过梯度算法得到的结果如图3(c)所示,最后经过约束条件选择得到的乳房与胸大肌的分割线如图3(d)所示。

图3 横切面分割流程示例
2.2.1.2 根据乳腺与胸大肌分界面的特点设定约束条件得到分割曲线
由于胸大肌是一个较大的组织,其边界的横向长度要远大于ROI 区域内其他零散组织边界的横向长度;同时考虑到当腺体组织与胸大肌相粘连时会出现分界面不连续的情况。首先提取图像中横向长度最长的曲线,然后挑选该曲线左(右)边终点与最长曲线右(左)边终点距离为±β 像素(β 取20)。将得到的两条曲线进行B样条拟合,拟合参数k为3。得到如图3(d)所示结果。
2.2.2 乳腺MR 矢状面分割
乳腺MR 矢状面分割步骤如下:1)读入乳腺MR 矢状面图像;2)选取ROI 区域;3)双边滤波对图像预处理;4)边缘提取,分区计算分割曲线。
2.2.2.1 选择ROI 区域
为了与水平面的分割相对应,矢状面ROI范围与水平面ROI范围一致。首先,设定矢状面上ROI的起始位置为矢状面图像中人体左右对称轴的位置。然后根据水平面中α 设定的大小,确定矢状面ROI的终止位置。
2.2.2.2 边缘提取,分区计算分割曲线
将每侧乳房图像均分为5 份。对每份图像做如下处理:使用Canny 边缘检测算法提取边缘,找到纵向最长曲线。将每份中每张图像得到的最长曲线叠加到一张二维图像上得到最长曲线簇如图4(a)所示。每个最长曲线簇经过中值滤波后横向取平均得到参考曲线如图4(b)所示。然后,在提取边缘得到的图像中寻找与参考曲线两端的空间距离不大于12 像素且斜率大于3[7]。将该曲线组进行B样条拟合。得到如图4(c)所示结果。
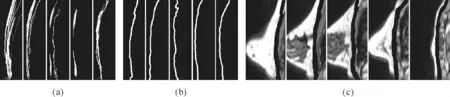
图4 矢状面分割流程示例
2.2.3 水平面与矢状面相分割结果相结合
本文所用水平面图像的空间分辨率为896×896 像素,共72 张,每张厚度为1.20 mm,而矢状面图像空间分辨率为450×896 像素,共896 张,每张厚度为0.19 mm。将矢状面断层图像的分割结果映射到水平面断层上时,由于两个图像的三维矩阵大小不一样,因此将矢状面的图像每隔6 行抽样一次。再将其映射到水平面上,与水平面的分割结果结合如图5(a)所示。
人体胸部是一个三维实体,胸部每张图像上的像素与其相邻图像的像素之间存在空间邻域关系。因此,将图像的三维信息引入,利用图像之间的三维相关性优化分割结果。具体处理步骤如下所述。
经过上述处理以后,找出所有曲线之中横向长度最长的那根(记为LC)。以LC为参照挑选出满足以下约束条件的曲线:1)横跨图像的左右对称轴;2)该曲线位于对称轴左(右)边部分的长度≥0.6×LC曲线位于对称轴左(右)边部分的长度。若有曲线不满足条件,则去除,用符合条件的相邻曲线代替。图5(c)为图5(b)用该方法进行优化后的结果,图5(e)为图5(c)用该方法进行优化后的结果。
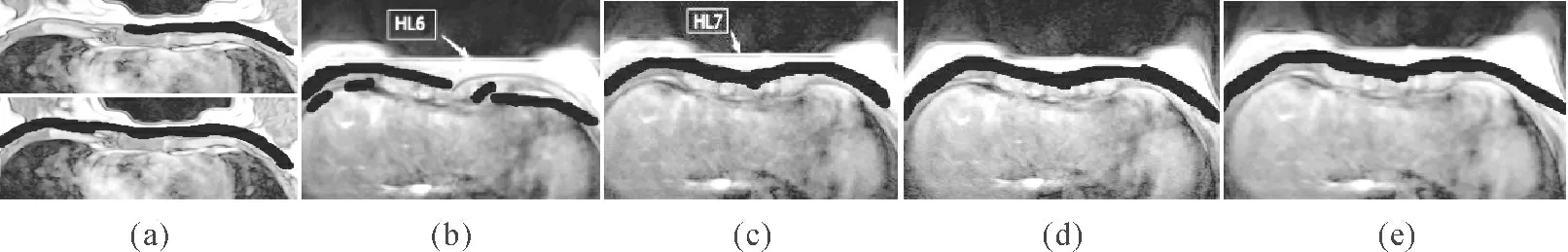
图5 分割结果优化示例
3 实验结果
为了评价本文分割方法在乳腺MRI 序列图像上的分割效果,采用将本文自动分割方法得到的结果与使用ITK-SNAP[8]软件手动分割得到的金标准结果进行对比。采用计算分割曲线Dice 系数(DSC)重叠率百分比(OP)和差异度(DP)[9]进行定量评价。其中sa,sb分别表示本方法和手动分割得到双乳的体积,∩表示sa和sb的交集运算,即取两个方法各自分割得到的乳房重叠处的体积,⊕表示sa和sb进行异或运算,即取两个方法各自分割得到的乳房不重叠处的体积。
24例病例手动分割与自动分割得到的双乳体积和这两种分割方法得到的重叠率与差异度比较如表1所示。
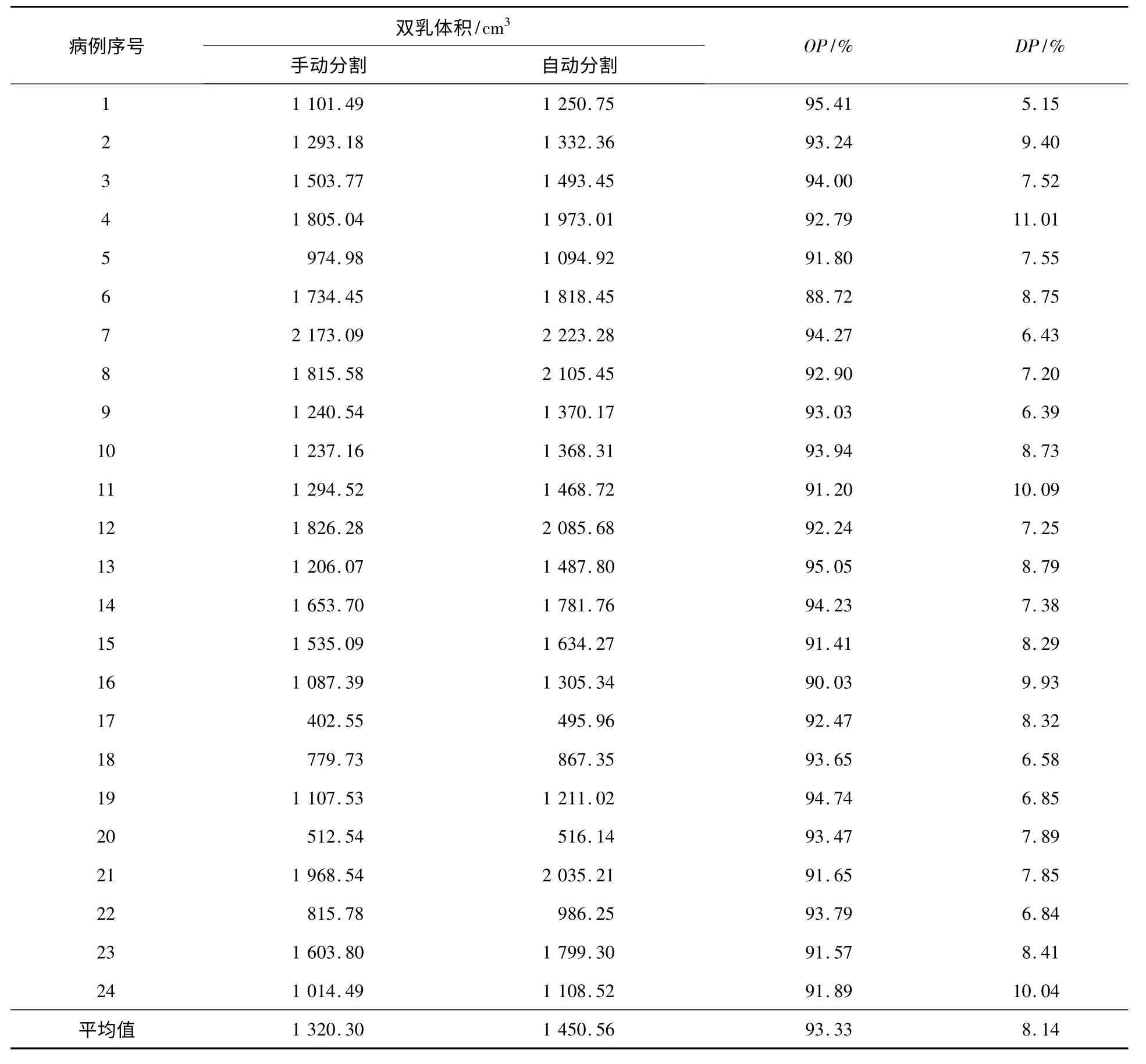
表1 自动分割与手动分割方法相关数据比较
通过自动分割与手动分割数据比较,平均重叠率为93.33%,平均差异度为8.14%。这说明本方法不仅可以将腺体所占比例大的图像精细的分割出来,而且对于腺体所占比例较少的图像也能得到很好的分割效果,从而使乳房的实际形态都包含进来。
4 结束语
本文针对乳腺MR 序列乳房分割问题,结合乳腺MR 水平面与矢状面的分割结果,后期阶段又结合图像的三维相关性,利用相邻图像之间的联系对分割结果进行优化。本文提出的方法充分利用了乳腺MR 图像的信息,能准确地分割出序列的所有图像,最大限度地保留了乳房区域,便于后期乳腺癌的相关研究工作。
[1]Klifa C,Carballido-Gamio J,Wilmes L,et al.Magnetic resonance imaging for secondary assessment of breast density in a high-risk cohort[J].Magnetic resonance imaging,2010,28(1):8-15.
[2]Macura K J,Ouwerkerk R,Jacobs M A,et al.Patterns of Enhancement on Breast MR Images:Interpretation and Imaging Pitfalls 1[J].Radiographics,2006,26(6):1719-1734.
[3]Rueckert D,Sonoda L I,Hayes C,et al.Nonrigid registration using free-form deformations:application to breast MR images[J].Medical Imaging,IEEE Transactionson,1999,18(8):712-721.
[4]Aljabar P,Heckemann R A,Hammers A,et al.Multi-atlas based segmentation of brain images:atlas selection and its effect on accuracy[J].Neuroimage,2009,46(3):726-738.
[5]Engeland S,Snoeren P R,Huisman H,et al.Volumetric breast density estimation from full-field digital mammograms[J].Medical Imaging,IEEE Transactions on,2006,25(3):273-282.
[6]Koenig M,Kohle S,Peitgen H O.Automatic cropping of breast regions for registration in MR mammography[C]//Medical Imaging.International Society for Optics and Photonics,San Diego:SPIE,2005:1563-1570.
[7]Wu S,Weinstein S P,Conant E F,et al.Fully automated chest wall line segmentation in breast MRI by using context information[C]//SPIE Medical Imaging.International Society for Optics and Photonics,San Diego:SPIE,2012:145-150.
[8]Yushkevich P A,Piven J,Hazlett H C,et al.User-guided 3D active contour segmentation of anatomical structures:significantly improved efficiency and reliability[J].Neuroimage,2006,31(3):1116-1128.
[9]Wu S,Weinstein S P,Conant E F,et al.Automated chest wall line detection for whole-breast segmentation in sagittal breast MR images[J].Medical physics,2013,40(4):042301-042313.
