缢蛏家系早期生长表现比较*
2015-12-02杜文俊牛东红李家乐沈和定吕昊泽
李 多,杜文俊,牛东红,李家乐,沈和定,管 菊,吕昊泽
(上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室,上海 201306)
缢蛏(Sinonovaculaconstricta)俗称蛏、蜻或蚬,是重要的滩涂贝类,为传统的四大养殖贝类之一,在中国的海水养殖业中占有重要的地位[1]。目前,浙江、福建、山东、江苏、辽宁和广东是缢蛏养殖主要产区,2013年中国缢蛏养殖产量72万t[2]。缢蛏在中国具有非常悠久的养殖历史,但是长期以来,缢蛏苗种来源主要依赖于半人工采苗获得[3]。近年来缢蛏工厂化育苗技术获得重大突破,室内规模化育苗技术已经完全成熟[4],但仍缺乏人工选育的良种。因此对缢蛏进行遗传改良,通过人工选育培育出生长速度快、个体性征明显的新品系是解决问题的重要途径。
家系是培育优良品种(系)的重要育种材料,同时也是进行遗传性状分析和构建遗传连锁图谱等遗传分析的重要实验材料[5-7],中国已对海湾扇贝、菲律宾蛤仔等开展了一系列的家系育种研究[8-10]。建立家系是贝类选择育种的基础[11-12],优良家系通过家系内的逐代筛选纯化和家系间杂交等方式,可以在不同程度上提升贝类的生长性能,固定群体内主要经济效应的加性基因,使经济效应得到遗传改良,从而获得人们需要的贝类新品系[13-15]。本文通过缢蛏家系的建立,进行家系早期生长性状的比较分析,以期为缢蛏家系的选育提供基础数据和理论依据。
1 材料与方法
1.1 亲贝来源与选择
实验所用缢蛏亲贝系福建漳州养殖的经过群体选育的F4代群体繁育的苗种,经过1~2年室外养殖待性腺成熟后,起挖成贝,剔除贝壳有损伤的个体后作为实验用亲贝群体。
1.2 家系建立
采用单对配对方法,通过人工催产的方法建立家系。受精的雌、雄缢蛏个数分别为8和10枚,8枚雌性缢蛏分别与1~2枚雄性缢蛏交配,得到10个缢蛏家系,A1—F1各家系母本各不相同,G1和G2同母本,H1和H2同母本。各家系亲本壳长、壳宽、壳高、总重及肉重等生长指标见表1。
将亲贝按照阴干—氨海水—黑布遮光—充气催产,控制水温25.0~28.0℃。缢蛏精卵排放一般于晚上8:00至次日凌晨1:00;发现缢蛏排放精卵,立即取出,分别放到盛有砂滤海水的500mL烧杯中继续排放精卵,每个烧杯放一个种贝,排放过程中避免强光直射。待亲贝停止排放精卵,将精卵按3∶1混合。家系建立过程中实验器具专用,严防组间混杂。
1.3 苗种培养
将建立的各家系转移至6L的圆柱形塑料桶中进行孵化、培育,培养水温控制在25.5~29.0℃。翌日将幼虫密度调节至10ind/mL,约17h后发育至D形幼虫。浮游幼虫期每天半量换水1次,以湛江叉鞭金藻为饵料,连续充气培养。待幼虫变态为稚贝营底栖生活后每天2/3量换水2次,以池塘人工施肥培养的天然单胞藻(小球藻、微绿球藻、骨条藻等)作为主要饵料,并辅以绿色巴夫藻和角毛藻。为避免家系混杂,各个家系分桶培育,器具专用。
1.4 数据测量及分析
测量10个缢蛏家系5、10、15、20、25、30日龄和其中母系半同胞家系组合(G1、G2、H1、H2)60、90日龄的壳长、壳高,每个家系随机测量30个个体。
对于家系的评价采用Kung育种值和综合评定值(Pi)。
用SPSS 17.0和Excel软件处理和分析数据,差异性显著分析采用最小显著差法(Least-Significant difference,LSD)[16]。

表1 缢蛏家系亲本基本情况Table 1 Parents’basic information of families of Sinonovacula constricta
2 结果
2.1 壳长、壳高的生长
由于缢蛏生长早期壳宽和体重量无法得到准确测量值,因此只对其壳长、壳高进行测量。各家系不同日龄壳长、壳高的生长数据经整理后,对各个家系的总体生长情况进行统计分析,所得壳长、壳高2个生长性状的平均值见表2。壳长与壳高比值的总体趋势见图1。5和10日龄时壳长、壳高比分别为1.26和1.27,10日龄后壳长、壳高比持续增长,30日龄时达到2.38,而后趋势渐缓。同一日龄时,虽然不同家系壳长、壳高的生长存在差异,但各家系个体的壳长、壳高比均在同一水平。

图1 缢蛏壳长、壳高生长比值趋势图Fig.1 The trend chart of the growth ratio between shell length and shell height

表2 缢蛏不同日龄的壳长壳高Table 2 Length and height of Sinonovacula constricta at different growth stages
2.2 表型性状间的相关性分析
缢蛏壳长和壳高间的表型相关分析见表3。对壳长、壳高的 Pearson相关性分析表明[17],20、30、60和90日龄时,各家系壳长与壳高均有较强的相关性,且达到极显著水平(P<0.01);这表明所选测量指标的表型相关性分析具有一定的实际意义,所选性状间表现出极强的正相关,可仅通过壳长或壳高了解缢蛏各家系生长发育早期的生长状况。

表3 缢蛏壳长壳高间的相关系数Table 3 The correlation coefficient between the shell length and shell height
2.3 家系间不同日龄的生长比较
所有缢蛏家系5~30日龄壳长的生长情况见图2,母系半同胞家系组合5~90日龄壳长的生长情况见图3。在浮游幼虫期,各家系间壳长生长速度没有明显差异。进入匍匐幼虫期后,各家系间生长速度出现差异,D1为生长最快的家系,C1次之,2个家系从匍匐幼虫向稚贝变态后表现明显的生长优势。10日龄时,F1相较B1和E1而言生长快速,此后生长优势消失。除A1和H2,G1、G2和 H1的壳长无显著差异外(P>0.05),其余各家系的壳长均存在显著差异(P<0.05)。15日龄开始,A1生长速度超过F1,但次于C1。C1和D1表现出明显的生长优势,且与其他各家系的壳长差异极显著(P<0.01)。母系半同胞家系组合壳长 H1>G1>H2>G2。20日龄时,B1和E1表现出明显的生长优势,日增长量超过C1和D1。H1和H2表现出明显的生长优势,生长趋于大型化,H1壳长最大;G1和G2逐渐趋于小型化,G2壳长最小,比C1小32.3%,比H1小38.2%,显著小于其他家系(P<0.01),生长劣势明显。25日龄时,C1壳长增长快,G2壳长仍最小,比C1小32.7%,比 H1小23.6%。30日龄时,壳长顺序依次为:D1>C1>E1>A1>H1>B1>H2>F1>G1>G2。G1和G2壳长无显著差异(P>0.05),且均显著小于其他各家系(P<0.01)。60日龄时,G1与 H2无显著差异(P>0.05),均显著大于 G2(P<0.05)。90日龄时,H1>H2>G1>G2,H1比G2大62.8%,各家系壳长差异极显著(P<0.01)。随着日龄增加,各家系内个体大小均出现分化。各发育阶段缢蛏壳长和壳高有较强的相关性,且达到极显著水平(P<0.01),各家系壳高与壳长呈正相关的生长趋势。

图2 缢蛏家系间壳长生长比较Fig.2 Growth comparison between families in shell length

图3 母系半同胞家系组合壳长生长比较Fig.3 Growth comparison between maternal half-sib families combinations in shell length
2.4 各家系评价
缢蛏各家系壳长、壳高的Kung育种值和综合评定值见表4。各家系不同指标的Kung育种值的大小比较结果为:壳长D1>C1>E1>A1>H1>B1>H2>F1>G1>G2;壳高D1>C1>E1>A1>B1>H1>H2>F1>G1>G2。各家系的综合评定值比较结果为:D1>C1>E1>A1>H1>B1>H2>F1>G1>G2,可见D1和C1的Kung育种值和综合评定值均取得较大值,表现出显著的生长优势。母系半同胞家系组合中H1的Kung育种值和综合评定值明显优于其他家系。
3 讨论
本实验共建立了32个缢蛏家系,选取其中同日建立的10个家系以减少水温等外部环境对实验的影响。表型性状相关性分析发现缢蛏幼虫不同生长时期壳长与壳高有较强的相关性,且达到极显著水平(P<0.01)表明以壳长或壳高为参数进行选育均能达到改良生长性状的效果。这与王庆志等对长牡蛎幼体的研究一致[18]。选取易测量的表型性状可以提高选育效率,缩短离水时间,减少人为因素造成的伤亡,保证其存活率。
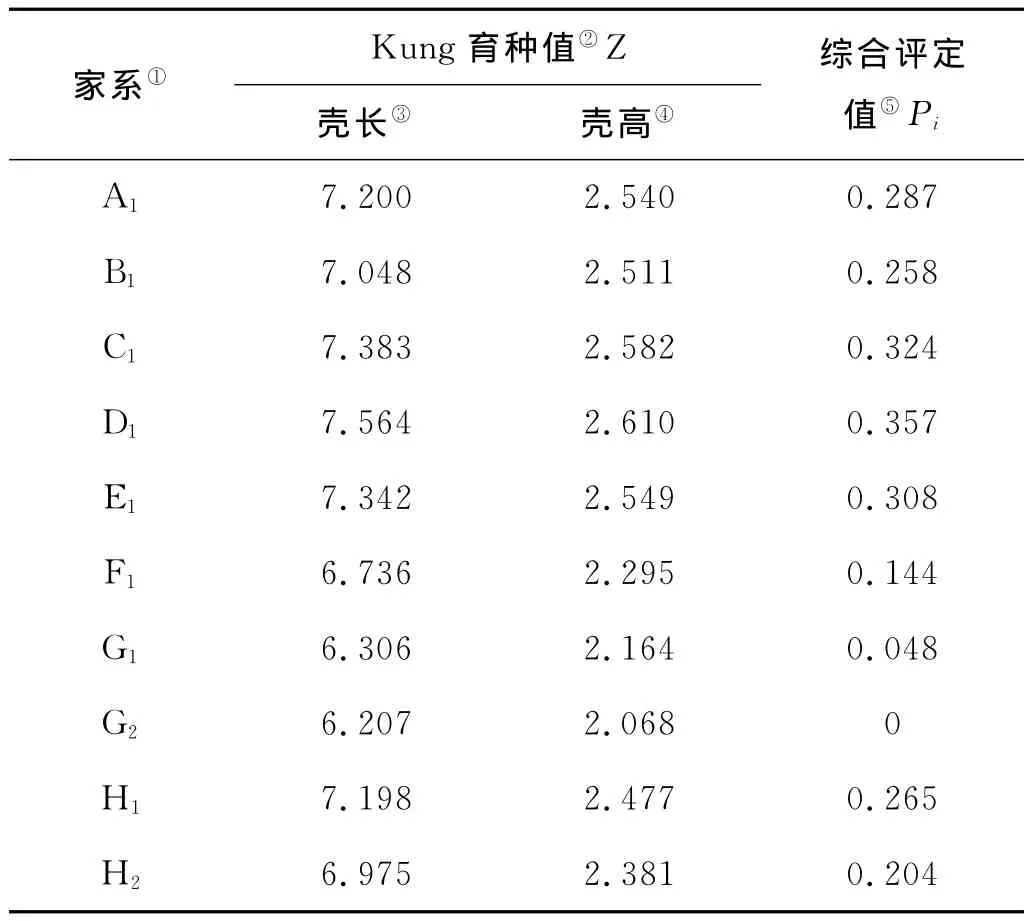
表4 家系的Kung育种值及综合评定值Table 4 Kung breeding values and the comprehensive evaluation values of the families
缢蛏不同家系浮游幼虫期的个体大小和生长速度不同,表现出一定程度的生长差异,但不明显;到了稚贝期,各家系间的生长差异逐渐变大,主要是由控制生长的基因在不同家系间表达的差异引起的[19]。D1一直个体最大,生长最快,C1次之;而随着日龄增加,F1逐渐表现出生长劣势,这与菲律宾蛤仔等早期生长发育比较的研究一致[11]。缢蛏部分家系间壳长无显著差异,而部分家系间差异显著,由于实验严格控制了养殖环境,所以可认为差异是由家系遗传背景引起的。部分家系个体生长差异的显著性随日龄发生变化,G1、G2和H1在10日龄时壳长无显著差异,90日龄时差异极显著(P<0.01),说明家系群体可能存在着丰富的遗传变异资源,也可能存在环境变化导致遗传变异与环境的交互效应[17]。
母系半同胞家系组合中,较大母本作为亲本的家系生长快,表现出明显的生长优势;较小母本作为亲本的家系生长慢,表现出明显的生长劣势。缢蛏家系个体大小与父性效应、母性效应以及交互作用相关。15日龄时,G1>H2,说明缢蛏生长早期受父性效应和母性效应的交互作用影响,且母性效应不明显。30日龄起,以G为母本的半同胞家系组合表现明显的生长优势,说明在生长较快的家系中存在较大的母性效应,这可能是由于卵细胞质量、上位效应和环境效应共同作用的结果[20-21]。而本研究中未建立父系半同胞家系组合,因而不能确定在缢蛏生长发育早期各阶段起主要作用的是父性效应还是母性效应,还有待后续实验来完善。
性状的表现型是基因型和环境共同作用的结果。基因型值可进一步分解为加性效应值、显性效应值和互作效应值。加性效应值即育种值,在世代传递中可以得到稳定遗传,是遗传育种的重要指标。相同条件下,育种值大为优[22]。本实验中,各家系壳长、壳高的Kung育种值和综合评定值的较大值均出自家系D1和C1,表现出显著的生长优势。D1和C1在早期生长的不同阶段均表现出较快的生长速度,且不同日龄时都与其他家系有显著性差异(P<0.01),故认定为经济性状优良的家系,可作为留选家系进行进一步的家系选育。由于本实验未设置对照组(野生群体),故家系留选对象为育种值高于所有家系均值的家系[23]。实验中大于家系均值(0.219)的家系有 A1、B1、C1、D1、E1和 H1,而在母系半同胞家系组合中,H1的Kung育种值和综合评定值显著大于其他家系,综合考虑,H1也可作为留选家系。
缢蛏部分家系已经表现出明显的生长优势,为进一步通过家系选育的方法培育缢蛏优良品系提供了良好的育种材料。同时,快速生长家系内个体规格明显分化,可以通过进一步的家系内选育或者家系间杂交选育培育出个体大、生长快的优良家系。
[1]刘广丰,沈和定,陈慧,等.不同微藻对缢蛏稚贝摄食和生长的影响[J].上海海洋大学学报,2009,18(6):708-714.
[2]农业部渔业渔政管理局.2014中国渔业统计年鉴[M].北京:中国农业出版社,2014:29-33.
[3]牛东红,陈慧,王树亮,等.我国沿海缢蛏群体遗传结构的mtDNA-COⅠ分析[J].动物学杂志,2010,45(2):11-18.
[4]周友富,林依列,杨吉方.缢蛏工厂化全人工育苗技术[J].中国水产,2003(1):55-56.
[5]张天时,孔杰,刘萍,等.中国对虾家系建立及不同家系生长发育的初步研究[J].海洋学报,2007,29(3):120-124.
[6]郑怀平,张国范,刘晓,等.不同贝壳颜色海湾扇贝 (Argopecten irradians)家系的建立及生长发育研究[J].海洋与湖沼,2004,34(6):632-639.
[7]Lannan J E.Estimating heritability and predicting response to selection for the Pacific oyster,Crassostreagigas[J].Proc Natl Shellfish Assoc,1972,62:62-66.
[8]张守都.海湾扇贝的选择和杂交育种[D].青岛:中国科学院海洋研究所,2013.
[9]汪勇飞.池蝶蚌 (Hyriopsisschlegeli)F1代家系选育与生长性状的遗传分析[D].南昌:南昌大学,2010.
[10]张跃环,闫喜武,王艳,等.不同壳型菲律宾蛤仔杂交家系的建立及早期生长发育比较[J].渔业科学进展,2009,30(2):71-77.
[11]闫喜武,霍忠明,张跃环,等.菲律宾蛤仔家系的建立及早期生长发育[J].水产学报,2010(1):32-40.
[12]盛志廉,陈瑶生.数量遗传学[M].北京:科学出版,2001.
[13]张国范,刘晓.关于贝类遗传改良几个问题的讨论[J].水产学报,2006,30(1):130-137.
[14]Ka tsuhiko T W.A quaculture gene tics of bivalve molluscs:a review[J].青岛海洋大学学报,2000,30(1):107-114.
[15]唐启升.中国海洋渔业可持续发展及其高技术需求[J].中国工程科学,2001,3(2):7-9.
[16]何毛贤,管云雁,林岳光,等.马氏珠母贝家系的生长比较[J].热带海洋学报,2007,26(1):39-43.
[17]张存善,杨小刚,宋坚,等.虾夷扇贝家系的建立及不同家系的早期生长研究[J].南方水产科学,2008,4(5):44-50.
[18]王庆志,李琪,刘士凯,等.长牡蛎幼体生长性状的遗传力及其相关性分析[J].中国水产科学,2009,16(5):736-743.
[19]闫喜武,张国范.中国蛤蝌的家系建立及早期生长发育[J].水产学报,2010,34(4):521-530.
[20]Sheridan A K.Genetic improvement of oyster production-a critique[J].Aquaculture,1997,153:165-179.
[21]Jones R,Bates J A,Innes D J,et al.Quantitative genetic analysis of growth in larval scallops(Placopectenmagellanicus)[J].Mar Biol,1996,124:671-677.
[22]刘来福,毛盛贤,黄远樟.作物数量遗传[M].北京:农业出版社,1984.
[23]刘志刚,章启忠,朱晓闻,等.海湾扇贝南部亚种自交家系选育及其Kung育种值评价[J].中国水产科学,2013,20(2):308-315.
