微拟球藻硫脂酶基因克隆及其在大肠杆菌中的表达*
2015-12-02王丽丽朱葆华杨官品潘克厚
王丽丽,朱葆华,杨官品,潘克厚**
(中国海洋大学1.海水养殖教育部重点实验室,2.海洋生命学院,山东 青岛 266003)
植物细胞合成脂肪酸时,乙酰CoA羧化酶将乙酰CoA转变为丙二酸单酰CoA[1],再经过脂肪酸合酶的催化,每循环增加2个碳延伸酰基碳链[2],最后硫酯酶(Thioesterase,TE)分解出脂肪酸和ACP,完成脂肪酸合成[3]。根据底物特异性,植物硫脂酶分为2类,FatA和 FatB[4-5]。FatA倾向水解不饱和酰基-ACP,对C18∶1-ACP有很强活性,而FatB倾向水解饱和或较短的酰基-ACP[6-10]。细菌硫脂酶则分为硫脂酶I和硫脂酶II,它们可以水解酰基-CoA和酰基-ACP,其中硫脂酶I催化C12-C18酰基-ACP/CoA水解,而硫脂酶II催化C6-C18酰基-ACP/CoA 水解[11]。目前,多种植物包括加州月桂、澳洲坚果、萼距花、拟南芥等的硫脂酶基因已被克隆并验证了功能[2,7,12-13]。然而,藻类硫脂酶基因的克隆和功能验证却鲜有报道。
微拟球藻(Nannochloropsisoceanica)属于真眼点藻纲(Eustigmatophyceae),多数分布于海洋,淡水中也有分布[14-15],富含蛋白质、多不饱和脂肪酸、色素等高附加值产物[16-18],是一类重要的单细胞经济微藻。近年来,微拟球藻更是有望用于生产生物柴油[17-18]。脂质积累必须经过脂肪酸合成、去饱和、延伸、酰基化等步骤。微拟球藻含有丰富的油脂,因此,其必含有一套完整且高效的脂肪酸合成酶系。硫脂酶是脂肪酸合成通路的关键酶,水解酰基-ACP,释放脂肪酸[10,19]。目前,关于微拟球藻脂肪酸去饱和酶和延伸酶的研究已有报道[20-21],但未见针对微拟球藻硫脂酶的研究。因此,探索微拟球藻硫脂酶的功能对全面认识微拟球藻脂肪酸的合成机制至关重要。
本实验室已测定了N.oceanica基因组序列,并注释了硫脂酶基因[22]。我们发现注释的硫脂酶氨基酸序列与其他物种硫脂酶氨基酸序列相似性较低,硫脂酶又缺少功能验证系统。为验证微拟球藻硫脂酶基因功能,本研究用反转录PCR(RT-PCR)技术分离了微拟球藻硫脂酶基因cDNA(NoTE),并在大肠杆菌中进行了表达,根据大肠杆菌脂肪酸组成变化验证微拟球藻硫脂酶基因功能。本研究为深入探索硫脂酶在微拟球藻脂肪酸合成过程中的作用奠定了基础,为下一步通过基因工程手段调控微拟球藻脂肪酸代谢提供依据。
1 材料与方法
1.1 微拟球藻培养
微拟球藻(N.oceanica)为中国海洋大学海水养殖教育部重点实验室保存,编号为LAMB 0001。将微拟球藻接种于250mL三角瓶中,内装有200mL高压蒸汽灭菌后的f/2培养基[23],于(23±1)℃、光强70 μmol·s-1·m-2、光周期12h∶12h、盐度30、pH=7.8条件下培养。
1.2 引物设计与合成
根据注释的NoTE设计引物,并引入酶切位点EcoRI和XhoI(下划线)(见表1)。引物由上海生工生物工程技术服务有限公司合成。
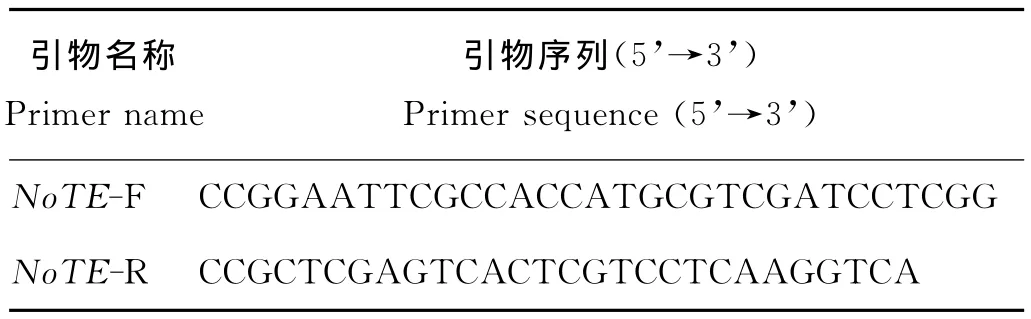
表1 NoTE扩增引物Table 1 Primers used to amplify NoTE
1.3 微拟球藻硫脂酶基因克隆
用Trizol(Iinvitrogen公司)方法提取微拟球藻总RNA。用TransScript?One-Step gDNA Removal and cDNA Synthesis SuperMix(全式金公司)反转录合成cDNA,PCR扩增NoTE。PCR反应条件:94℃预变性3min接94℃变性30s,66℃退火30s,72℃延伸1.5min,30个循环和72℃延伸10min一个额外循环。用胶回收试剂盒(Omega公司)切胶纯化PCR产物。与pEASY?-Blunt Cloning Vector(全式金公司)进行T-A连接后,转化大肠杆菌Trans1-T1,PCR筛选阳性克隆并测序。
1.4 硫脂酶基因表达
提取重组质粒。将重组质粒和pET-30a均用EcoRI和XhoI双酶切,回收纯化后连接,构建重组质粒pET30a-NoTE,转化大肠杆菌BL21(DE3),菌落PCR筛选阳性克隆并测序。
将重组子接种到含50μg/mL卡那霉素的LB液体培养基中[2],37℃震荡培养过夜。按1∶100比例转接到新鲜LB培养基,震荡培养至OD600约0.6,加入IPTG至终浓度0.5mmol/L,30℃诱导4h。4℃下5 000g离心收集菌体,用100μL蒸馏水重悬菌体,加入300μL 4×蛋白质上样缓冲液,100℃煮沸20min,12 000g离心5min,取上清进行SDS-PAGE检测。
1.5 重组子脂肪酸组成分析和含量测定
取35mL菌液,4℃下5 000g离心收集菌体,参照文献[24],在湿菌体中加入3mL萃取剂(甲醇∶氯仿=1∶2),涡旋震荡10min萃取细胞总脂,再加入5mL皂化试剂(水∶甲醇=1∶4,含6%NaOH),60℃水浴1h,最后加入2mL甲酯化试剂(12%三氟化硼-甲醇溶液),60℃水浴30min,用1mL色谱纯正己烷萃取脂肪酸甲酯,然后用AgiLent 6890Series GC Systerm(US10251016,USA)进行GC分析。色谱条件为汽化室温度250℃,空气流量450mL/min,氢火焰离子化检测器(FID),N2载气,线速45mL/min,H2线速40mL/min,分流比10∶1,程序升温170℃ (1min)升至210℃ (25min),每分钟开3℃。以十五烷酸(Sigma公司)为内标进行定量。
2 结果与分析
2.1 微拟球藻硫脂酶基因表达
PCR扩增获得与预期大小相符的特异性条带(见图1)。测序显示,插入T载体的DNA片段与NoTE预测序列一致。NJ进化树(见图2)显示,硫脂酶主要分为植物FatA和FatB,细菌硫脂酶以及几个单独的种类,而微拟球藻硫脂酶与它们的同源性较低,是独立于它们之外的一类硫脂酶。
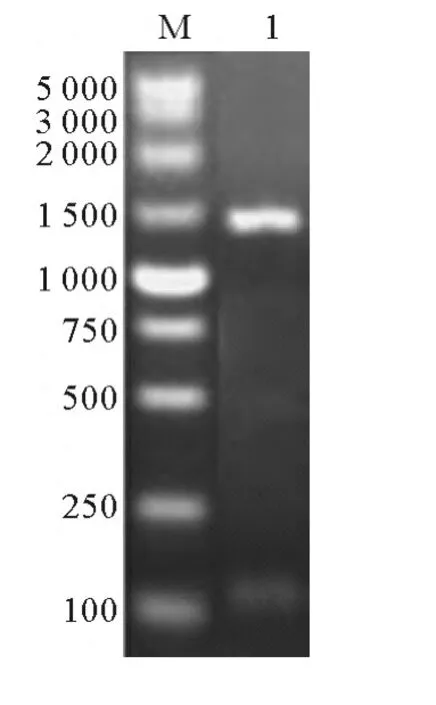
图1 NoTE扩增结果Fig.1 RT-PCR product of NoTE
将NoTE从T载体上切下并连接到pET-30a上,构建重组质粒,用pET-30a特异性引物(5’-TCA AGA CCC GTT TAG AGG C-3’和 5’-TCA TTC TTC TGG TCT GGT GC-3’)菌落PCR扩增获得一条特异条带(见图3),与预期大小相符。测序显示插入pET-30aDNA片段与NoTE序列一致,说明重组质粒构建成功。
重组子诱导4h后,SDS-PAGE检测发现在55kD处有一条特异条带(见图4),与预期蛋白大小相符,对照无特异条带,说明NoTE已在大肠杆菌BL21(DE3)中表达。
2.2 重组子脂肪酸组成和含量
GC分析显示重组子和对照脂肪酸组分相同,表明NoTE表达不改变大肠杆菌脂肪酸种类。但是,重组子脂肪酸定量(见图5)显示C14∶1、C16∶0、C16∶1、C18∶1及总脂肪酸含量与非重组子相比分别提高了11%、18%、32%、49%和30%,证明分离的基因确有硫脂酶活性,其表达能够改变重组子脂肪酸含量,且微拟球藻硫脂酶倾向催化不饱和酰基-ACP的水解,对C18∶1-ACP有很强活性。
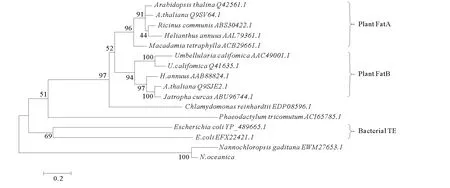
图2 微拟球藻和其他物种硫脂酶的Neighbor-joining树Fig.2 The Neighbor-joining tree of the thioesterase of N.oceanicaand those of other species
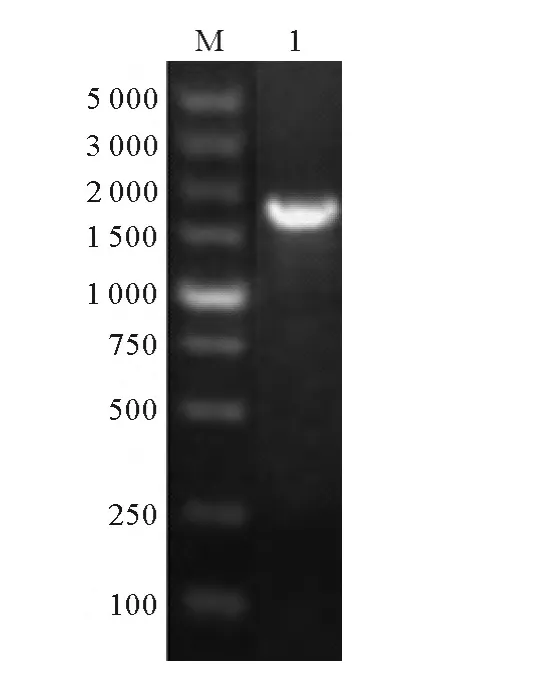
图3 重组质粒PCR鉴定Fig.3 PCR verification of recombinant plasmid

图4 NoTE在大肠杆菌中的表达Fig.4 Expression of NoTEin E.coli BL21(DE3)
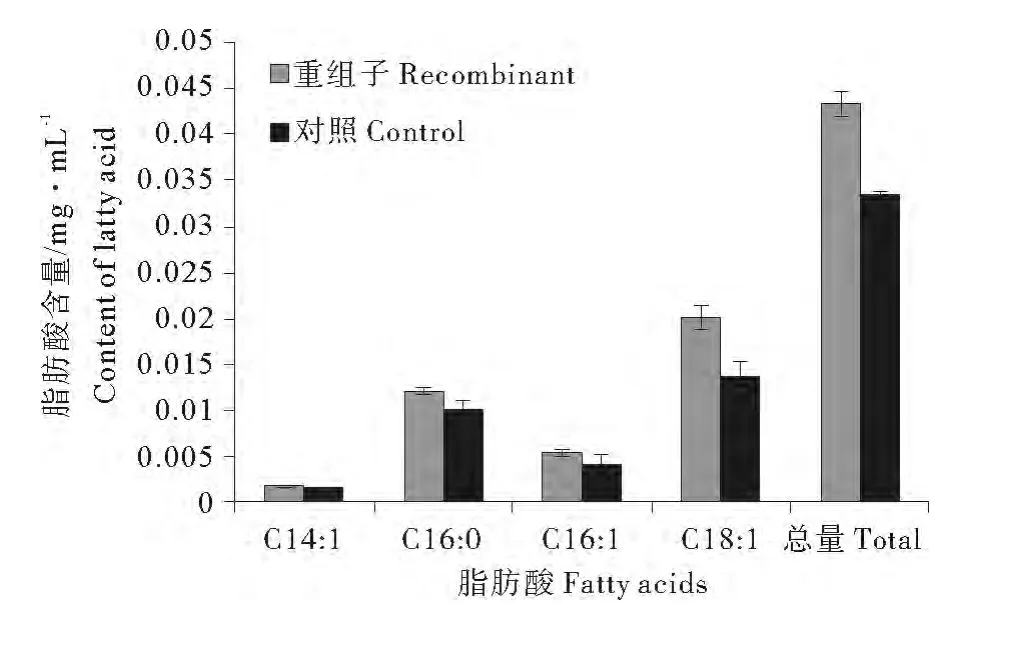
图5 NoTE表达对大肠杆菌脂肪酸含量的影响Fig.5 Changes in the contents of fatty acids of E.coli BL21(DE3)expressing NoTE
3 讨论
本研究分离了微拟球藻一条硫脂酶基因,其功能尚未验证,因此,确定其功能对利用该基因调控微拟球藻的脂肪酸代谢至关重要。大肠杆菌遗传背景清楚、表达系统成熟完善、繁殖迅速、培养简单、操作方便、遗传稳定,其表达系统为验证NoTE的功能提供了一个合适的平台。因此,本实验选择大肠杆菌做为表达宿主,通过SDS-PAGE检测重组子,发现55kD处有一特异条带,与预期蛋白大小相符,初步说明NoTE在大肠杆菌中成功表达。
通过气相色谱对重组子进行脂肪酸组成分析,GC数据显示,大肠杆菌重组子脂肪酸种类虽未发生改变,但其总脂肪酸含量却显著增加,说明异源表达硫脂酶基因可显著提高细菌总脂肪酸含量,这与文献[3,25]的报道一致。另外,重组子C16∶1、C18∶1的含量显著提高,这表明微拟球藻硫脂酶与植物FatA功能相似,主要水解不饱和酰基-ACP,并对C18∶1-ACP活性较强,而细菌硫脂酶对C6-C18酰基-ACP/CoA活性更强[3,11]。本研究中,重组子C16∶0脂肪酸的含量也有一定程度的提高,说明微拟球藻硫脂酶也具有一部分植物FatB的功能,表明FatA和FatB的活性有部分是重叠的[25-26]。这些数据充分证明微拟球藻硫脂酶对不饱和酰基-ACP有更强的亲和力,主要水解C18∶1-ACP,并且与FatB的活性有一定重叠,也可以水解C16∶0-ACP。由于大肠杆菌表达系统缺乏对真核蛋白质的复性功能和修饰加工系统,更系统、全面的了解NoTE的功能还需要更多的实验依据。在接下来的实验中,我们拟纯化重组蛋白,对该酶的底物特异性进行分析;进一步通过转基因技术在微拟球藻中过量表达该基因,从而实现微拟球藻脂肪酸构成的基因工程修饰。
本研究首次对NoTE的功能进行了验证,为进一步研究该酶基因的功能,并通过基因工程手段调控微拟球藻脂肪酸代谢,提高脂肪酸产量,改变脂肪酸组成提供了一定的基础。
[1]Ruffing A M.Borrowing genes fromChlamydomonasreinhardtiifor free fatty acid production in engineered cyanobacteria[J].J Appl Phycol,2013,25(5):1495-1507.
[2]Voelker T A,Davies H M.Alteration of the specificity and regulation of fatty acid synthesis ofEscherichiacoliby expression of a plant medium-chain acyl-acyl carrier protein thioe[J].J Bacteriol,1994,176(23):7320-7327.
[3]Gong Y M,Guo X J,Wan X,et al.Characterization of a novel thioesterase(PtTE)fromPhaeodactylumtricornutum[J].J Basic Microbiol,2011,51:666-672.
[4]Jones A,Davies H M,Voelker T A.Palmitoyl-acyl carrier protein(ACP)thioesterase and the evolutionary origin of plant acyl-ACP thioesterases[J].Plant Cell,1995,7:359-371.
[5]Salas J J,Ohlrogge J B.Characterization of substrate specificity of plant FatA and FatB acyl-ACP thioesterases[J].Arch Biochem Biophys,2002,403(1):25-34.
[6]Dani K G S,Hatti K S,Ravikumar P,et al.Structural and functional analyses of a saturated acyl ACP thioesterase,type B from immature seed tissue ofJatrophacurcas[J].Plant Biology,2011,13(3):453-461.
[7]Moreno-Pérez A J,Sánchez-García A,Salas J J,et al.Acyl-ACP thioesterases fromMacadamia(Macadamiatetraphylla)nuts:Cloning,characterization and their impact on oil composition[J].Plant Physiol Biochem,2011,49:82-87.
[8]Wu P Z,Li J,Wei Q,et al.Cloning and functional characterization of an acyl-acyl carrier protein thioesterase (JcFATB1)fromJatrophacurcas[J].Tree Physiol,2009,29:1299-1305.
[9]Wen Q G,Lei Y,Huang J Q,et al.Molecular cloning and charac-terization of an acyl-ACP thioesterase gene(AhFatB1)from allotetraploid peanut(ArachishypogaeaL.)[J].Afr J Biotechnol,2012,11(77):14123-14131.
[10]元冬娟,吴湃,江黎明.高等植物的酰基-ACP硫酯酶研究进展[J].中国油料作物学报,2009,31(1):103-108.
[11]Cho H,Cronan J E.Escherichiacolithioesterase I,molecular cloning and sequencing of the structural gene and identification as aperiplasmic enzyme[J].J Biol Chem,1993,268(13):9238-9245.
[12]Dehesh K,Jones A,Knutzon D S,et al.Production of high levels of 8∶0and 10∶0fatty acids in transgenic canola by overexpression ofChFatB2,a thioesterase cDNA fromCupheahookeriana[J].Plant J,1996,9(2):167-172.
[14]黄伟超,胡晗华.微拟球藻属对盐度的耐受及其产油特性分析[J].水生生物学报,2013,37(2):383-387.
[15]Solovchenko A,Khozin-Goldberg I,Recht L,et al.Stress-induced changes in optical properties,pigment and fatty acid content ofNannochloropsissp.:Implications for non-destructive assay of total fatty acids[J].Mar Biotechnol,2011,13:527-535.
[16]Kilian O,Benemann C S E,Niyogi K K,et al.High-efficiency homologous recombination in the oil-producing algaNannochloropsissp.[J].PNAS,2011,108(52):21265-21269.
[17]Pal D,Khozin-Goldberg I,Cohen Z,et al.The effect of light,salinity,and nitrogen availability on lipid production byNannochloropsissp.[J].Appl Microbiol Biotechnol,2011,90:1429-1441.
[18]Nobre B P,Villalobos F,Barragán B E,et al.A biorefinery fromNannochloropsissp.microalga-Extraction of oils and pigments.Production of biohydrogen from the leftover biomass[J].Bioresour Technol,2013,135:128-136.
[19]Radakovits R,Jinkerson R E,Darzins A I,et al.Genetic engineering of algae for enhanced biofuel production [J].Eukaryot Cell,2010,9(4):486-501.
[20]Pan K H,Ma X L,Yu J Z,et al.Cloning and phylogenetic analysis of a fatty acid elongase gene fromNannochloropsisoculataCS179[J].J Ocean Univ China,2009,8(4):392-398.
[21]Ma X L,Yu J Z,Zhu B H,et al.Cloning and characterization of a delta-6desaturase encoding gene ofNannochloropsisoculata[J].Chin J Oceanol Limnol,2011,29(2):290-296.
[22]Pan K H,Qin J J,Li S,et al.Nuclear monoploidy and asexual propagation ofNannochloropsisoceanica(Eustigmatophyceae)as revealed by its genome sequence[J].J Phycol,2011,47:1425-1432.
[23]Guillard R R L,Ryther J H.Studies of marine planktonic diatoms:CyclotellananaHustedt,andDetonulaconfervacea(cleve)Gran[J].Can J Microbiol,1962,8:229-239.
[24]程涛,杨建明,刘辉,等.拟南芥硫酯酶基因(atfata)在大肠杆菌中的表达及其对游离脂肪酸合成的影响 [J].应用与环境生物学报,2011,17(4):568-571.
[25]Serrano-Vega M J,Garcés R,Martínez-Force E.Cloning,characterization and structural model of a FatA-type thioesterase from sunflower seeds(HelianthusannuusL.)[J].Planta,2005,221:868-880.
[26]Huynh T T,Pirtle R M,Chapman K D.Expression of aGossypiumhirsutumcDNA encoding a FatB palmitoyl-acyl carrier protein thioesterase inEscherichiacoli[J].Plant Physiol Biochem,2002,40:1-9.
