omega-3多不饱和脂肪酸对人肺腺癌细胞H460及H1975细胞周期及细胞凋亡的影响
2015-12-02曾斯逊李昌林丁振宇
曾斯逊,李昌林,丁振宇,王 椿
(1.泸州医学院附属医院肿瘤科,四川泸州646000;2.成都市第一人民医院肿瘤二科,成都610000;3.四川大学华西医院肿瘤中心,四川大学生物治疗国家重点实验室,成都610041;4.四川大学华西医院内分泌代谢科,成都610041)
肺癌发病率及死亡率居于全球恶性肿瘤首位,严重威胁人类的生命健康。目前治疗方式有手术治疗,化疗、放疗及生物治疗等,大部份病人就诊时已属晚期,无手术指征,对于转移性肺癌患者化疗为主要治疗手段,但肺癌5年生存率始终徘徊在15%左右,且已达平台期,很难再提高[1-2],所以拓展思路,发展新的治疗方式有重要意义。
多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)是指结构中含有两个或两个以上双键且碳链长度为18~22个碳原子的直链脂肪酸。通常分为omega-3和omega-6。其中omega-3 PUFAs主要包括二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahex-oenoic acid,DHA)。人体不能合成omega-3 PUFAs。
PUFAs可促进多种恶性肿瘤如乳腺癌、肝癌、胰腺癌等细胞的凋亡且抑制细胞增殖。可能机制涉及影响生物膜的构成和功能、调节肿瘤细胞脂质过氧化,抑制癌基因编码蛋白的表达和功能,抑制肿瘤新生血管形成及抑制癌细胞与内皮细胞粘附[3-5]。
李芳芳[6]等研究omega-3多不饱和脂肪酸脱氢酶基因fat-1在人肺癌细胞H460内的表达,该研究表明omega-3脱氢酶基因fat-1能有效抑制肺腺癌细胞。胡振东[7]等研究多不饱和脂肪酸不同组分抑制肺腺癌干细胞作用,该研究表明多不饱和脂肪酸各有效成分对肺腺癌细胞有不同程度的抑制作用,且随浓度增加其抑制作用增加。有学者[8]发现和给予omega-6 PUFAs的小鼠比较,细胞周期抑制剂基因(P21)在给予omega-3 FUFAs的小鼠中更具有较高表达,该结果表明摄入较高量鱼油(omega-3/omega-6比例高)对肺癌进展有抑制作用。本研究用DHA及EPA处理肺腺癌细胞H460及H1975,观察EPA及DHA对肿瘤细胞的细胞周期及细胞凋亡的影响。
1 材料与方法
1.1 材料
1.1.1 实验细胞 人肺腺癌细胞株H460及H1975购自American type culture collection(ATCC美国模式培养物收藏中心)。
1.1.2 主要试剂 EPA 、DHA(美国Sigma公司),CCK-8试剂盒(Cell Counting Kit-8)(日本同仁),细胞凋亡及细胞周期试剂盒(凯基生物公司)。EPA和DHA用二甲亚砜配制成浓度600mmol/L的贮存液,-80℃避光保存。RPM1-1640培养基(Thermo公司),同时加入10%胎牛血清(草原绿野生物)及双抗(100U/mL青霉素+100U/mL链霉素)。
1.2 方法
1.2.1 细胞培养 肺腺癌细胞H460和H1975细胞均用10%胎牛血清及100U/mL青霉素+链霉素的1640培养基于37℃、饱和湿度、5%CO2的条件下,在培养箱内进行培养,隔天换液,3d传代1次。
1.2.2 实验分组 实验药物EPA及DHA按浓度分组,分为 25、50、100、150、200、300μmol/L 组,同时设立二甲亚砜(1%)阴性对照及吉西他滨(400μg/ml)阳性对照。
1.2.3 CCK-8检测细胞活性 按CCK-8使用说明书进行操作。采用96孔培养板,贴壁细胞用0.25%胰蛋白酶进行消化,收集后计数,调整细胞浓度为1×104个/ml,并设置5个复孔,培养24小时,使细胞呈单层贴壁且处于对数生长期。根据实验设计分组以不同浓度药物加药,继续培养24、48和72小时,终止反应时每孔加10μl的CCK-8试剂继续在37℃、饱和湿度、5%CO2条件下在培养箱内培养2小时,在酶标仪(Thermo Multiskan Mk3)波长450 nm条件下测定OD值。
1.2.4 细胞凋亡检测 经不同浓度DHA(100、200、300μmol/L)及 EPA(200μmol/L)处理 24 小时,诱导细胞凋亡后,严格按照凯基生物细胞凋亡试剂盒说明书进行操作,将贴壁细胞用不含EDTA的胰酶消化收集,用PBS洗涤细胞两次(2 000rpm离心5min)收集1~5×105细胞;加入500ul的结合缓冲液悬浮细胞;加入5ul Annexin V-FITC混匀后,加入5ul碘化丙啶(Propidium Iodide,PI),混匀;室温、避光、反应5~15min;用Accuri C6流式细胞仪(BD公司)进行检测。
1.2.5 细胞周期检测 经不同浓度DHA(100、200 μmol/L)及 EPA(200μmol/L)处理24小时后,严格按照凯基生物细胞周期试剂盒说明书进行操作,收集培养的细胞悬液,1 500rpm离心5min,弃去上清液,保留约100μl残留液,其中细胞数量大于2×105个;取培养单个细胞悬液50μl,加入到试管底部。加入 100μl试剂 A,室温孵育 10min。加入100μl试剂B。加入150μl试剂C于上述试管中,室温避光孵育10min。用BD Accuri C6流式细胞仪进行检测。
1.2.6 Western-blot检测 Survivin 在蛋白水平上的表达 离心收集细胞,提取细胞总蛋白,预冷PBS漂洗2次,弃上清,再次离心,去尽残留液,将样品置于冰上用添加含有cooktail蛋白酶抑制剂及PMSF的RIPA裂解液(均购自凯基生物)重悬细胞。样品涡旋震荡1min,冰上放置3 min,如此反复操作至细胞彻底裂解。用细胞超声破碎仪超声3~5次,每次3~5s。避免产生气泡,冰上操作。13,000rpm,4℃离心15 min,收集上清,用BCA(凯基生物)法测定蛋白浓度。加入SDS上样缓冲液(凯基生物),离心5min,取上清。4~20%SDS-PAGE胶(上海willget biotech公司)电泳,恒压电泳浓缩胶80V,10min,再恒压电泳分离胶120V,80min电泳直至溴酚染料前沿下至凝胶末端处,即结束电泳。将PAGE胶中蛋白转移至 PVDF 膜(Millipor,0.22 μm)上,5% 脱脂奶粉室温封闭2小时,TBST漂洗后加入兔抗人Survivin多克隆抗体(Cell Signaling Tecnology公司),4℃孵育过夜,TBST漂洗后加入HRP-羊抗兔IgG抗体(华安生物),室温孵育1.5 h,用TBST漂洗,最后加ECL化学发光显色液(Millipore公司)显色。以β-actin(Cell Signaling Tecnology公司)作为内参。
1.2.7 统计学处理 采用SPSS 13.0进行统计处理,计量资料结果以±s,采用单因素方差分析和t检验进行统计学比较,以P<0.05作为检验水准。
2 结果
2.1 DHA与EPA对人肺腺癌细胞活性的影响
用CCK-8法测定阴性对照组、吉西他滨组及DHA 、EPA 6 个不同浓度(25、50、100、150、200、300μmol/L)及不同时间点(24、48、72小时)对肿瘤细胞活性的影响。用吉西他滨处理肿瘤细胞后,肿瘤细胞活性可明显降低(P<0.001)。用DHA或EPA处理肿瘤细胞后,低浓度组对肿瘤细胞活性无明显影响。用 200μmol/L、300μmol/L EPA处理H460及H1975细胞肿瘤细胞活性均下降(P<0.001),且300μmol/L 比200μmol/L 下降更明显(P<0.05);用 200μmol/L 、300μmol/L DHA 处理H460细胞后,肿瘤细胞活性均下降(P<0.001),且 300μmol/L比 200μmol/L下降更明显(P<0.05)。用200μmol/L DHA 处理 H1975细胞后,肿瘤细胞活性下降不明显,用300μmol/L DHA处理H1975细胞后,肿瘤细胞活性明显下降(P<0.001)。随着300μmol/L DHA处理肿瘤细胞的时间延长,肿瘤细胞活性下降(P<0.05)。随着300μmol/L EPA处理肿瘤细胞的时间延长,肿瘤细胞活性下降(P<0.05)。而低浓度组DHA及EPA处理肿瘤细胞后,其细胞活性与时间无明显相关性。(见图1、表1~4)。
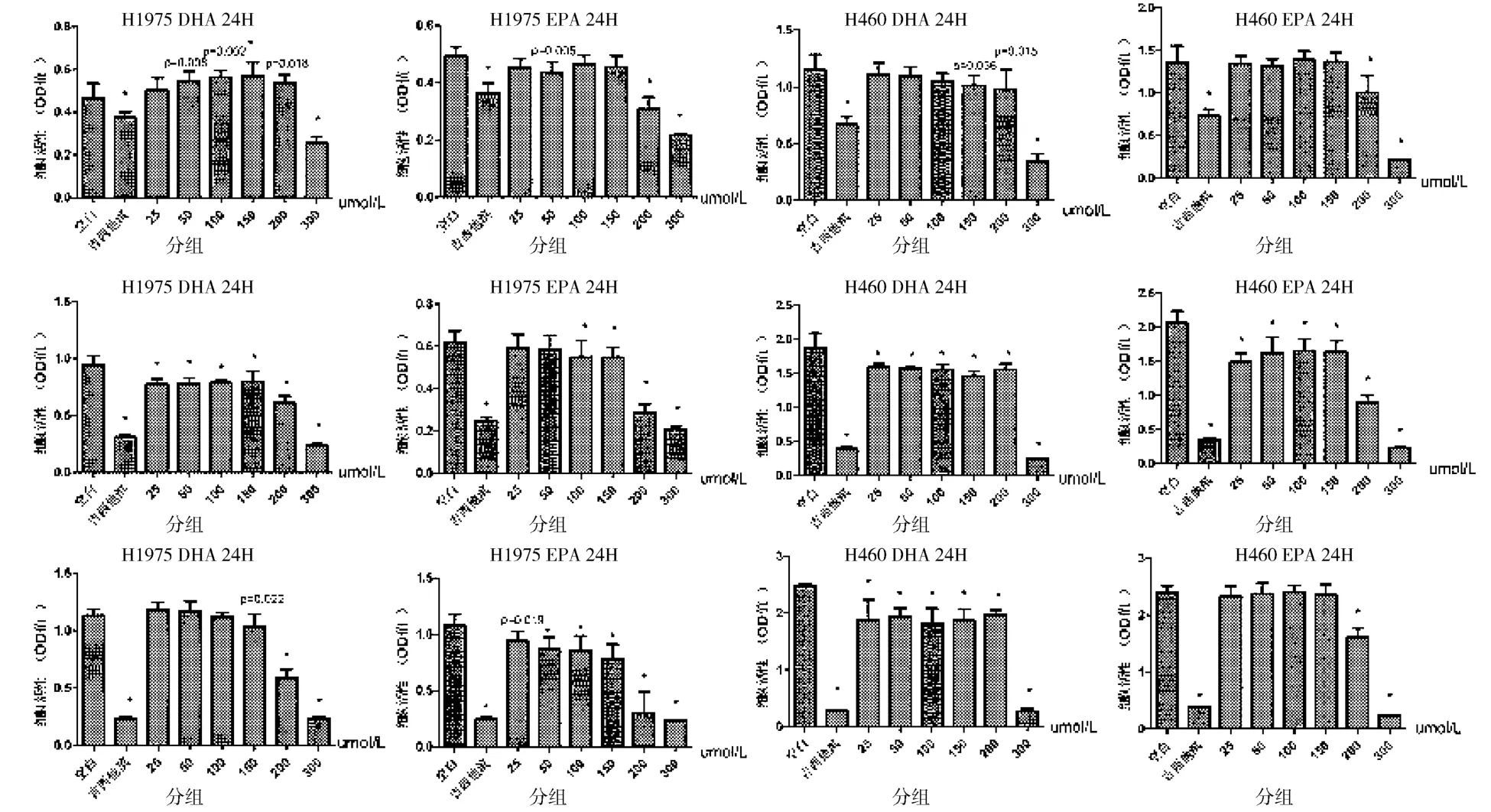
图1 EPA和DHA对H460及H1975细胞活性的影响
表1 EPA对H1975细胞活性的影响(OD值)(± s,n=6,)
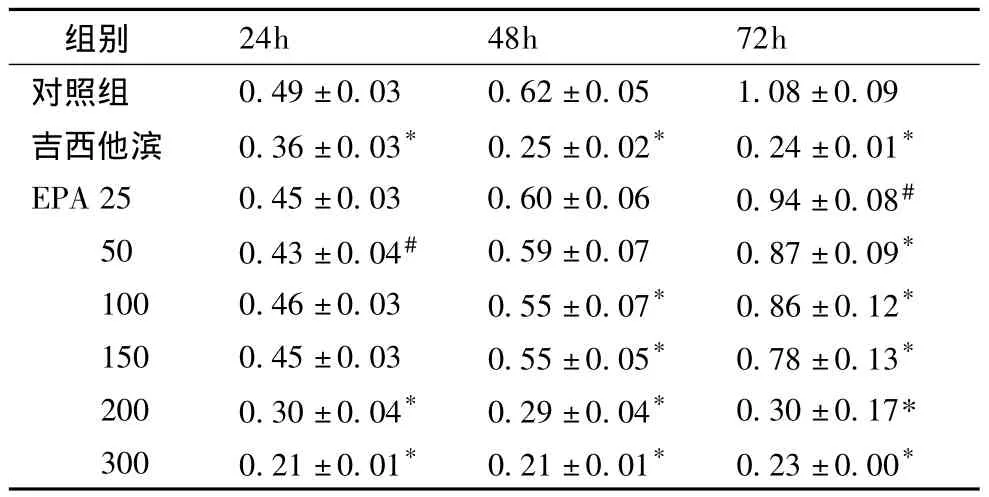
表1 EPA对H1975细胞活性的影响(OD值)(± s,n=6,)
注:*与对照组相比P<0.001,#与对照组相比P<0.05
24h 48h 72h对照组组别0.49 ±0.03 0.62 ±0.05 1.08 ±0.09吉西他滨 0.36 ±0.03* 0.25 ±0.02* 0.24 ±0.01*EPA 25 0.45 ±0.03 0.60 ±0.06 0.94 ±0.08#50 0.43 ±0.04# 0.59 ±0.07 0.87 ±0.09*100 0.46 ±0.03 0.55 ±0.07* 0.86 ±0.12*150 0.45 ±0.03 0.55 ±0.05* 0.78 ±0.13*200 0.30 ±0.04* 0.29 ±0.04* 0.30 ±0.17*300 0.21 ±0.01* 0.21 ±0.01* 0.23 ±0.00*
表2 EPA对H460细胞活性的影响(OD值)(± s,n=6,)

表2 EPA对H460细胞活性的影响(OD值)(± s,n=6,)
注:*与对照组相比P<0.001,#与对照组相比P<0.05
组别24h 48h 72h对照组1.36 ±0.18 2.06 ±0.17 2.40 ±0.11吉西他滨 0.73 ±0.07* 0.36 ±0.02* 0.38 ±0.01*EPA 25 1.34 ±0.09 1.49 ±0.12* 2.32 ±0.18 50 1.32 ±0.07 1.62 ±0.23* 2.39 ±0.18 100 1.39 ±0.09 1.66 ±0.16* 2.41 ±0.11 150 1.37 ±0.09 1.64 ±0.16* 2.36 ±0.18 200 1.01 ±0.19* 0.90 ±0.10* 1.61 ±0.15*300 0.22 ±0.00* 0.23 ±0.00* 0.24 ±0.00*
表3 DHA对H1975细胞活性的影响(OD值)(±s,n=6)

表3 DHA对H1975细胞活性的影响(OD值)(±s,n=6)
注:*与对照组相比P<0.001,#与对照组相比P<0.05
组别24h 48h 72h对照组0.46 ±0.07 0.94 ±0.08 1.13 ±0.06吉西他滨 0.37 ±0.03* 0.31 ±0.02* 0.23 ±0.02*DHA 25 0.50 ±0.06 0.77 ±0.05* 1.18 ±0.06 50 0.55 ±0.04# 0.78 ±0.05* 1.17 ±0.09 100 0.56 ±0.03# 0.78 ±0.02* 1.12 ±0.03 150 0.56 ±0.07* 0.79 ±0.09* 1.03 ±0.09#200 0.54 ±0.04# 0.60 ±0.06* 0.59 ±0.07*300 0.26 ±0.03* 0.24 ±0.01* 0.23 ±0.02*
表4 DHA对H460细胞活性的影响(OD值)(±s,n=6)
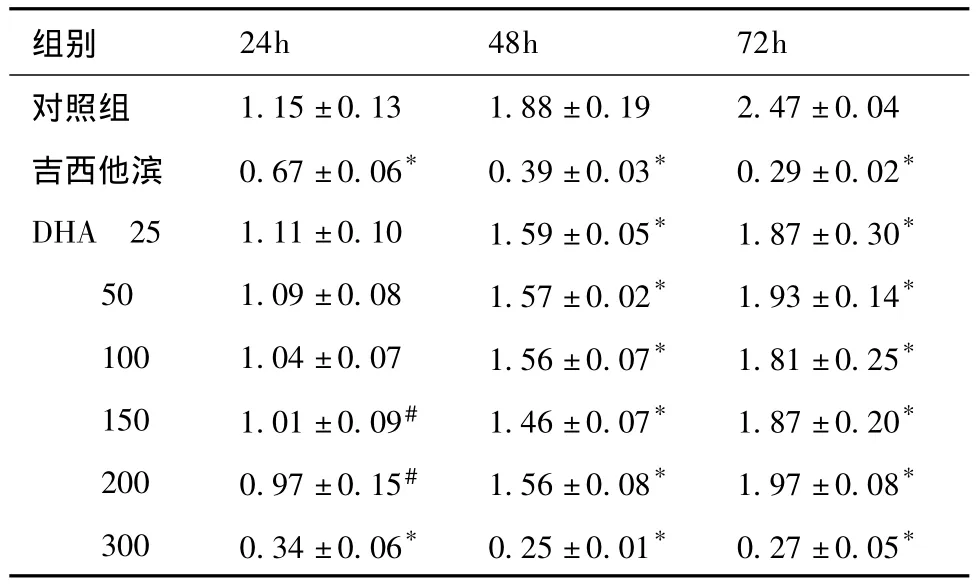
表4 DHA对H460细胞活性的影响(OD值)(±s,n=6)
注:*与对照组相比P<0.001,#与对照组相比P<0.05
组别24h 48h 72h对照组1.15 ±0.13 1.88 ±0.19 2.47 ±0.04吉西他滨 0.67 ±0.06* 0.39 ±0.03* 0.29 ±0.02*DHA 25 1.11 ±0.10 1.59 ±0.05* 1.87 ±0.30*50 1.09 ±0.08 1.57 ±0.02* 1.93 ±0.14*100 1.04 ±0.07 1.56 ±0.07* 1.81 ±0.25*150 1.01 ±0.09# 1.46 ±0.07* 1.87 ±0.20*200 0.97 ±0.15# 1.56 ±0.08* 1.97 ±0.08*300 0.34 ±0.06* 0.25 ±0.01* 0.27 ±0.05*
2.2 DHA及EPA对细胞凋亡的影响
当EPA、DHA浓度大于200μmol/L时,细胞活性明显下降。且细胞活性随着EPA、DHA浓度增加而降低。我们推测200μmol/L为EPA和DHA对细胞活性产生影响的最低有效浓度。在EPA和DHA的最低有效浓度下检测EPA(200μmol/L)及DHA(100、200 μmol/L)对细胞无明显的诱导凋亡作用。不同浓度 DHA(100、200、300μmol/L)对细胞进行处理,结果发现当DHA浓度为300μmol/L时具有明显诱导细胞凋亡的作用。(见图2)。

图2 DHA或EPA对H460及H1975细胞凋亡的影响

图3 DHA或EPA对H460及H1975细胞周期的影响
2.3 DHA和EPA对人肺腺癌H1975及H460细胞周期的影响
EPA 200μmol/L及不同浓度 DHA(100、200μmol/L)处理肿瘤细胞后,显示:EPA 200μmol/L及DHA 100、200μmol/L对 H1975及 H460的细胞周期无明显影响。见图3。
2.4 survivin蛋白在H460及H1975肿瘤细胞中的表达
肿瘤细胞经不同浓度EPA和DHA处理24小时后,EPA 浓度分别为 100、200、300μmol/L 时survivin蛋白表达无明显变化,DHA浓度为100、200μmol/L时处理肿瘤细胞后,survivin蛋白表达无明显变化,400μmol/L EPA处理H460及H1975细胞后,肿瘤细胞survivin表达降低,DHA 300μmol/L、400μmol/L处理H460细胞后,肿瘤细胞survivin表达均降低,DHA 300μmol/L处理H1975细胞后,肿瘤细胞survivin表达降低。由于DHA 400μmol/L处理H1975细胞24小时后,细胞凋亡十分明显,故400μmol/L浓度处理H1975 24小时后未收到survivin蛋白,因此H1975细胞实验结果无400μmol/L DHA浓度组实验结果。高浓度的EPA及DHA可抑制survivin在肿瘤细胞H460及H1975中的表达。见图4。
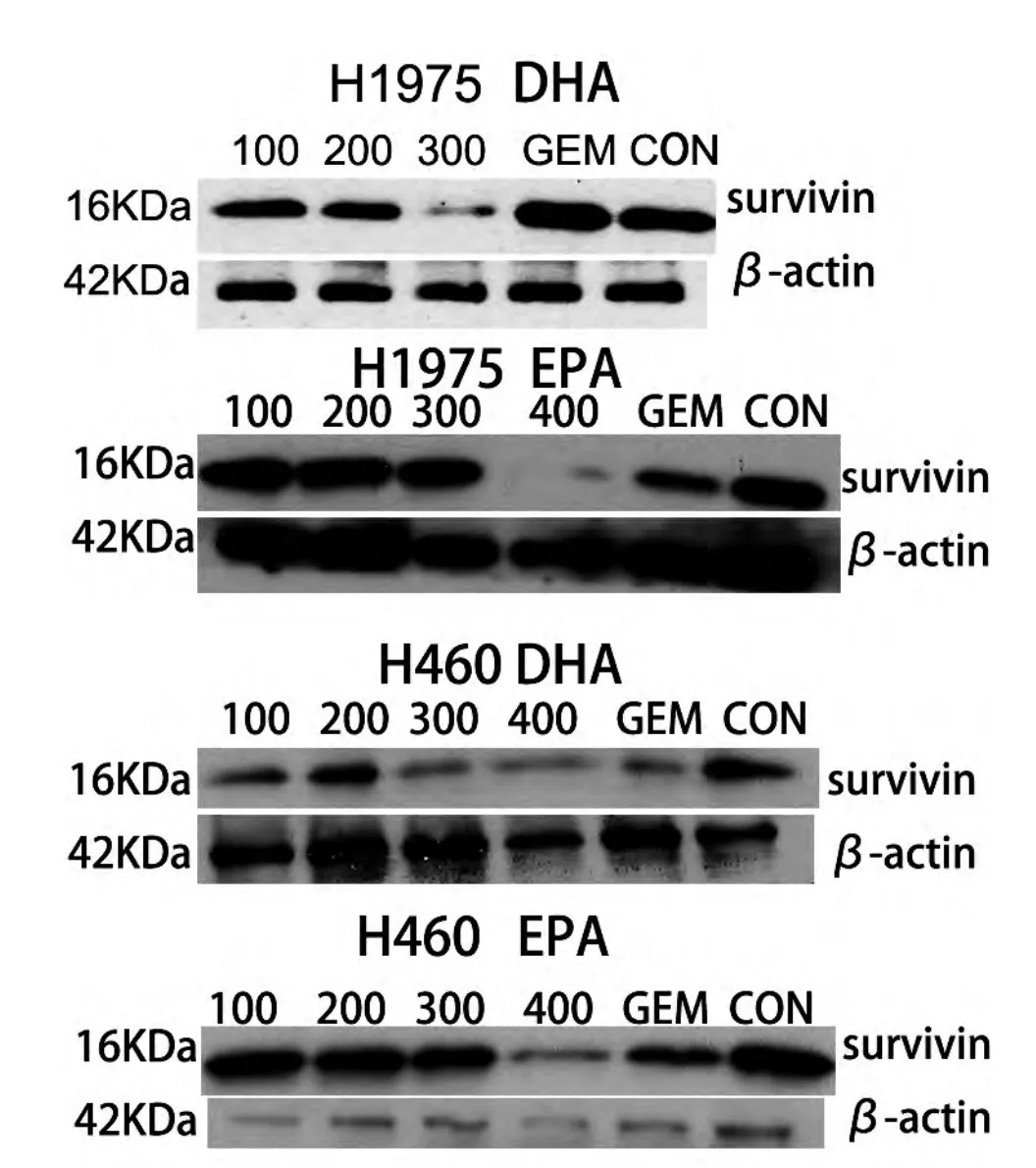
图4 DHA和EPA对肺腺癌细胞H460及H1975中Survivin蛋白表达的影响
3 讨论
Omega-3PUFAs是一类重要的多不饱和脂肪酸,也是人体内必须的营养成分之一,与人类多种生理活动密切相关。omega-3PUFAs可降低心血管疾病的发生[9]。近年的研究发现,omega-3PUFAs可促进肿瘤细胞的凋亡及抑制肿瘤细胞增殖,但国内关于omega-3PUFAs对肺癌细胞的研究较少。
本研究以不同浓度和不同时间点的EPA和DHA作用于人肺腺癌细胞,用CCK-8方法测定肿瘤细胞活性,结果表明,低浓度omega-3PUFAs对人肺腺癌细胞无明显作用,而高浓度omega-3PUFAs可抑制人肺腺癌细胞H1975及H460肿瘤细胞活性,提示高浓度EPA和DHA对人肺腺癌细胞H460及H1975有抑制作用。用流式细胞仪检测肿瘤细胞凋亡及细胞周期,结果表明,低浓度 omega-3PUFAs对肿瘤细胞凋亡无明显影响,高浓度DHA可诱导肿瘤细胞的凋亡;omega-3PUFAs对人肺腺癌细胞H1975及H460的细胞周期无明显影响。用western法检测Survivin蛋白在H460及H1975肿瘤细胞中的表达,发现低浓度omega-3PUFAs对Survivin蛋白在H460及H1975肿瘤细胞中的表达无明显影响,而高浓度omega-3PUFAs处理肿瘤细胞后,survivin表达减弱。
Kikawa[10]等通过增强电离辐射及补充 DHA诱导人肺腺癌细胞A549的氧化应激及细胞凋亡中发现:增强电离辐射及补充DHA能诱导人肺腺癌细胞A549的氧化应激及细胞凋亡,且联合增强电离辐射及补充DHA比单独采用上述方法的效果更佳。本实验研究了 omega-3PUFAs对人肺腺癌细胞A549、H1975及H460细胞活性的影响,但我们发现omega-3PUFAs对A549的细胞活性无明显影响(结果未展示),而 omega-3PUFAs对人肺腺癌细胞H1975及H460的细胞活性有抑制作用。本研究与Kikawa KD研究结果不一致可能是由于检测方法的差异所致,该研究使用胰蛋白酶消化后用台盼蓝染色计数,使用血细胞计数器对无污点的细胞计数,其结果表明DHA对A549细胞有明显抑制作用,而用流式细胞术检测细胞凋亡结果表明DHA对A549细胞的抑制作用不明显,其差异可能是由于其系统误差而导致。而本研究采用CCK-8试剂盒及酶标仪在波长450 nm条件下测定OD值,这种检测方法的系统误差相对前者较小。
本研究发现omega-3PUFAs处理肿瘤细胞后,survivin表达减弱,我们推测 omega-3PUFAs对H1975及H460的细胞凋亡作用机制可能与omega-3PUFAs改变肿瘤细胞survivin基因蛋白的表达相关。survivin是凋亡抑制蛋白(inhibitor of apoptosisprotein,IAP)家族的成员。survivin表达于胚胎和发育的胎儿组织,且在大部分肿瘤如乳腺癌、肺癌、胃癌、前列腺癌以及膀胱癌中显著表达,而在正常分化的组织中几乎不表达。生物学上,survivin已经被证明能够抑制细胞凋亡,促进肿瘤转移和促进血管生成,其抑制凋亡的机制可能与survivin通过调控线粒体凋亡途径发挥抗肿瘤细胞凋亡作用有关。关于survivin在肺癌中的表达目前报道较少。随着癌前细胞向癌细胞的转化,survivin的表达逐渐升高,survivin阳性提示组织学正常的组织存在癌变的可能,survivin表达随肿瘤细胞分化程度降低而呈上升趋势,预示肺癌有较高的浸润性和不良预后。由于survivin在正常组织和肿瘤组织中的表达存在较大差异,目前survivin作为癌症的预后指标及一个新的抗癌治疗靶点成为一个研究热点[11-14]。
李芳芳[6]等在研究中表明 omega-3PUFAs脱氢酶基因fat-1能有效抑制肺腺癌细胞,胡振东[7]等在研究中表明多不饱和脂肪酸各有效成分对肺腺癌细胞有不同程度的抑制作用,并随浓度增加其抑制作用增加,以上两个研究间接支持我们结果。而Zhang[15]等在研究中发现PUFA摄入对肺癌发生的风险没有显著影响,与本实验结果不相似,该研究为meta分析,可能存在研究之间的异质性。
膳食中的PUFAs对人类恶性肿瘤发生、发展的影响已成为国内外的研究热点,大量研究证实了不同比例omega-3PUFAs对恶性肿瘤的增殖具有不同程度的影响,从众多调查研究来看,omega-3 PUFAs能够降低恶性肿瘤发生的风险,有研究[16]发现omega-3PUFAs可通过促进细胞凋亡抑制胃癌细胞的生长。但是也有一些研究对omega-3 PUFAs能够降低癌症发生风险这个观点提出了争议,有学者[17]发现摄入omega-3 PUFAs与降低胃癌发生的风险并没有相关性。
综上所述,DHA和 EPA对人肺腺癌细胞H1975及H460细胞有明显的抑制细胞活性及诱导细胞凋亡作用,但对细胞周期作用影响不明显,其抑制细胞活性及诱导凋亡的作用机制可能与omega-3PUFAs改变了肿瘤细胞survivin蛋白的表达有关。但本研究未对omega-3PUFAs在人体内是否抑制肺腺癌细胞生长这个问题进行研究。该研究表明omega-3PUFAs对肺癌治疗可能有潜在应用前景,值得进一步探索。
[1] Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008,GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2] Jemal A,Bray F,Center MM ,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[3] Azrad M,Turgeon C,Demark-Wahnefried W.Current evidence linking polyunsaturated Fatty acids with cancer risk and progression[J].Front Oncol,2013 ,3:224.
[4] Berquin IM,Edwards IJ,Kridel SJ,et al.Polyunsaturated fatty acid metabolism in prostate cancer[J].Cancer Metastasis Rev,2011,30(3-4):295-309.
[5] Prieto-Hontoria PL,Pérez-Matute P,Fernández-Galilea M ,et al.Role of obesity-associated dysfunctional adipose tissue in cancer:a molecular nutrition approach[J].Biochim Biophys Acta,2011,1807(6):664-678.
[6] 李芳芳,葛银林,李艳君,等.n-3多不饱和脂肪酸脱氢酶基因fat-1在人肺癌细胞H460内的表达[J].青岛农业大学学报(自然科学版),2011,28(3):215-218.
[7] 胡振东,尹 荣,武雅琴,等.多不饱和脂肪酸不同组分抑制肺腺癌干细胞作用研究[J].南京大学学报(自然科学),2013,49(1):116-122.
[8] Heather M,Fuzhi L,Donald E,et al.Fish oil supplementation inhibits NNK-induced lung carcinogenesis in the A/J mouse[J].Nutr Cancer,2009,61(5):663-669.
[9] Laake K,Myhre P,Nordby LM,et al.Effects of omega 3 supplementation in elderly patients with acute myocardial infarction:design of a prospective randomized placebo controlled study[J].BMC Geriatr,2014 ,14:7.
[10] Kikawa KD,Herrick JS,Tateo RE,et al.Induced oxidative stress and cell death in the A549 lung adenocarcinoma cell line by ionizing radiation is enhanced by supplementation with docosahexaenoic acid[J].Nutr Cancer,2010,62(8):1017-1024.
[11] Cheung CH,Huang CC,Tsai FY,et al.Survivin-biology and potential as a therapeutic target in oncology[J].Onco Targets Ther,2013,6:1453-1462.
[12] Zhang LQ,Wang J,Jiang F,et al.Prognostic value of survivin in patients with non-small cell lung carcinoma:a systematic review with meta-analysis[J].PLoS One,2012,7(3):e34100.
[13] Temraz S,Mukherji D,Shamseddine A.Potential targets for colorectal cancer prevention[J].Int J Mol Sci,2013 ,14(9):17279-17303.
[14] Liu JL,Gao W,Kang QM ,et al.Prognostic value of survivin in patients with gastric cancer:a systematic review with meta-analysis[J].PLoS One,2013 ,8(8):e71930.
[15] Zhang YF,Lu J,Yu FF,et al.Polyunsaturated fatty acid intake and risk of lung cancer:a meta-analysis of prospective studies[J].PLoS One,2014 ,9(6):e99637.
[16]尹 勇,詹文华,彭俊生,等.ω-多不饱和脂肪酸诱导人胃癌细胞凋亡的实验研究[J].中华胃肠外科杂志,2007,10(6):570-3.
[17] Wu S,Liang J,Zhang L,et al.Fish consumption and the risk of gastric cancer:systematic review and meta-analysis[J].BMC Cancer,2011,11:26.
