肾细胞癌组织中的组蛋白甲基化酶表达及其临床意义
2015-12-02韦秀望易晓明唐朝朋徐振宇梁建波蓝志相周文泉
韦秀望,易晓明,唐朝朋,徐振宇,梁建波,蓝志相,周文泉
0 引 言
肾癌发生发展是多因素作用下的复杂过程,除基因重组、突变等传统遗传修饰之外,DNA异常甲基化和组蛋白修饰等同样存在极大影响[1]。组蛋白甲基化酶(histone methylase SET domain containing 8,SET8)/赖氨酸甲基转移酶为含有SET结构域的甲基化转移酶家族成员之一,是一个特异对组蛋白H4K20进行单甲基化修饰的酶。SET8通过对组蛋白进行 H4K20me1参与转录调控[2]、异染色质形成[3]、基因组稳定[4]、细胞周期进程及发育[5]等生物学过程。β-catenin定位于染色体3q21,是由CTNNB1基因编码的连环蛋白家族成员。β-catenin是经典Wnt信号通路中的第二信使,当其从细胞膜移至细胞浆和细胞核时,将激活靶基因TCF/LEF的转录,这被认为是许多肿瘤中异常Wnt信号激活最为常见的形式。β-catenin异常的亚细胞定位及积聚与细胞恶性转化、肿瘤发生密切相关[6-7]。本研究旨在运用免疫组织化学技术,观察肾细胞癌(renal cell carcinoma,RCC)标本及其相应癌旁组织中SET8以及Wnt通路的重要信号分子β-catenin的表达情况,揭示SET8与Wnt信号通路的关联,并探讨其在RCC中的作用机制及临床意义,从分子生物水平探究组蛋白甲基化与肾癌发生发展之间存在的关联。
1 资料与方法
1.1 临床资料 选取2010年至2012年广西壮族自治区人民医院的RCC标本50例。50例患者中男 33 例(66.7%),女 17 例(33.3%);年龄27~78岁,平均年龄(56.4±14.61)岁,肿瘤直径范围2~12 cm,平均直径4.3 cm。患者中无症状肾癌34例(68%),有泌尿系统症状占 16例(32%)。按AJCC分期标准:Ⅰ期(T1N0M0)12例、Ⅱ期(T2N0M0)16例、Ⅲ期(T1-T3N0-N1M0)14例、Ⅳ期(T0-T4N0-N1M0-M1)8例;高分化(G1)33例、中分化(G2)11例、低分化(G3)6例。选择距肿瘤边缘3 cm以外的相应正常肾组织作为对照。全部患者术前均未接受化疗、放疗或其他抗癌治疗。
1.2 试验方法 对每一例病理标本连续4 μm切片3张,分别进行HE染色和SET8免疫组化染色,抗SET8抗体稀释浓度为1∶100,PBS代替一抗作替代对照。HE染色:新鲜组织经10%中性甲醛溶液固定,然后进行常规脱水、透明、浸蜡包埋处理,切片机4 μm切片,HE染色。免疫组化染色(同时染色βcatenin):①4 μm石蜡切片,继而二甲苯脱蜡,乙醇水化;②运用高压锅高温高压进行抗原修复,自然冷却,水洗;③用PBS(pH7.4)漂洗;④滴加50μL一抗(兔抗人SET8单克隆抗体,工作效价为1∶100),置入4℃冰箱过夜;⑤PBS冲洗;⑥滴加50 μL二抗(酶标抗兔聚合物),37℃孵育;⑦PBS冲洗,DAB显色剂显色;⑧自来水漂洗,苏木精衬染及蓝化,梯度乙醇脱水,二甲苯透明,中性树胶封片。结果判断:①光镜下HE染色的病理诊断标准:单盲法病理学复查,确定诊断为RCC,并进行病理分级。②光镜下SET8免疫组化标记表达的判定标准:对染色阳性反应性强弱进行打分。SET8免疫组化染色结果采用二级记分法:第1级计分方式:根据染色范围记分,着色范围以百分率进行记分(400倍镜下连续计数200个细胞),≤1%计分为0分,1% ~20%计分为1分,20% ~50%计分为2分,>50%计分为3分。第2级计分方式:着色程度,依据其深浅记分。无着色计分为0分,较浅着色计分为1分,较深着色计分为2分。将上述2项分值相加做为着色强度积分值:分值≤1.9分为阴性(-),分值2.0~2.9分为弱阳性(+),分值3.0 ~3.9 分为阳性(2+),分值≥4分为强阳性(3+)。以PBS代替一抗的阴性对照染色结果显示无阳性。③光镜下β-catenin免疫组化标记表达的判定标准按照Maruyamaeta et al方法,分别从细胞膜、细胞质、细胞核判断其在细胞内的分布情况。细胞膜>70%细胞阳性为正常表达,反之为细胞膜表达缺失;细胞质或细胞核>10%细胞阳性为细胞质或细胞核阳性表达,即异位表达。
1.3 统计学分析 采用统计软件SPSS 19.0对数据进行分析。运用配对χ2检验检测组间阳性表达率差异,运用Spearman相关检验进行相关性分析,以P≤0.05为有统计学意义。
2 结 果
2.1 HE染色和SET8免疫组化染色结果
2.1.1 HE染色结果 50例RCC中,集合管癌5例伴转移,肾透明细胞癌45例,其中8例存在远处转移。50例肿瘤相应癌旁3 cm以外的肾组织均为正常肾组织。
2.1.2 SET8免疫组化染色结果 SET8在正常肾组织及RCC组织中的表达主要集中在细胞质中,细胞膜及细胞核亦有表达,免疫组化颗粒状呈棕黄色染色。50例RCC组织中,38例呈阳性表达,12例呈阴性表达,其中8例伴随远处转移的肾透明细胞癌组织呈强阳性表达,1例伴随远处淋巴结转移的肾透明细胞癌组织呈阴性表达,5例集合管癌伴转移组织亦呈强阳性表达,无阴性表达。此外,SET8在肾癌血管内皮细胞中亦出现阳性表达。SET8的表达阳性率及其染色强度与患者年龄、性别、肿瘤直径、组织学亚型及临床表现无关(P>0.05),与病理分期、肿瘤细胞分级有关(P<0.05)。见表 1,图 1、图 2。
2.2 β-catenin表达与RCC临床及病理特征的关系 β-catenin在正常肾组织中的表达集中在肾小管、集合管上皮细胞的细胞膜,免疫组化呈棕黄色网格状分布,或于细胞间交界处染色,细胞质和细胞核呈阴性表达。β-catenin的异常表达为细胞膜表达减弱或缺失,在RCC组织中出现细胞质及细胞核阳性表达,即异位表达。β-catenin的异常表达与患者病理分期、肿瘤细胞分级有关(P<0.05)。见表1,图3、图 4。
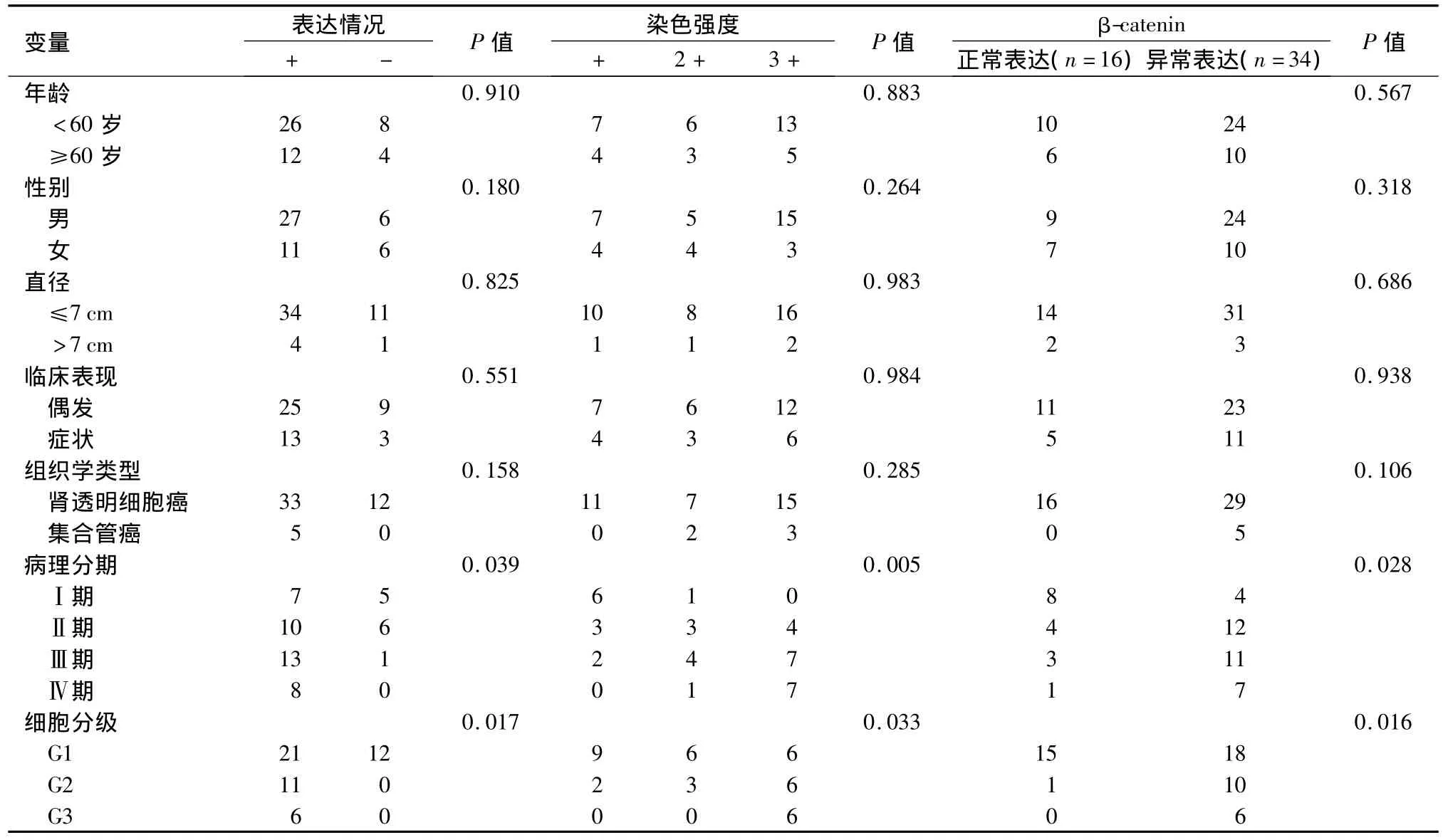
表1 SET8表达及其染色强度、β-catenin表达与RCC临床及病理特征的关系(n)Table 1 Expression and staining intensity of SET8,expression of β-catenin,and their correlation with the clinical and pathological characteristics of renal cell carcinoma(n)

图2 集合管癌组织中SET8的阳性表达(Elivision×200)Figure 2 Expression of SET8 in the renal collecting duct carcinoma tissue(Elivision×200)

图3 肾透明细胞癌组织中 β-catenin的阳性异位表达(Elivision×200)Figure 3 Expression of β-catenin in the renal clear cell carcinoma tissue(Elivision×200)

图4 集合管癌中β-catenin的阳性异位表达(Elivision×200)Figure 4 Expression of β-catenin in the renal collecting duct carcinoma tissue(Elivision×200)
2.3 SET8与β-catenin蛋白的关系及在RCC与肾组织中表达的比较 SET8的表达与β-catenin蛋白异常表达呈正相关(r=0.219,P=0.040)。RCC 与癌旁正常肾组织中SET8阳性表达率差异无统计学意义(P=0.214)。β-catenin蛋白异常表达率在RCC及癌旁正常肾组织中,差异有统计学意义(P<0.001)。见表2。
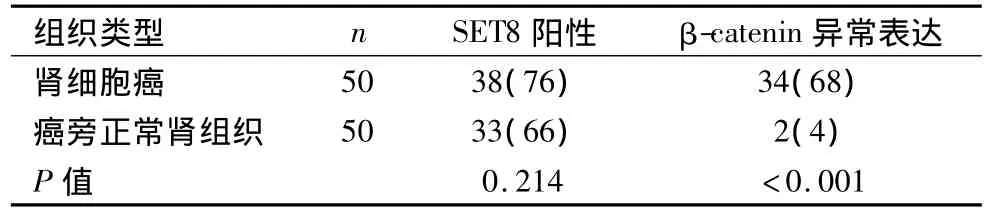
表2 SET8和β-catenin蛋白在RCC及癌旁正常肾组织中的表达[n(%)]Table 2 Expressions of SET8 and β-catenin in the renal cell carcinoma and adjacent noncancerous tissues n(%)
3 讨 论
SET8在肾组织的表达集中在肾小管细胞质及细胞膜中,在RCC组织的表达主要集中在细胞质中,细胞膜及细胞核亦有表达[8]。病理分期及细胞分级越高、分化越差的RCC组织中SET8的阳性率越高,染色强度也相应显著增强,提示在肿瘤进展过程中SET8扮演重要角色,印证了组蛋白甲基化与RCC发生发展之间的密切联系。本研究中3例RCC伴转移的标本进行分析发现,SET8同样出现大量表达,这与上述提到的相关研究提出的组蛋白单甲基化与肿瘤远处转移相关,SET8可能作为调控肿瘤远处转移的潜在靶点的说法相同。此外,SET8在肾癌血管内皮细胞中亦出现阳性表达,提示其在肿瘤血管生成过程中可能发挥着重要作用。
β-catenin在正常肾组织中的表达集中在肾小管、集合管上皮细胞的细胞膜,或于细胞间交界处染色,细胞质和细胞核呈阴性表达。β-catenin的异常表达为细胞膜表达减弱或缺失,在RCC组织中出现细胞质及细胞核阳性表达,即异位表达。和SET8类似,β-catenin的异常表达与之存在相当大的一致性。
SET8可以特异的对含有R-W-z-K-X-F结构(W代表一个芳香族氨基酸,z代表一个非酸性氨基酸,F代表一个大的疏水氨基酸,R代表精氨酸,K即被修饰的精氨酸)的蛋白质序列进行单甲基化修饰[9]。本研究给我们很多启示,在Wnt信号通路被激活时,SET8作为一个转录激活辅助因子对组蛋白进行H4K20me-1修饰,调节染色体构象,从而招募更多转录因子聚集,开启下游基因转录[10-11]。SET8对β-catenin的调节以及在Wnt信号通路中是否存在SET8的新的底物,仍然悬而未决[12]。于此同时,当SET8参与进Wnt信号通路时,它是否会受到Wnt信号的调控同样值得思考,即Wnt信号是否可以通过或绕过β-catenin对SET8进行修饰,从而影响SET8的活性改变,进而影响H4K20me-1的过程,最终对肿瘤的发生发展造成影响[13]。
Wnt信号通路的异常激活参与包括肾癌在内的肿瘤发生发展已经得到大量的研究验证[14-15],对其机制的研究也取得了进展,而本研究探讨了SET8在RCC中表达,肯定了其与Wnt信号通路的关联性,并探讨其在RCC中的作用机制及临床意义。目前大量相关研究都还未揭示SET8对Wnt信号通路激活的具体机制[16],但是本研究提供了一些证据表明SET8与激活Wnt信号通路的激活有着密切关联,而且Wnt诱导的H4K20me-1是靶基因转录的激活性标志,SET8激活的H4K20me-1调控着Wnt信号通路的激活与异常活动,进而影响基因转录与细胞活动,与RCC的发生、发展及远处转移存在必然的密切联系,并可能对肿瘤血管的生成产生重要影响。
[1] Cairns P.Renal cell carcinoma[J].Cancer Biomark,2010,9(1-6):461-473.
[2] Congdon LM,Houston SI,Veerappan CS,et al.PR-Set7-mediated monomethylation of histone H4 lysine20 at specific genomic regions induces transcriptional repression[J].J Cell Biochem,2010,110(3):609-619.
[3] Tardat M,Brustel J,Kirsh O,et al.The histone H4 Lys 20 methyltransferase PR-Set7 regulates replication origins in mammalian cells[J].Nat Cell Biol,2010,12(11):1086-1093.
[4] Oda H,Okamoto I,Murphy N,et al.Monomethylation of histone H4-lysine 20 is involved in chromosome structure and stability and is essential for mouse development[J].Mol Cell Biol,2009,29(8):2278-2295.
[5] Wu S,Wang W,Kong X,et al.Dynamic regulation of the PRSet7 histone methyltransferase is required for normal cell cycle progression[J].Genes Dev,2010,24(22):2531-2542.
[6] Gong A,Huang S.FoxM1 and Wnt/β-catenin signaling in glioma stem cells[J].Cancer Res,2012,72(22):5658-5662.
[7] 董 杰,王龙信,唐朝朋,等.转化生长因子β不敏感的树突状细胞疫苗对肾细胞癌荷瘤小鼠细胞毒性T淋巴细胞的影响[J].医学研究生学报,2013,26(5):455-459.
[8] Beck DB,Oda H,Shen SS,et al.PR-Set7 and H4K20me1:at the crossroads of genome integrity,cell cycle,chromosome condensation,and transcription[J].Genes Dev,2012,26(4):325-337.
[9] Couture JF,Collazo E,Brunzelle JS,et al.Structural and functional analysis of SET8,a histone H4 Lys-20 methyltransferase[J].Genes Dev,2005,19(12):1455-1465.
[10] Li Z,Nie F,Wang S,et al.Histone H4 Lys 20 monomethylation by histone methylase SET8 mediates Wnt target gene activation[J].Proc Natl Acad Sci USA,2011,108(8):3116-3123.
[11] 唐朝朋,徐振宇,周文泉,等.加速康复外科在后腹腔镜肾上腺切除术中的应用[J].医学研究生学报,2014,27(8):829-832.
[12] Schotta G.H4K20 monomethylation faces the WNT[J].Proc Natl Acad Sci USA,2011,108(8):3097-3098.
[13] Holland JD ,Klaus A,Garratt AN,et al.Wnt signaling in stem and cancer stem cells[J].Curr Opin Cell Biol,2013,25(2):254-264.
[14] Kawamoto K,Hirata H,Kikuno N,et al.DNA methylation and histone modifications cause silencing of Wnt antagonist gene in human renal cell carcinoma cell lines[J].Int J Cancer,2008,123(3):535-542.
[15] 易晓明,许 松,何昊玮,等.15-氧代绣线菊内酯对肾癌786-0细胞增殖的抑制作用[J].医学研究生学报,2014,27(12):1250-1253.
[16] Jørgensen S,Schotta G,Sørensen CS,et al.Histone H4 lysine 20 methylation:key player in epigenetic regulation of genomic integrity[J].Nucleic Acids Res,2013,41(5):2797-2806.
