国家医疗器械质量监督抽验分析及思考
2015-12-01李海宁郝擎李静莉任海萍杨昭鹏中国食品药品检定研究院北京市100050
【作 者】李海宁,郝擎,李静莉,任海萍,杨昭鹏中国食品药品检定研究院,北京市,100050
国家医疗器械质量监督抽验分析及思考
【作 者】李海宁,郝擎,李静莉,任海萍,杨昭鹏
中国食品药品检定研究院,北京市,100050
该文对国家医疗器械抽验13年来的抽验品种、抽验数量及质量状况进行了统计分析,对抽验过程中取得的成果进行了的总结,同时针对国家抽验过程中发现的问题提出了建议与对策,为下一步更好的开展国家抽验工作提供参考。
医疗器械;国家质量监督抽验
0 引言
医疗器械是一种特殊商品,上市后产品的质量直接关系到公众的健康和生命安全。因此,医疗器械产品的质量越来越受到人们的关注。1998年国家药品监督管理局成立,2000年4月《医疗器械监督管理条例》[1]正式出台,原国家食品药品监督管理局(简称国家局)为了及时了解上市后产品的质量状况,于2001年针对医疗器械产品的特点、正式开始组织实施国家医疗器械质量监督抽验,到目前为止,国家局已经组织实施了13年国家医疗器械质量监督抽验工作。
1 国家抽验情况统计分析
13年来,共组织对(262)个品种、(17 298)批次的医疗器械进行了质量监督抽验工作,见图1。
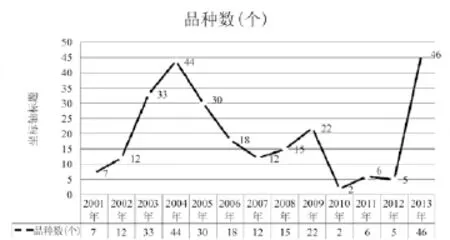
图1 抽验品种统计Fig.1 Number of medical device type sampled
1.1 抽验品种分析
从图1中可以看出,国家抽验品种的选择在经历了2001年、2002年的初始阶段之后,2003年、2004年及2005年抽验的品种上升很快,这期间国家总局投入了大量的人力物力,对市场的情况有了初步的认识。到了2006年,国家局又有了新的思路,认为可以选择少量的品种进行深入的研究,因此首次选择以天然胶乳避孕套为代表的产品,组成4个专项小组,仅对具有裸套生产能力的企业进行抽验,同时深入了解生产企业的质量管理体系,摸清了产品的质量状况及市场状况。2009年到2011年3年间延续了专项抽验的模式,每一年都安排了不同的品种深入了解了产品的质量状况,2009年选择了进口避孕套以及体外诊断试剂[2]两大类产品,其中体外诊断试剂首次进行三大类21个品种全方位的抽验和评价;2010年对一次性使用注射器具及人工晶体[3]进行了专项调研及抽验;2011年对物理治疗设备、体外循环及血液处理类产品、高电位治疗设备、透析粉(液)及配套使用的耗材、导尿管(含药及不含药)进行了专项调研和抽验工作。
1.2 抽样数量分析
通过对13年来抽样数量及抽验品种的对比分析(见图2)可以看出,抽验品种与抽样数量有很强的关联性,抽验品种的多少直接影响到抽样数量的多少,正如上图所示,经历了2001年、2002年的摸索之后2003年、2004年、2005年抽样量达到了较高的水平,2006年、2007年抽样数量相对较少;尤其是2007年,为了彻底摸清产品的质量状况,重点倾向于追踪2006年未抽到的企业及不合格产品,以彻底弄清楚抽样的难点,采取有针对性措施。2012年则由于仅有局本级资金项目,只有2家中央单位承担检验任务,检验数量及品种都相对较少;而2013年国家总局争取到了中央补助地方项目,抽验资金到位,共有33家检验机构共同参与了国家抽验工作,无论从抽样的数量、品种还是参与单位都达到了最大。
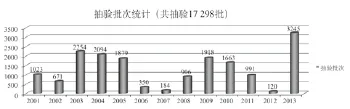
图2 抽样数量统计Fig.2 Quantity of medical device product sampled
1.3 质量及抽验成果分析
通过每年组织的国家抽验工作,主管部门及时了解了上市后产品的市场状况,同时也发现了很多质量问题,我们对13年的年度抽验质量状况进行了统计(见图3),抽验年度的平均合格率在65.2%到96.2%之间,对于质量有问题的医疗器械国家局采取措施进行了及时地追踪和纠正,对净化市场起到了一定的作用。下面就抽验过程中取得的部分成果进行简单的总结。
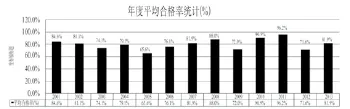
图3 年度抽验符合标准率统计Fig.3 Annually ratio of medical device type sampled compliance with the specifications
1.3.1 甲醇残留事件的发现及妥善处理,及时消除了安全隐患
2007年在开展“医用透明质酸钠”抽验过程中,对“乙醇残留量”进行测定时发现了“较大不明异物残留”,最后经多方确认为“甲醇残留”。国家局立即部署全国范围内的专项检查,对全国9家医用透明质酸钠生产企业的20个规格20批产品进行了甲醇残留专项抽查。结果有5个规格(型号)的产品查出有甲醇残留,有1家进口产品中检出异丙醇,所有国产产品均检出乙苯和二甲苯,危害很大。针对该产品的标准缺失以及原料检验中没有有机溶剂残留检验的相关规定而出现的安全隐患。国家局当即要求各生产企业在“医用透明质酸钠”原料进厂检验或验证时,应进行有机溶媒残留检验或提供第三方检验报告。同时建议标准中增加有害溶剂残留测定指标。这次甲醇残留的发现及处理及时消除了可能出现的安全隐患。
1.3.2 体外诊断试剂产品国家标准品获认可
通过对2009年及2013年体外诊断试剂产品的年度抽验情况进行详细的统计分析后发现,尤其是2013年抽验体外诊断试剂类产品中符合标准率很高,其中抽验的11个品种中有7个品种的符合标准率达到了100%,分析其中的原因发现有些产品采用的是企业的注册产品标准和企业自己提供的参考品,由于没有统一的标准,所以很难客观真实地反映产品的质量状况。针对这种情况,国家总局为了进一步加强体外诊断试剂产品的质量控制,在2014年7月发布的《体外诊断试剂注册管理办法》(总局第5号令)[4](第二十五条:有国家标准品、参考品的产品应当使用国家标准品、参考品进行注册检验……)明确了国家标准品在注册检验中的法定地位,为今后顺利开展国家抽验工作奠定了基础,也为体外诊断试剂产品质量的提升作出了具体的要求。
1.3.3 对重点监控产品的持续监管见成效
主管部门一直以来对于医疗器械重点监控产品非常重视,例如天然胶乳橡胶避孕套,因为它是与百姓生活息息相关,并影响到国家计划生育基本国策、预防艾滋病传播的重要产品,且量大面广。因此国家局先后在2005年、2006年及2009年从不同角度不同侧重组织了一系列的监督抽验。为全方位整治避孕套市场秩序,提高产品质量打下基础。
2 存在的几点突出问题
2.1 分类问题
由于医疗器械产品类别复杂,因此在抽验过程中发现有一些产品的管理类别与其在诊疗过程中的作用和安全风险不相匹配,产品风险程度较高,而实际管理类别较低,例如:防护服、防护屏 、防护眼镜 、甲状腺防护帘、性腺防护器具等防护类产品目前按I类管理,但其中的铅当量性能为高风险项目,企业无自测条件。该项目不合格的产品在使用过程中不能起到应有的防护作用,会使使用者接受更多的X射线照射,造成辐射伤害。因此建议应当提高此类产品的管理类别。
2.2 标准问题
2.2.1 国行标更新不及时、内容存在缺失等
抽验发现,多个产品的国内标准更新速度有待提高。例如:球囊扩张导管产品,其相关的ISO 10555国际标准已更新至2013版,目前的标准内容与新版国际标准相比较,内容较为简单,标准滞后,缺少“流量”,“球囊顺应性”,“球囊卸压时间”和“球囊爆破压力”等项目。除此之外还发现国行标存在内容缺失等问题。例如:小型蒸汽灭菌器 ,其国家标准GB 4793.4—2001《测量、控制及实验室用电气设备的安全 实验室用处理医用材料的蒸压器的特殊要求》,中没有“工作压力”、“最小工作压力”定义,这会造成对标准的理解和把握尺度不一致。
2.2.2 注册产品标准存在诸多问题
医疗器械很多产品没有统一的国行标,但是产品上市后仍需要监管,因此从2008年开始采用企业的注册产品标准作为检验依据进行检验,工作上有了一定程度上的突破,但是几年来的确暴露出了很多问题。例如注册产品技术要求未引用强制性国行标或引用内容不完全;注册产品技术要求相关内容要求低于强制性国行标要求;注册产品技术要求引用国行标错误;注册产品技术要求引用过期作废的国行标;产品主要技术指标或相关条款的试验方法在注册产品技术要求中缺失或描述错误;注册产品技术要求内容与产品实际不符;注册产品技术要求内容前后不一致或与说明书不一致等等。
2.3 审评审批问题
2.3.1 未按管理类别审批
抽验发现管理类别为Ⅰ类的产品在注册时被审批成Ⅱ类,而管理类别为Ⅱ类的产品在注册时被审批成Ⅰ类。例如呼吸道用吸引导管,应为II类产品,实际按Ⅰ类产品进行管理的。
2.3.2 注册产品标准对国行标的执行存在问题
注册产品标准是贯穿产品注册、生产、质量监管等环节的关键依据,若标准引用不当或执行不够,可能导致产品在注册和监管环节上产生矛盾。例如,2013年共抽验呼吸道吸引导管344批次,按照强制性行业标准YY 0339—2009判定,其中263批次不符合标准规定,合格率仅23.6%,若按照各自的注册产品标准判定,则有121批次不符合标准,合格率为64.8%。这说明至少142批次样品符合注册产品标准却不符合行标,占抽样量的41.3%。
3 建议与对策
3.1 逐步完善医疗器械标准化管理
3.1.1 加快国行标更新速度,解决分类交叉问题,建立科学合理的医疗器械标准体系
建议提高抽验发现问题的国家标准、行业标准的更新速度;重视并通过各种渠道收集存在漏洞或歧义的国行标相关条文,并及时组织修订。针对分类问题,建议及时完善医疗器械分类目录和编码,解决分类原则不统一和分类交叉等问题;同时理清医疗器械标准的层次结构,明确标准级别设定原则;优化标准专业分布;尽快研究出切实可行、科学合理、具有一定前瞻性的医疗器械标准体系,从而全面提升医疗器械标准的整体效能,更好地发挥其技术基础和技术支撑作用,为更好地开展国家抽验工作打下坚实的基础。
3.1.2 不断提高注册产品标准(产品技术要求)的质量
标准在国家抽验中的地位至关重要,它是评价产品质量的重要依据。对于目前注册产品标准中存在的缺项、检测方法不统一、撰写不规范等问题,一方面,应加快国行标制订及修订的步伐,尽快统一行业标准;另一方面,建议加强标准化基本知识的培训,同时在注册检验时对注册产品标准(产品技术要求)的预评价给出科学合理的建议,从而提高注册产品标准(产品技术要求)的质量。
3.2 规范提高审评审批水平
建议加强审批审评部门的业务指导,及时关注行业动态和相关国家标准、行业标准的更新情况;针对存在审评尺度不一、把关不严等问题的医疗器械产品,建议制订统一的审评原则;在审评审批过程中督促企业及时更新标准并调整产品结构,对变化的标准项目及时进行补充测试,使产品满足新版标准的要求。
3.3 不断完善信息化建设
注册产品标准索取困难是历年国家医疗器械抽验工作的难题。一些单位对索取注册产品标准存有疑虑,一些单位则拒不配合。抽验过程中标准的索取仍然耗费了抽样单位、检验单位大量的人力物力,严重影响抽验工作进展。建议能够尽快完成相关信息化建设,面向监管系统共享医疗器械第三类产品注册信息及备案标准库、进口医疗器械产品注册信息及备案标准库、各省医疗器械注册信息及备案标准库,更好地为监管服务。
3.4 加强医疗器械检验机构能力建设
2013年共有33个医疗器械检验机构参与了监督抽验,这尚属首次,在这个过程中确实存在医疗器械检验机构能力分布不均的问题,因此建议结合国务院关于整合检验检测认证机构的精神,进一步加强各医疗器械检验机构的能力建设,尽快完善医疗器械监督检验相关基础设施,优化装备配置,提高检验能力和水平。制定出更加科学合理的抽验方案 。
3.5 采取相应措施,提高抽样效率
建议开展医疗器械抽验职能分布的摸底调研,理顺业务关系;同时建议确定医疗器械抽样工作负责人和联系人,对抽样工作完成情况进行考核;同时,要努力降低退样率,尽量减少抽错样品的可能性。一方面,要加强抽样人员的专业培训,规范操作,提高监督检验工作的质量和效率;另一方面,应统一医疗器械的命名规则,规范医疗器械的名称,使抽样的产品从名称上易于识别。
4 复验工作的展望与探讨
2006年国家局首次颁布了《国家医疗器械质量监督抽验管理规定》[5],较好地指导了国家抽验工作。2013年为了更好的适应新形势下医疗器械监管的需要[6],国家总局组织修订了《医疗器械质量监督抽查检验管理规定》[7],对多个关键问题作出了修订,其中复验申请可以向“具有相应资质的医疗器械检验机构提出”一处引起了广泛关注,也打破原来通常在原承检机构进行复验的惯例。这本身对于检验机构来讲既是机遇又是挑战。挑战是抽验工作更加趋于透明,不再是一家之言,这就要求所有承检机构要更加审慎处理不合格产品,要求检验机构本身要具有较高的技术水平、出具的检验报告要有较强的说服力。机遇则是其他具有相应资质的检验机构有机会通过复验来体现自己的技术水平和能力,展示自己在某个检验领域所具备的优势,进一步得到大家的认可。这原本是最大限度的保障企业的合法权利,但是也不排除有部分企业试图钻空子、打擦边球的可能。因此,针对复验环节的有关协调和运转机制还有待进一步完善。2014年将是真正执行新复验程序的第一年,建议及时了解并收集复验过程中遇到的各种新情况、新问题,及时予以协调处理,确保抽验工作的公平公正。
[1] 中华人民共和国国务院令 第276号 原医疗器械监督管理条例[R]. 2000.
[2] 李海宁, 母瑞红, 任海萍, 等. 体外诊断试剂监管现状分析及思考[J]. 中国医疗器械杂志, 2011, 35(1): 68-70.
[3] 李海宁, 白东亭. 对人工晶体市场调研情况的思考[J].中国药事, 2011, 25 (4): 358-360
[4] 国家食品药品监督管理总局令 第5号 体外诊断试剂注册管理办法[R]. 2014.
[5] 原国家食品药品监督管理局. 国食药监市[2006]463号, 关于印发《国家医疗器械质量监督抽验管理规定(试行)》的通知[R]. [2006-09-07]
[6] 郝擎, 石现.《国家医疗器械质量监督抽验管理规定》修订探讨[J]. 中国医疗器械杂志, 2013, 37(5): 373-378.
[7] 国家食品药品监督管理总局. 医疗器械质量监督抽查检验管理规定[R]. 2013 .
Analysis of the National Quality lnspection for Medical Devices
【Writers】LI Haining, HAO Qing, LI Jingli, REN Haiping, YANG Zhaopeng
National Institutes for Food and Drug Control, Beijing, 100050
This paper analyses overall situation of the national quality inspection for medical devices in recent 13 years. The statistics cover the inspected varieties, sampling quantity and quality status. The achievements and suggestions are provided, which are helpful for future work.
medical device, testing for the state quality supervision
F203
A
10.3969/j.issn.1671-7104.2015.02.015
1671-7104(2015)02-0132-04
2014-11-20
杨昭鹏,E-mail:yangzp@nifdc.org.cn
