儿童Alport综合征的听力学特征多样性研究
2015-12-01王蓬鹏王华张亚梅刘世琳郑军刘海红张莉张杰
王蓬鹏王华张亚梅刘世琳郑军刘海红张莉张杰
1首都医科大学附属北京儿童医院耳鼻咽喉头颈外科,儿童耳鼻咽喉头颈疾病北京市重点实验室(北京100034)
2首都医科大学附属北京同仁医院耳鼻咽喉头颈外科(北京,100730)
儿童Alport综合征的听力学特征多样性研究
王蓬鹏1王华1张亚梅1刘世琳1郑军2刘海红1张莉1张杰1
1首都医科大学附属北京儿童医院耳鼻咽喉头颈外科,儿童耳鼻咽喉头颈疾病北京市重点实验室(北京100034)
2首都医科大学附属北京同仁医院耳鼻咽喉头颈外科(北京,100730)
目的探讨儿童Alport综合征(Alport Syndrome AS)听力学特点多样性及预后。方法分析2007-2013年北京儿童医院确诊的43例AS患者的听力学特点,病理改变及临床特点并进行电话随访,并进行统计学分析。结果 43例诊断为AS儿童中男性36例,女性7例,年龄22个月-13岁,中位数年龄8岁,听力正常组33例,听力异常组10例。①23.2%AS患儿合并感音神经性聋,并且全部为男性,中度聋最常见占70%;②听力曲线图包括谷型7例(70%)、陡降型2例(20%)、平坦型1例(10%);其中有30%听力曲线呈非对称分布;③比较耳听力正常组及耳听力异常组肾脏病理间差异性,存在耳部症状的患者,电镜足突病变较重,两组间差异有统计学意义;④电话回访发现正常听力组有近1/3的受访者诉听力有下降,而全部听力异常组的受访者听力进行性下降,1例重度听力损失患儿发展为终末期肾病 结论 耳部病变是AS的常见症状,其听力曲线多样,并有部分呈非对称分布,儿童期听力损失呈进行性下降趋势,听力异常是显著足细胞病变一个指标。
Alport综合征;听力损失;儿童
Alport综合征(Alport Syndrome,AS)是一种遗传性基底膜病变,患者具有肾脏、眼部及耳部病变,又称"眼耳肾综合征"[1]。听力损失是Alport综合征的首发症状之一,通常为双侧对称性感音神经性聋[2],而近来有研究发现在不同年龄组的人群听力损害发生率及听力曲线不同,不同遗传方式听力损害的发生率也不同[3],在儿童及青少年期呈现进行性加重的特点[4],同时其听力损失的程度与慢性肾衰竭预后相关[5],本文对我院在2007-2013年确诊为AS的43例儿童进行回顾性的研究,通过临床资料及电话随访情况,分析听力学特点,预后,及听力损伤与肾损伤及预后的相关性。
1 研究对象
1.1收集2007年1月至2013年12月在北京儿童医院诊断为Alport综合症的43例患者的完整临床资料,包括就诊的年龄及原因、明确诊断的年龄、家族史、常规体检和实验室检查(尿常规、肾功能、肾活检等),耳鼻咽喉专科检查和听力学检查(2岁以上儿童行纯音测听或行为测听、或听性脑干测听、声导抗测听,2岁以下小年龄组儿童行听性脑干测听和多频稳态听觉诱发反应、声导抗测听)。
2 研究方法
2.1研究过程
首先分析43例患儿的听力学特点,包括听力损失的程度、类型,及听力曲线对称性及听力曲线分布特征,以及听力损失与肾脏病理的相关性。此后于2015年3月统一进行随访,随访年限为19-94个月,内容包括询问患儿听力损失情况,肾病发展情况,分析中涉及的定义及分类标准如下。
2.1.1Alport综合征诊断标准
按照Flinter等[2]建议的Alport综合征的诊断标准进行记录,即下面4项标准:(1)家族性血尿伴或不伴进行性肾功能减退;(2)电镜下肾小球基底膜厚薄不均、断裂分层交叉成丝网状;(3)高频区感觉神经性耳聋;(4)眼部病变典型改变为前球形晶状体及黄斑周围颗粒。所有病人符合相应诊断。
2.1.2听力学诊断
听力损失程度采用WHO1997年的提出的分类标准,即按照0.5-4.0 kHz平均听阈(pure tone average, PTA)分为正常(≤25 dB)、轻度(26-40 dB)、中度(41-60 dB)、重度(61-80 dB)、极重度(≥81 dB))5个级别。
2.1.3听力损失类型
依据0.5-4.0 kHz范围内骨导-气导听阈差值,将听力损失分为传导性(骨导听阈位于正常范围,气导听阈位于正常范围之外)、感音神经性(骨、气导听阈均位于正常范围之外,且骨导-气导听阈差值≤10 dB)、混合性(骨、气导听阈均位于正常范围之外,且骨导-气导听阈差值>10 dB)3种类型。
2.1.4听力曲线类型
听力曲线类型定义参考Pittman等[6]于2003年提出的分类标准,具体分类标准:下降型(0.25-8.00 kHz范围内听阈逐渐下降,8.00 kHz与0.25 kHz听阈差值大于20 dB)、上升型(0.25-8.00 kHz范围内听阈逐渐上升,8.00 kHz与0.25 kHz听阈差值大于20 dB)、平坦型(0.25-8.00 kHz范围内各频率听阈差值不超过20 dB)、U型(0.50~4.00 kHz范围内1个或多个频率听阈与0.25 kHz和8.00 kHz中较差听阈之差≥20 dB)和其他(不满足上述分类标准的其他听力曲线类型)。
2.1.5听力曲线的对称性分析[7]
对称性听力曲线定义为双耳间0.50~4.00k Hz范围内平均听阈差值不超过10 dB。
2.2统计学方法应用SPSS 17.0统计软件分析,计数比较用卡方检验;P<0.05为差异有统计学意义。
3 结果
3.1一般资料
在2007-2013年确诊的AS病例43例,年龄22个月—13岁,中位年龄8岁,病史从4天至9年,初诊年龄9个月-12岁,其中5例肾功正常,36例慢性肾功能不全,2例慢性肾功能衰竭;有家族史者30例;发病年龄与合并听力损失情况如表1。

表1 发病年龄与合并听力损失情况
3.2在本组研究的43例患儿中合并有听力损伤的10例,占总研究患儿的23.2%,全部为男性,病史7天至8年,10例患者均有血尿,8例患者同时合并蛋白尿,仅1例患者肾功能正常,其余9例均有慢性肾功能衰竭,基本临床资料如表2,本组研究者均为感音神经性聋,轻度聋1例(10%),中度聋7例(70%),重度聋2例(20%)。鼓室导抗图均为A型。依据听力曲线类型的定义,听力曲线图有3种形式如图1:谷型7例(70%)、下降型2例(20%)、平坦型1例(10%);依据听力曲线对称性分布特征的定义,本组研究中有7例(70%)听力曲线呈对称分布,3例(30%)听力曲线呈现出非对称分布特征。

图1
3.3听力损失与病理表现
43例患儿中均行电镜病理检查,提示有特征性肾小球基底膜的改变,其主要表现为肾小球毛细血管丛上皮细胞肿胀,足突融合,毛细血管基底膜厚度不均匀,比较耳听力正常组及耳听力异常组肾脏病理间差异性,存在耳部症状的患者,电镜足突病变较重,两组间差异有统计学意义(表3)

表3 AS患儿耳听力正常组及异常组之间电镜病理特点比较
3.4听力损失与眼部病变
43例患儿中均行眼部视力检查和眼底检查,其中共有15例儿童存在不同程度的屈光不正,听力正常组中有24.2%(8/33)的儿童合并眼部病变,而听力异常组中有70%(7/10)的儿童合并眼部病变,其中有1例重度听力下降的儿童合并黄斑病变,1例中度听力下降的儿童合并白内障。
3.5电话随访听力损失情况
共随访35例,失访8例,听力异常组:8例,听力正常组:27例。在听力正常组中有7例受访者诉听力有下降(男6例,女1例,年龄6至18岁,中位年龄11岁,AS病史5至11年,中位数为10年),入院时的正常听力曲线如图2,随访时依据电话描述的听力曲线如图3,其中有3例为下降型,4例为平坦型。全部听力异常组的受访者听力进行性下降,1例重度听力损失患儿发展为终末期肾病。

图2
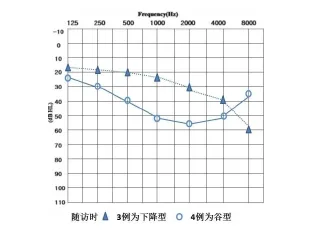
图3
4 讨论
Alport综合征的发病机制是染色体上编码胶原Ⅳ基因突变,使胶原Ⅳ结构及稳定性发生改变,从而在以胶原Ⅳ为主要成分的肾小球、晶体前囊膜、视网膜及内耳基底膜部位引起相关病变,在临床中多有报提示AS病人的听力损失发生、发展,以及听力损失类型的存在者多样性,有国外学者提出发病基因的多态性可能与AS患者听力学的这一特点相关,至今已有300多个COL4A5基因的突变位点被发现,并继续不断被报道。在本次研究中,因为条件所限,所有研究对象未进行基因检测。尽管如此,在询问患儿家族史时,我们发现并非所有AS患儿均有家族史,但合并听力损失的患儿有90%均有明确家族,同时其发病家族成员也不尽相同,因而,我们推测本次研究中AS患儿听力表现出的多态性可能与发病基因的多态性相关。

表2 Alport综合征和合并听力损失患者临床资料
4.1关于儿童AS患者合并听力损失发生率
在往报道中AS患者中感音神经性聋的发生率为50%~67%不等[8],国内有报道18岁以下患AS的儿童合并听力损失者发生率为50%[9]。本组AS患儿中合并有感音神经性聋者为23.2%,6岁以内发生率为8%,低于文献报道的发生率,6-13岁发生率为44%,接近文献报道的发生率,而近期随访发现原听力正常组的儿童中有25%(7/27)出现了听力下降,发生听力异常的中位年龄为11岁,这提示AS患儿的听力损失主要出现在学龄期,并有随年龄增长加重的趋势;从发病的最小年龄来看,本组听力下降的最小年龄为1岁5个月,比文献中记录的更早,这提示内耳损害的可以发生在低年龄段的儿童,听力下降可以是AS的首发症状之一。AS患者中男性发病率明显高于女性[3],本组患儿中发生听力损失者均为男性,在电话随访中,正常听力组中有26%受访者出现听力损失,其中男性仍然明显多于女性(男6例,女1例),而全部听力异常组的受访者听力出现进行性下降,这均于文献报道相仿,提示男性AS患者的听力损失进展的情况也较女性严重。
4.2关于儿童AS患者合并听力损失曲线图多样性与对称性
文献报道AS患者的听力曲线形式多样,主要是以高频听力损害为主,还可有平坦型和谷型听力减退型[4],国内也有文献报道,在听力损伤的早期,听力曲线以槽型(谷型)为主[9],在本次研究发现AS儿童患者的听力曲线以谷型为主(70%),其病史除1例为5年半外,均小于2年,在随访中还发现,原听力常组的AS儿童出现听力下降时的听力曲线也以谷型更多,这提示在AS合并听力损失的早期,谷型听力曲线更为常见。在本次研究的AS患儿中听力下降程度以中度为主(70%),语言频率范围内平均听阈26-75 dB,这与文献报道的语言频率范围内听阈平均值为66 dBHL比较更重[2]。另外,在本次研究中男性患儿听力损失多累及高频区,但有70%同时累及低频区及语频区,这与国外文献报道相似,即男性听损可有其他频率范围累及,听力呈进行性下降,女性较少或出现较晚,多数患者会有残余听力[3]。
文献报道As通常为双侧对称性感音神经性聋[4],而本研究发现本研究显示非对称性听力曲线分布比例达30%(3例),两侧平均听阈差分别为11 dB、21 dB和49dB,病史分别为7天,7个月,9个月,均小于1年,而在7例对称性感音神经性聋的儿童中,仅有1例病史小于1年,其余6例病史均大于1年病史,提示AS儿童患者在儿发病的初期时双耳听力损失可能不完全是对称的。
4.3关于儿童AS患者合并听力损失与病理相关性分析
有研究认为因肾小球、肾小管与耳蜗血管纹之微血管的结构有相似之处,故患肾脏病的同时,耳蜗血管亦可产生病变而导致听力下降,加之底回血管血供丰富,氧耗量大,对缺血缺氧更加敏感[10]。另外,遗传性肾病可有不同程度的蜗管发育不全,基底周螺旋器和神经节细胞病变最明显,故易出现高频听力下降[11]。这种耳聋为进行性的,耳聋程度与肾功能恶化程度成正比。因此是指导判定预后的指标之一。本研究发现听力异常的患者中,有90%的患者其电镜足突病变为部分融合和广泛融合,与听力正常组患者相比较病理表现较重,90%听力正常组患者的电镜足突病变为小部分融合和部分融合,两组间差异有统计学意义。而王海燕等[12]研究显示,持续性蛋白尿组GBM损伤范围及足突融合程度较无或间歇性蛋白尿组大,且足突融合程度与GBM损伤范围呈正相关,提示AS足突损伤与GBM改变有关,且有可能是继发于后者的改变。因此,推测AS基底膜异常有可能是通过引起足突损伤导致蛋白尿发生的,但具体分子水平的研究有待进一步深入。有研究对32例Alport患者进行回顾性分析发现,听力水平与慢性肾衰竭病程有正相关性,终末期肾病组的AS患者,听力损害更明显[5],本项研究在对AS患儿进行电话回访发现听力损失组患儿听力有进行性下降,并有一例重度感音神经性聋患儿发展为终末期肾衰,而听力正常组中则有近1/3患儿出现听力下降,这提示随着AS病情发展,其听力也有进行性下降的趋势。综上所述,耳部症状的出现是患者肾病变较重及肾功能预后不良的一个指标,对Alport患者进行听力检测对患者的肾损伤及其预后有一定的评估价值。
4.4关于儿童AS患者合并听力损失与眼部病变的分析
本次研究中发现,有35%AS儿童合并眼部病变,与既往文献报道Alport综合征眼部发病率约为15%~30%相似特征性改变为前锥形晶体和/或黄斑周围微粒改变,造成视力下降[13],还可引起各种屈光异常、斜视、白内障等病变,黄斑病变亦见报道[14],本次研究发现AS儿童合并的眼部病变主要表现为屈光不正,并且听力异常组的AS儿童屈光不正发生率较正常听力组儿童更高,通过眼底检查发现听有2例力异常组中、重度听力下降儿童还合并的黄斑病变,和白内障,这提示眼部病变的发生和程度与听力损伤的发生发展有相关性。另有研究报道发生眼部病变的患者出现肾衰的年龄更早[15],因此眼部病变与听力损失都是指导判定预后的指标。
1Srinivasan M,Uzel SG,Gautieri A,et al.Alport syndromemuta⁃tions in type IV tropocollagen altermolecular structure and nano⁃mechanicalproperties[J].JStructBiol,2009,168(3):503-510.
2Flinter F.Alport'ssyndrome[J].JMed Genet,1997,34(4):326-330.
3Alves FR,de AQR F.Revision abouthearing loss in the Alport's syndrome,analyzing the clinical,genetic and bio-molecular as pects[J].Braz JOtorhinolaryngol,2005,71(6):813-819.
4AlvesFR,RibeiroFA.Clinical dataandhearingofindividuals with Al⁃portsyndrome[J].BrazJOtorhinolaryngol,2008,74(6):807-814.
5Moon IS,BangM Y,Shim D B,etal.Severe to profound hearing loss in patients with progressed Alport's syndrome[J].Acta Otolaryngol, 2009,129(9):982-987.
6Pittman A L,Stelmachowicz PG.Hearing loss in children and adults: audiometric configuration,asymmetry,and progression[J].Ear Hear, 2003,24(3):198-205.
7Lutman M E,Coles R R.Asymmetric sensorineural hearing thresh⁃olds in the non-noise-exposed UK population:a retrospective analy⁃sis[J].Clin Otolaryngol,2009,34(4):316-321.
8Bekheirnia M R,Reed B,Gregory M C,et al.Genotype-phenotype correlation in X-linked Alport syndrome[J].JAm Soc Nephrol,2010, 21(5):876-883.
9陈丽,薛俊芳,张琰琴,等.Alport综合征的临床听力学特点分析[J].中华耳鼻咽喉头颈外科杂志,2014,49(11):902-907.
10董程,陈斯琦,张焱琴,等.X-连锁Alport综合征的听力表现与皮肤α5(Ⅳ)胶原表达的关系[J].中华耳科学杂志,2014,12(2): 275-279.
11MerchantSN,Burgess B J,Adams JC,etal.Temporal bonehistopa⁃thologyinalportsyndrome[J].Laryngoscope,2004,114(9):1609-1618.
12王海燕,孙良忠,吴金浪,等.肾小球滤过屏障超微结构改变与Al⁃port综合征蛋白尿的关系[J].中国病理生理杂志,2013,29(2): 361-363.
13Kashtan C E.Alport syndrome.An inherited disorder of renal,ocu⁃lar,and cochlear basement membranes[J].Medicine(Baltimore), 1999,78(5):338-360.
14Gupta V,Kumar N.Bilateralmacular holes:an unusual feature of al⁃portsyndrome[J].Retina,2002,22(4):499-501.
15Shaw E A,Colville D,Wang Y Y,et al.Characterization of the pe⁃ripheral retinopathy in X-linked and autosomal recessive Alport syn⁃drome[J].NephrolDial Transplant,2007,22(1):104-108.
Audiological features in children w ith alport syndrome
WANGPengpeng1,WANGHua1,ZHENGJun2,LIUHaihong1,ZHANG li1,ZHANGJie1
1DepartmentofOtolaryngology&Head and Neck Surgery,Beijing Children'sHospital,CapitalMedical University,Beijing Key Laboratory for Pediatric DiseasesofOtolaryngology Head and Neck Surgery,Beijing 100034,China
2DepartmentofOtolaryngology Head and Neck Surgery,Beijing Tongren Hospital,Capital MedicalUniversity,Beijing,100730,China
Corresponding author:ZHANGJie,Email:stzhangj@263.net
Objective To assess audiological features in children w ith A lport Syndrome and hearing loss prognosis.M ethods Audiologic,nephrologic and opthalmologic findings in 43 cases of Alport syndrome between 2007 and 2013 were reviewed.Their progress was followed up by telephone interview.Results Forty-three individuals(36males,7 females,aged from 22months to 13 years)underwentaudiologic tests,which showed normal hearing in 33 and hearing loss in 10.Of these children w ith AS,23.2%(allmale)had sensorineuralhearing loss(70%atmoderatehearing loss level).Audiometric configurationwas“U”-shaped in 7,sloping in 2 or flat in 1 patient,respectively.Sensorineural hearing losswas asymmetric in 30%of these patients. For AS children w ith abnormal hearing,there weremore severe podocyte injury as compared w ith those w ith normal hearing.Telephone follow-up found thatone-third of AS children w ith normal hearing gradually developed hearing loss,and hearing in thosew ith abnormal hearing became progressively worse.One child w ith severe hearing loss developed end stage renal disease(ESRD).Conclusion Hearing loss is a common symptom of AS,whichmay reflect the severity of podocyte lesions.Audiometric configuration distribution in ASmay vary and can be asymmetric.Children w ith ASallshowed continuing progressive hearing loss.
A lportSyndrome;Hearing loss;Children
R762.5
A
1672-2922(2015)03-445-05
10.3969/j.issn.1672-2922.2015.03.014
王蓬鹏,主治医师,硕士研究生,研究方向:小儿耳鼻咽喉
张杰,Email:stzhangj@263.net
2015-8-26)
