手性硫叶立德在不对称三元环化合物合成中的应用
2015-11-30颜雪明张红英
颜雪明,张红英
(1.南华大学化工学院,湖南衡阳421001;2.衡阳财经工业职业技术学院材料系,湖南衡阳421001)
手性硫叶立德在不对称三元环化合物合成中的应用
颜雪明,张红英
(1.南华大学化工学院,湖南衡阳421001;2.衡阳财经工业职业技术学院材料系,湖南衡阳421001)
通过论述近年来手性硫叶立德在不对称环丙烷、环氧丙烷、氮杂环丙烷等三元化合物合成中的研究进展,提动了今后手性三元环不对称合成领域的研究方向。
叶立德;三元环;不对称反应;手性
三元环是一种具有良好生物活性的结构单元,如含三元环结构的螺杂环化合物广泛存在于天然生物碱及药物分子中,并具有抗艾滋病、抗心律失常、抗癌、杀菌等活性[1-3]。三元环是最小的环状结构,它的环张力非常大,具有一定的不饱和度,因此,三元环化合物具有烯烃的性质,是一类反应活性很强的特殊分子结构。三元环结构单元极易和亲核试剂、亲电试剂、自由基等试剂进行反应,从而衍生合成各种复杂的分子结构。三元环结构还具有极易重排的特点,能与多种活泼官能团发生扩环反应,可以由三元环到四元环、五元环和七元环,特别是当在三元环上有不同的取代基修饰时,更能赋予其反应的丰富性[4-5]。因此,无论对三元环合成方法的研究还是将其作为合成中间体的研究都具有重要的意义,三元环化合物的合成及其应用倍受有机化学工作者的关注[6-7]。目前,叶立德反应是合成三元环结构的最常见的反应类型之一,主要包括磷叶立德、硫叶立德、砷叶立德、硒叶立德、碲叶立德以及吡啶叶立德等[8],本文中将对手性硫叶立德在环丙烷、环氧丙烷、氮杂环丙烷化合物的不对称合成中的应用进行综述。
1 手性硫叶立德在不对称环丙烷合成中的应用
环丙烷化是叶立德反应的基本反应之一,早在1973年,TROST[9]等人就采用金刚烷结构的手性硫叶立德和α,β-不饱和酯反应来合成光学活性的环丙烷化合物,遗憾的是尽管产率可观,但对映选择性很低,如图1所示。
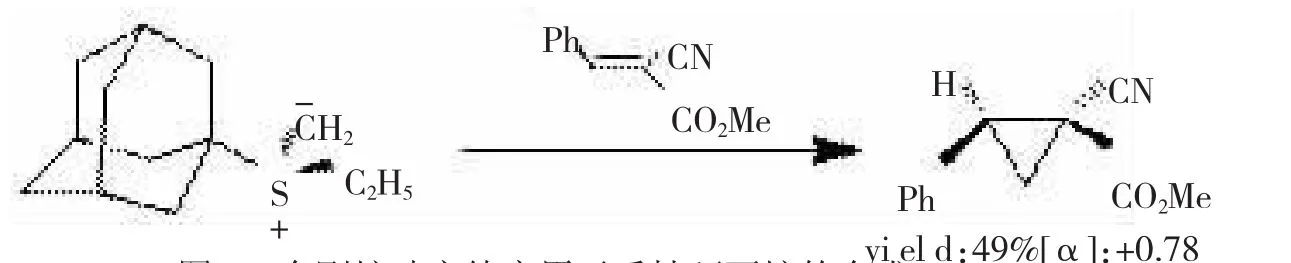
图1 金刚烷叶立德应用于手性环丙烷的合成
而TRONCHET[10]等人则从糖出发合成一个稳定手性叶立德,与一系列迈克尔受体如丙稀腈、丙稀酸或富马酸二甲酯反应后得到了一系列带有糖基的环丙烷化合物,产率较低(26%~50%),对映选择性
也不高(ee=20%~40%),如图2所示。也不高(ee=20%~40%),如图2所示。

图2糖衍生的手性叶立德合成不对称环丙烷
图2 糖衍生的手性叶立德合成不对称环丙烷
直到1998年,CAVALLO[11]等人从长叶薄荷酮出发合成一个含氧桥环的硫化物,用该硫化物与一系列苯环取代的溴苄反应合成一些锍盐,这些盐在强碱作用下生成手性硫叶立德,然后与丙烯酸乙酯反应得到手性环丙烷类化合物,反应的对映选择性很高(ee=96%~99%),如图3所示。
直到1998年,CAVALLO[11]等人从长叶薄荷酮出发合成一个含氧桥环的硫化物,用该硫化物与一系列苯环取代的溴苄反应合成一些锍盐,这些盐在强碱作用下生成手性硫叶立德,然后与丙烯酸乙酯反应得到手性环丙烷类化合物,反应的对映选择性很高(ee=96%~99%),如图3所示。
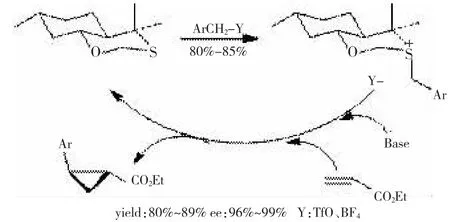
图3长叶薄荷酮衍生的手性叶立德合成不对称环丙烷
图3 长叶薄荷酮衍生的手性叶立德合成不对称环丙烷
CAVALLO的研究将硫叶立德不对称环丙烷化反应的对映选择性大大提高了,但也有几个缺陷,他们的硫化物与溴苄不能直接成盐,必须在AgBF4的帮助下才能完成,而且,在形成叶立德的过程中必须使用昂贵且不稳定的膦腈碱,这些缺陷将会限制他们的研究在工业上的实际应用。
最近,黄坤博士[12]采用樟脑衍生的手性硫化物研究了半稳定和稳定叶立德的不对称环丙烷化反应。研究结果显示,虽然稳定叶立德在这个反应中的对映选择性不高,但半稳定叶立德的对映选择性却达到了90%以上。有趣的是,在形成叶立德的过程中,当分别使用叔丁醇钾和氢化钠做碱时,得到的环丙烷化合物具有相反的构型,见图4。
CAVALLO的研究将硫叶立德不对称环丙烷化反应的对映选择性大大提高了,但也有几个缺陷,他们的硫化物与溴苄不能直接成盐,必须在AgBF4的帮助下才能完成,而且,在形成叶立德的过程中必须使用昂贵且不稳定的膦腈碱,这些缺陷将会限制他们的研究在工业上的实际应用。
最近,黄坤博士[12]采用樟脑衍生的手性硫化物研究了半稳定和稳定叶立德的不对称环丙烷化反应。研究结果显示,虽然稳定叶立德在这个反应中的对映选择性不高,但半稳定叶立德的对映选择性却达到了90%以上。有趣的是,在形成叶立德的过程中,当分别使用叔丁醇钾和氢化钠做碱时,得到的环丙烷化合物具有相反的构型,见图4。
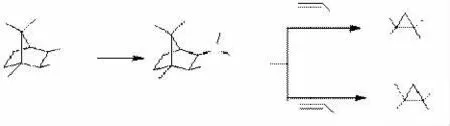
图4樟脑衍生的手性硫叶立德合成不对称环丙烷
图4 樟脑衍生的手性硫叶立德合成不对称环丙烷
前面的研究都涉及到硫化物的溴苄盐和丙烯酸酯类化合物反应,合成的产物都是二取代苯基环丙烷化物,对于在有机合成中更有意义的三取代的烯基环丙烷没有研究。2002年,YE[13]课题组试图用樟脑衍生的硫叶立德合成了1,2,3-三取代的烯基环丙烷,并取得了成功,反应的对映选择性非常可观(74%~97%),但只得到中等收率,见图5。
前面的研究都涉及到硫化物的溴苄盐和丙烯酸酯类化合物反应,合成的产物都是二取代苯基环丙烷化物,对于在有机合成中更有意义的三取代的烯基环丙烷没有研究。2002年,YE[13]课题组试图用樟脑衍生的硫叶立德合成了1,2,3-三取代的烯基环丙烷,并取得了成功,反应的对映选择性非常可观(74%~97%),但只得到中等收率,见图5。
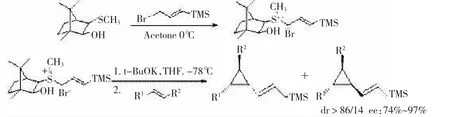
图5樟脑衍生的手性硫叶立德合成三取代不对称环丙烷
图5 樟脑衍生的手性硫叶立德合成三取代不对称环丙烷
AGARWAL在不对称催化环氧化研究中发现了一个新的而且有效的即时生成叶立德的方法[14-15],他们用此方法在不对称的环丙烷化反应中也取得了成功[16]。催化循环如图6,首先是重氮化合物分解与过渡金属如醋酸姥反应产生金属卡宾,后者与硫化物反应产生手性硫叶立德,硫叶立德再与Michael受体反应形成环丙烷。在这个过程中,手性硫化物和醋酸铑是催化量的,而重氮化合物和Michael受体是化学计量的。他们研究了3个手性硫化物,均取得了较高的对映选择性和顺反选择性[17-18],见图6~7。
AGARWAL在不对称催化环氧化研究中发现了一个新的而且有效的即时生成叶立德的方法[14-15],他们用此方法在不对称的环丙烷化反应中也取得了成功[16]。催化循环如图6,首先是重氮化合物分解与过渡金属如醋酸姥反应产生金属卡宾,后者与硫化物反应产生手性硫叶立德,硫叶立德再与Michael受体反应形成环丙烷。在这个过程中,手性硫化物和醋酸铑是催化量的,而重氮化合物和Michael受体是化学计量的。他们研究了3个手性硫化物,均取得了较高的对映选择性和顺反选择性[17-18],见图6~7。
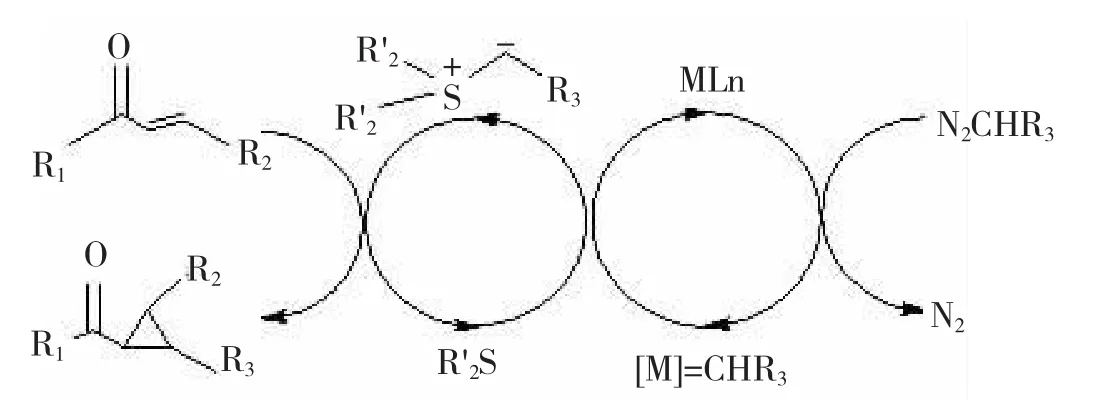
图图66过过渡渡金金属属催催化化即即时时生生成成叶叶立立德德合合成成手手性性环环丙丙烷烷
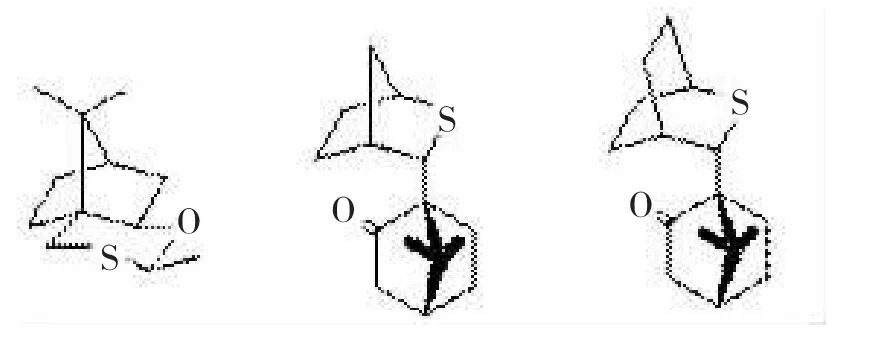
图7三种手性樟脑衍生的硫化合物结构
图7 三种手性樟脑衍生的硫化合物结构
2006年,DENG等[19]较为系统地研究了天然樟脑衍生的硫叶立德介导的三取代手性环丙烷的对对映选择性、底物范围和局限性,并对其反应过程的机理进行了研究,见图8。
2006年,DENG等[19]较为系统地研究了天然樟脑衍生的硫叶立德介导的三取代手性环丙烷的对对映选择性、底物范围和局限性,并对其反应过程的机理进行了研究,见图8。
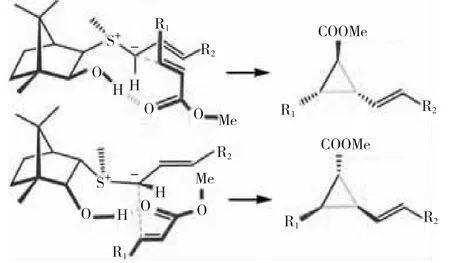
图8天然樟脑衍生的不同构型硫叶立德介导的手性环丙烷反应过程
图8 天然樟脑衍生的不同构型硫叶立德介导的手性环丙烷反应过程
2010年,ZHU等[20]进一步研究发现,在THF溶液中,使用强有机碱叔丁醇钾,当反应温度低至-78℃条件下,由天然樟脑衍生的硫叶立德参与的Micheal反应能得到高达99%对映选择性。相反如果使用弱碱CsCO3,且有微量水存在下,反应产物截然不同,得到环氧丙烷的环加成产物,如图9所示。
2010年,ZHU等[20]进一步研究发现,在THF溶液中,使用强有机碱叔丁醇钾,当反应温度低至-78℃条件下,由天然樟脑衍生的硫叶立德参与的Micheal反应能得到高达99%对映选择性。相反如果使用弱碱CsCO3,且有微量水存在下,反应产物截然不同,得到环氧丙烷的环加成产物,如图9所示。
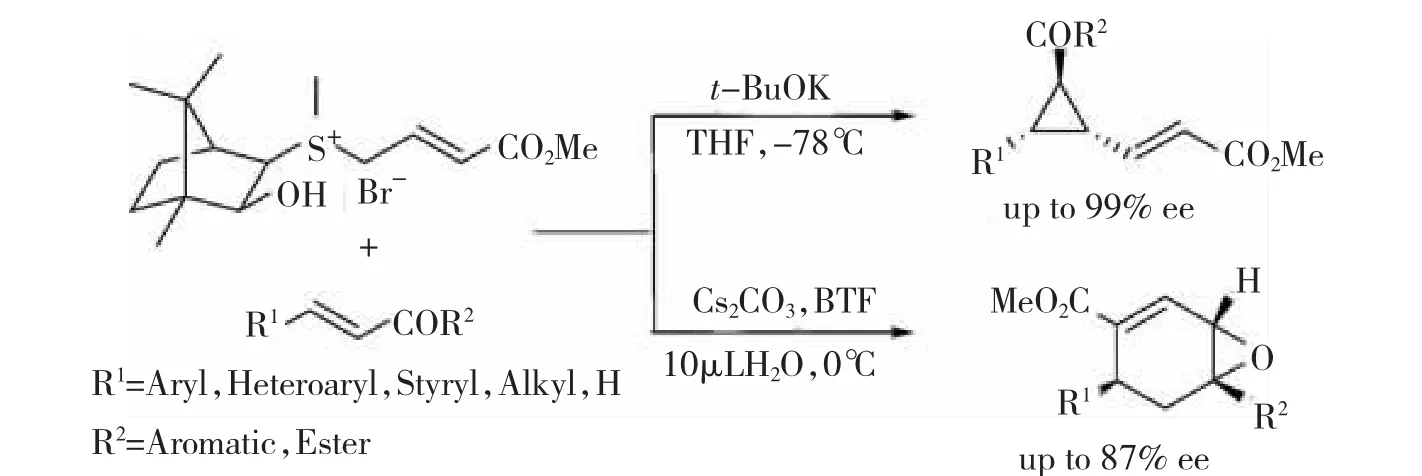
图9天然樟脑衍生的硫叶立德介导的高对映选择性的手性环丙烷和手性环氧丙烷的合成
图9 天然樟脑衍生的硫叶立德介导的高对映选择性的手性环丙烷和手性环氧丙烷的合成
值得关注的是,2013年KENGO等[21]突破了合成手性环丙烷的传统方法,即采用结构复杂的手性硫叶立德来介导手性环丙烷的不对称合成。他们采用结构非常简单的非手性的硫叶立德,而采用具有结构复杂的手性多肽来催化合成手性环丙烷的不对称。其对映选择性可以达到98%,如图10所示。
值得关注的是,2013年KENGO等[21]突破了合成手性环丙烷的传统方法,即采用结构复杂的手性硫叶立德来介导手性环丙烷的不对称合成。他们采用结构非常简单的非手性的硫叶立德,而采用具有结构复杂的手性多肽来催化合成手性环丙烷的不对称。其对映选择性可以达到98%,如图10所示。
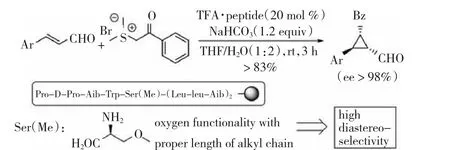
图10多肽催化、非手性硫叶立德介导高对映选择性手性环丙烷的合成
图10 多肽催化、非手性硫叶立德介导高对映选择性手性环丙烷的合成
2手性硫叶立德在不对称环氧丙烷合成中的应用
2 手性硫叶立德在不对称环氧丙烷合成中的应用
1958年,JOHNSON[22]等人合成了第一个硫叶立德,他们最初设想是这个稠环结构的硫叶立德像磷叶立德一样与对硝基苯甲醛反应生成烯烃,然而实验结果出乎他们的意外,得到的产物不是所要的烯烃而是一个环氧化合物,见图11。随后,硫叶立德开始在有机合成中得到广泛的应用。
1958年,JOHNSON[22]等人合成了第一个硫叶立德,他们最初设想是这个稠环结构的硫叶立德像磷叶立德一样与对硝基苯甲醛反应生成烯烃,然而实验结果出乎他们的意外,得到的产物不是所要的烯烃而是一个环氧化合物,见图11。随后,硫叶立德开始在有机合成中得到广泛的应用。
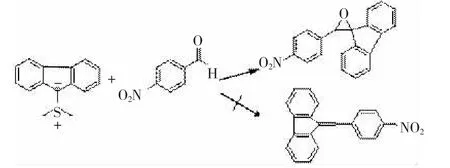
图11稠环结构的硫叶立德像与对硝基苯甲醛反应生成环氧丙烷
图11 稠环结构的硫叶立德像与对硝基苯甲醛反应生成环氧丙烷
首次采用手性硫叶立德来进行不对称合成的尝试来自于TROST[23]等人,他们合成了一个带有金刚烷结构的手性锍盐,采用正丁基锂去质子化形成手性叶立德,然后与苯甲醛反应,遗憾的是,反应没有对映选择性,见图12。反应的对映选择性很差的原因被认为是该叶立德的亲核部分是亚甲基,与苯甲醛反应的位阻很小,人们猜测如果将亚甲基变成苄基,对映选择性会得到提高。
首次采用手性硫叶立德来进行不对称合成的尝试来自于TROST[23]等人,他们合成了一个带有金刚烷结构的手性锍盐,采用正丁基锂去质子化形成手性叶立德,然后与苯甲醛反应,遗憾的是,反应没有对映选择性,见图12。反应的对映选择性很差的原因被认为是该叶立德的亲核部分是亚甲基,与苯甲醛反应的位阻很小,人们猜测如果将亚甲基变成苄基,对映选择性会得到提高。
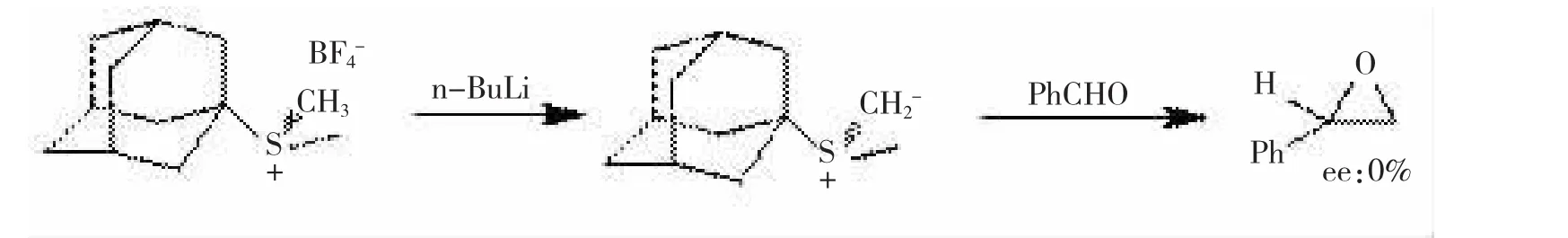
图12金刚烷结构的手性锍盐合成的环氧丙烷无对映选择性
图12 金刚烷结构的手性锍盐合成的环氧丙烷无对映选择性
日本的FURUKAWA[24]等人从樟脑磺酸出发合成了一系列手性硫化物,并用这些硫化物和芳香醛、溴苄在碱的作用下一锅法合成具有光学活性的环氧化合物,见图13。反应的机理是硫化物和溴苄反应生成锍盐,锍盐与碱反应即时生成硫叶立德,后者再与醛反应形成环氧化合物。尽管反应的对映选择性不高,但这是首次用手性硫叶立德来合成具有光学活性的环氧化合物的成功例子,对映选择性不高可能是合成的硫化物由于硫原子周围的位阻较小,硫原子上两对孤对电子空间选择性不强。
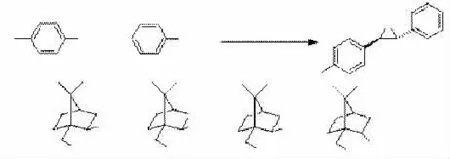
图13樟脑衍生的手性硫化物应用于手性环氧丙烷的合成
图13 樟脑衍生的手性硫化物应用于手性环氧丙烷的合成
不难想到是在具有C2对称性的硫化物分子中,硫原子上两对孤对电子的空间位置是一致的,当硫化物与卤代烃成盐时,无论哪一对电子参与反应所得的锍盐空间构型是一致的,因此,C2对称的硫化物可以克服FURUKAWA的这个缺陷。DURST[25-26]等人合成了3个具有C2对称性的硫化物并用于不对称环氧化,反应的对映选择性有很大的提高,最高可达83%ee值,如图14所示。
不难想到是在具有C2对称性的硫化物分子中,硫原子上两对孤对电子的空间位置是一致的,当硫化物与卤代烃成盐时,无论哪一对电子参与反应所得的锍盐空间构型是一致的,因此,C2对称的硫化物可以克服FURUKAWA的这个缺陷。DURST[25-26]等人合成了3个具有C2对称性的硫化物并用于不对称环氧化,反应的对映选择性有很大的提高,最高可达83%ee值,如图14所示。
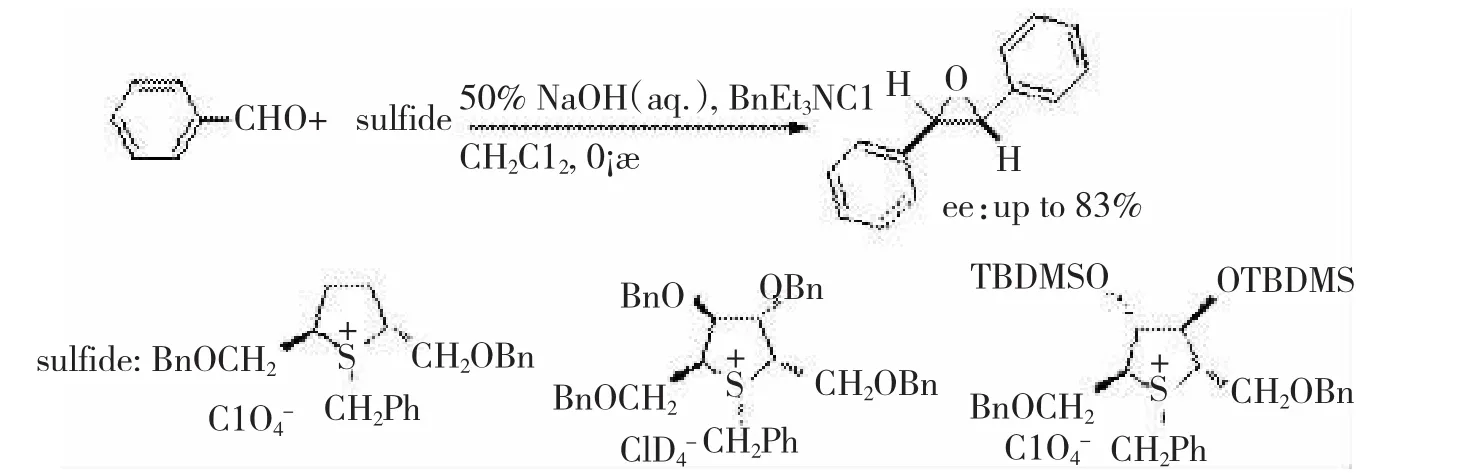
图14手性噻吩结构应用于手性环氧丙烷的合成
图14 手性噻吩结构应用于手性环氧丙烷的合成
在不对称合成中,与化学计量的不对称反应相比,不对称催化反应具有非常明显的优点,它通过使用催化量的手性源合成大量的手性目标化合物,达到不对称放大的效果,因此不对称催化已经成为不对称合成的热点。在FURUKAWA报道的例子中,反应是一锅法完成,叶立德是通过成盐、去质子化现场产生,硫化物与卤代烃的摩尔比是1∶2,而DURST则是用硫化物和卤代烃成盐后再环氧化,他们的研究并不符合不对称催化的要求。上海有机所LI等[27]详细研究了手性硫叶立德环氧化反应的催化模式,硫化物的使用量为20%,令人遗憾的是,尽管他们在反应模式上有了改进,但是反应的结果并不是很理想,反应的对映选择性最高仅为74%。反应的催化机理如图15所示。
在不对称合成中,与化学计量的不对称反应相比,不对称催化反应具有非常明显的优点,它通过使用催化量的手性源合成大量的手性目标化合物,达到不对称放大的效果,因此不对称催化已经成为不对称合成的热点。在FURUKAWA报道的例子中,反应是一锅法完成,叶立德是通过成盐、去质子化现场产生,硫化物与卤代烃的摩尔比是1∶2,而DURST则是用硫化物和卤代烃成盐后再环氧化,他们的研究并不符合不对称催化的要求。上海有机所LI等[27]详细研究了手性硫叶立德环氧化反应的催化模式,硫化物的使用量为20%,令人遗憾的是,尽管他们在反应模式上有了改进,但是反应的结果并不是很理想,反应的对映选择性最高仅为74%。反应的催化机理如图15所示。
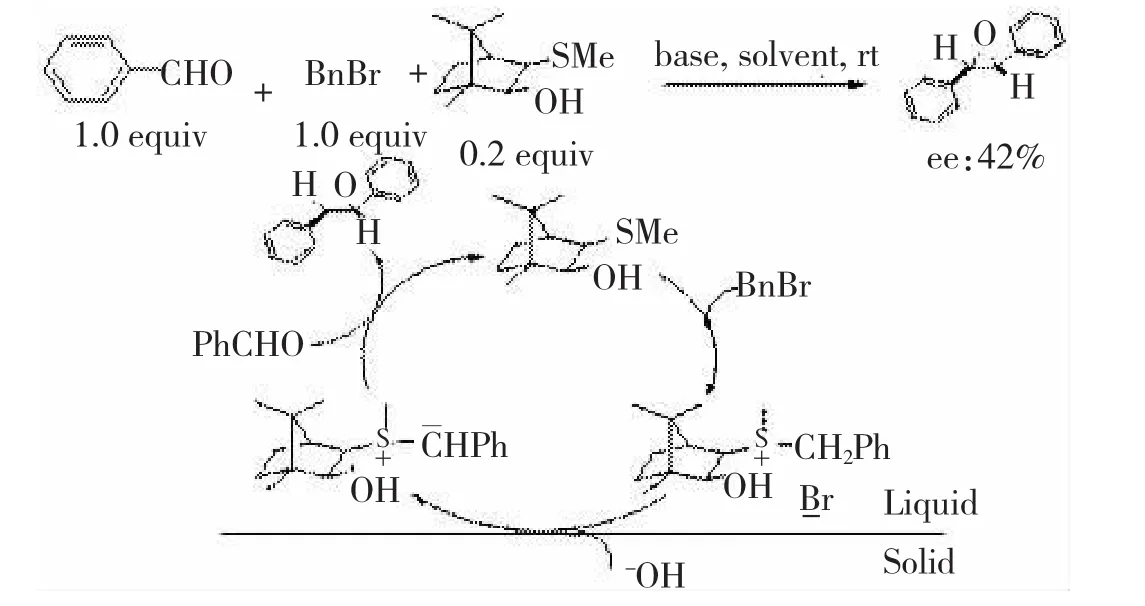
图15樟脑手性硫叶立德介导环氧化反应的催化模式
图15 樟脑手性硫叶立德介导环氧化反应的催化模式
最近ZANADI等[28]和WIN等[29]分别合成了两个具有C2对称性的手性硫化物,采用催化量的不对称环氧化反应,取得较高的对映选择性,证明了C2对称性硫化物的优越性。尤其是后者的对映选择性达到了一个新的高度,缺点是由于该硫化物强大的位阻原因,反应的速度非常缓慢,产率不够理想(14%~59%),如图16所示。
最近ZANADI等[28]和WIN等[29]分别合成了两个具有C2对称性的手性硫化物,采用催化量的不对称环氧化反应,取得较高的对映选择性,证明了C2对称性硫化物的优越性。尤其是后者的对映选择性达到了一个新的高度,缺点是由于该硫化物强大的位阻原因,反应的速度非常缓慢,产率不够理想(14%~59%),如图16所示。
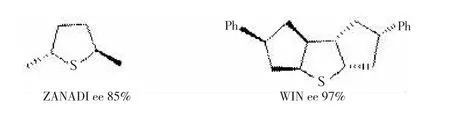
图16具有C2对称性的手性硫化物结构
图16 具有C2对称性的手性硫化物结构
前述研究都采用了传统的形成叶立德的方法,这个方法涉及硫化物和卤代烃反应生成锍盐,锍盐在碱的作用下去质子化形成叶立德。在这个过程中,第一步通常是一个慢反应过程,由于硫原子上孤对电子的亲核性不如氮、磷等,因此,很多硫化物成盐的过程非常缓慢,必须在银盐如AgBF4和AgClO4的
前述研究都采用了传统的形成叶立德的方法,这个方法涉及硫化物和卤代烃反应生成锍盐,锍盐在碱的作用下去质子化形成叶立德。在这个过程中,第一步通常是一个慢反应过程,由于硫原子上孤对电子的亲核性不如氮、磷等,因此,很多硫化物成盐的过程非常缓慢,必须在银盐如AgBF4和AgClO4的
帮助下反应才比较顺利,而这些银盐的价格昂贵,并且很不稳定。因此,一些具有大位阻的硫化物尽管具有较好的手性诱导效果,但反应非常缓慢。AGGARWAL[30]发展了另一种形成叶立德并且进行环氧化的方法:即重氮化合物和醋酸铑反应形成金属卡宾,后者和硫化物反应形成叶立德,叶立德再与醛反应形成环氧化合物,整个过程是按照催化模式进行的,见图17。他们的方法是解决位阻大的硫醚形成锍盐困难的一个好方法,但是对于位阻小的硫醚则显得比较繁琐,不仅要现场制备比较危险的重氮化合物,而且要用到昂贵的醋酸铑。帮助下反应才比较顺利,而这些银盐的价格昂贵,并且很不稳定。因此,一些具有大位阻的硫化物尽管具有较好的手性诱导效果,但反应非常缓慢。AGGARWAL[30]发展了另一种形成叶立德并且进行环氧化的方法:即重氮化合物和醋酸铑反应形成金属卡宾,后者和硫化物反应形成叶立德,叶立德再与醛反应形成环氧化合物,整个过程是按照催化模式进行的,见图17。他们的方法是解决位阻大的硫醚形成锍盐困难的一个好方法,但是对于位阻小的硫醚则显得比较繁琐,不仅要现场制备比较危险的重氮化合物,而且要用到昂贵的醋酸铑。
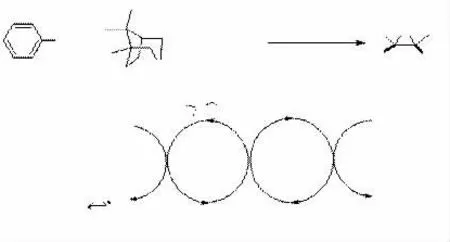
图17过渡金属催化即时生成叶立德合成手性环氧丙烷
图17 过渡金属催化即时生成叶立德合成手性环氧丙烷
但这个反应的对映选择性不高,仅获得了11%的对映选择性,如此低的选择性可能是他们选用的硫化物的结构原因,在接下来的工作中,该小组合成了两种新的硫化物[31],采用同样的方法来进行不对称环氧化,反应的对映选择性大大提高,如图18所示。
但这个反应的对映选择性不高,仅获得了11%的对映选择性,如此低的选择性可能是他们选用的硫化物的结构原因,在接下来的工作中,该小组合成了两种新的硫化物[31],采用同样的方法来进行不对称环氧化,反应的对映选择性大大提高,如图18所示。
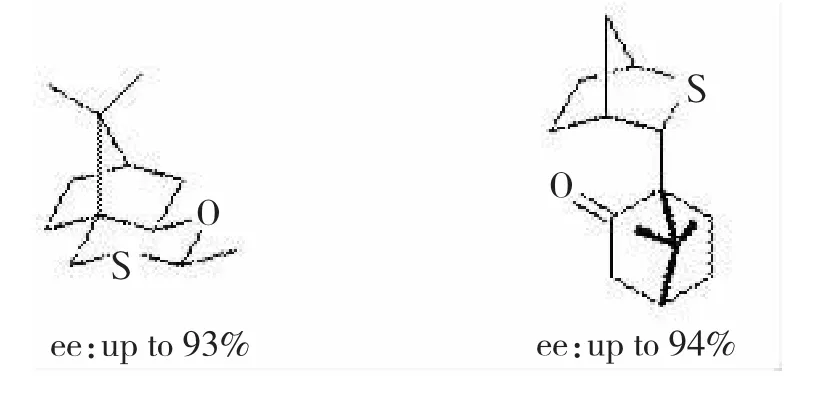
图18采用不同硫化合物获得的对映选择性不同
图18 采用不同硫化合物获得的对映选择性不同
最近,WU等[32]经过五步合成了具有三环取代的手性叔醇结构,并将其应用于催化卞溴与芳醛合成手性环氧丙烷,对映选择性可以达到92%,如图19所示。
最近,WU等[32]经过五步合成了具有三环取代的手性叔醇结构,并将其应用于催化卞溴与芳醛合成手性环氧丙烷,对映选择性可以达到92%,如图19所示。
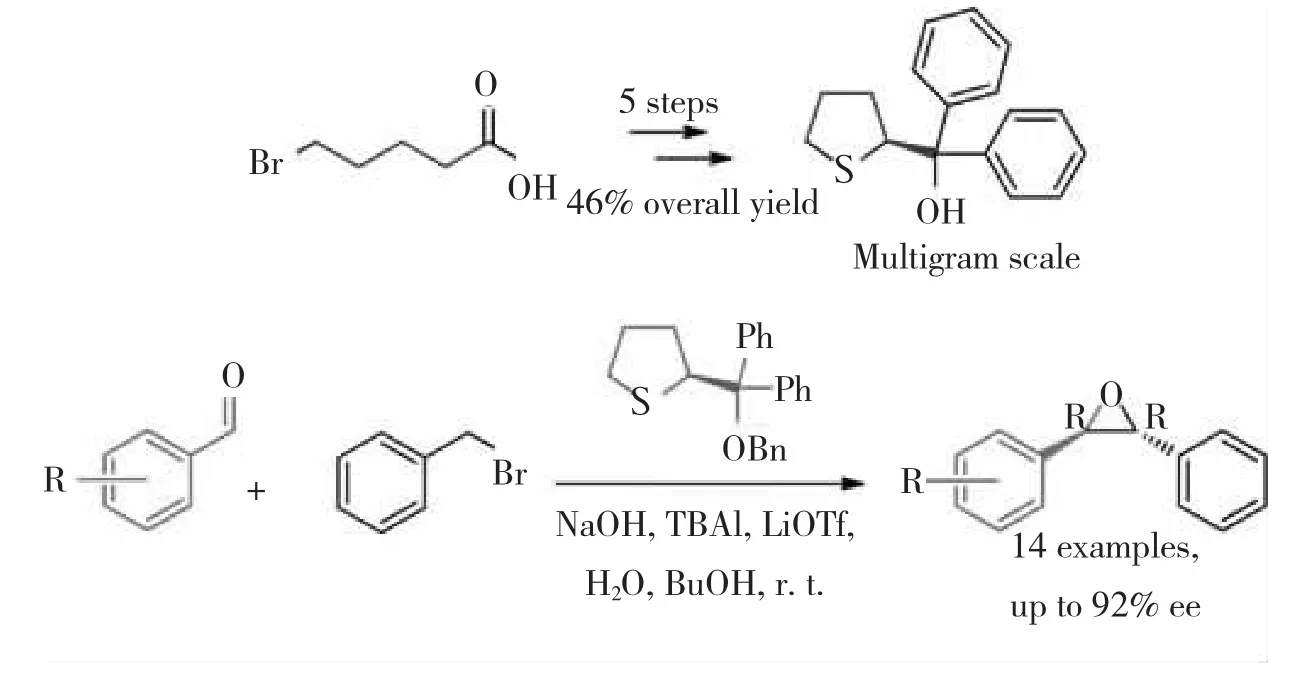
图19含硫手性叔醇应用于手性环氧丙烷的不对称合成
图19 含硫手性叔醇应用于手性环氧丙烷的不对称合成
2013年,ILLA等[33]采用廉价易得的单质硫、萜烯、柠檬烯一步反应合成手性硫化物Isothiocineole,该手性硫化物不仅能应用于醛的不对称环氧化反应,而且可以与亚胺反应合成氮杂环丙烷,具有底物范围广泛,具有高对映选择性等特点,如图20所示。
2013年,ILLA等[33]采用廉价易得的单质硫、萜烯、柠檬烯一步反应合成手性硫化物Isothiocineole,该手性硫化物不仅能应用于醛的不对称环氧化反应,而且可以与亚胺反应合成氮杂环丙烷,具有底物范围广泛,具有高对映选择性等特点,如图20所示。
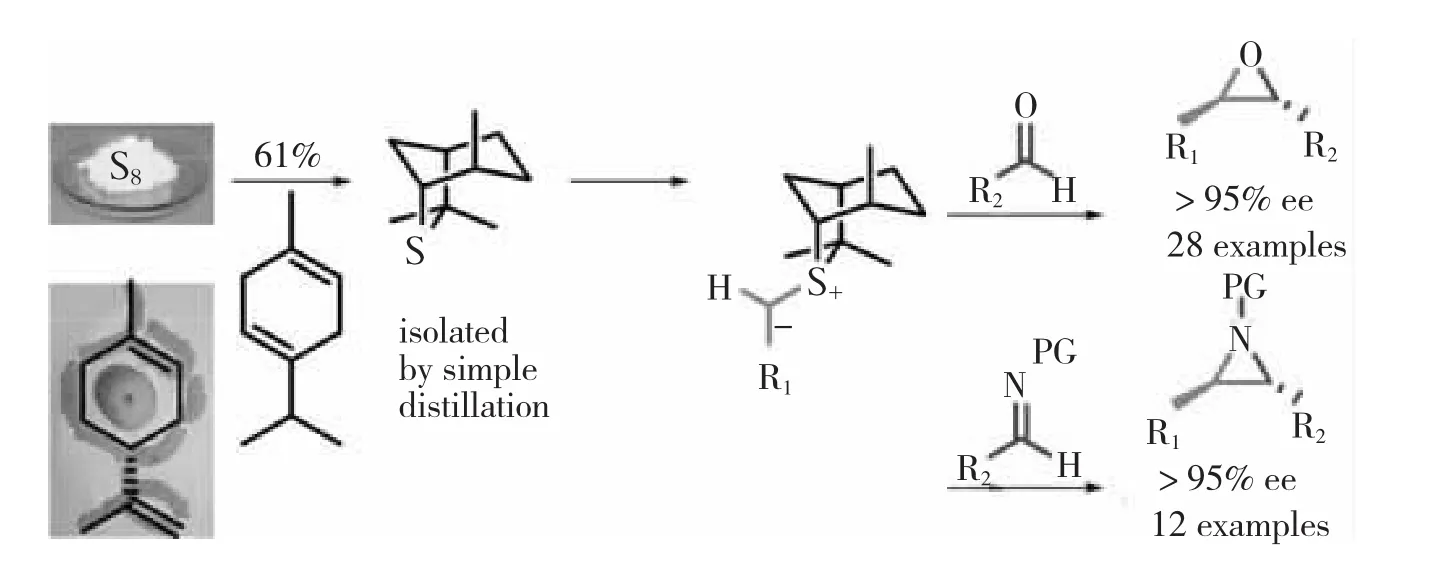
图20手性硫化物Isothiocineole的简便合成及其在不对称环氧化和氮杂环丙烷合成中的应用
图20 手性硫化物Isothiocineole的简便合成及其在不对称环氧化和氮杂环丙烷合成中的应用
3 手性硫叶立德在不对称氮杂环丙烷化合成中的应用
3手性硫叶立德在不对称氮杂环丙烷化合成中的应用
AGGARWAL发展的用金属卡宾来形成叶立德的方法在不对称环氧化和环丙烷化取得了很好的研究的成果,当他们把这个方法应用到不对称氮杂环丙烷化反应同样取得了成功[34-36],见图21。
AGGARWAL发展的用金属卡宾来形成叶立德的方法在不对称环氧化和环丙烷化取得了很好的研究的成果,当他们把这个方法应用到不对称氮杂环丙烷化反应同样取得了成功[34-36],见图21。
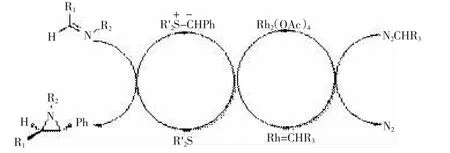
图21渡金属催化即时生成叶立德合成手性氮杂环丙烷的机理
图21 渡金属催化即时生成叶立德合成手性氮杂环丙烷的机理
在上面的不对称催化循环中,重氮化合物和金属卡宾充当了碳转移试剂,除此之外,该小组还报道了Simmon-Smith试剂做为碳转移试剂、经硫叶立德形成氮杂环丙烷的方法[37],如图22所示。该反应的产物在硫酚存在下可区域选择性地进行开环反应生成nelfinavir,它是一种潜在的艾滋病病毒蛋白酶的抑制剂。
在上面的不对称催化循环中,重氮化合物和金属卡宾充当了碳转移试剂,除此之外,该小组还报道了Simmon-Smith试剂做为碳转移试剂、经硫叶立德形成氮杂环丙烷的方法[37],如图22所示。该反应的产物在硫酚存在下可区域选择性地进行开环反应生成nelfinavir,它是一种潜在的艾滋病病毒蛋白酶的抑制剂。
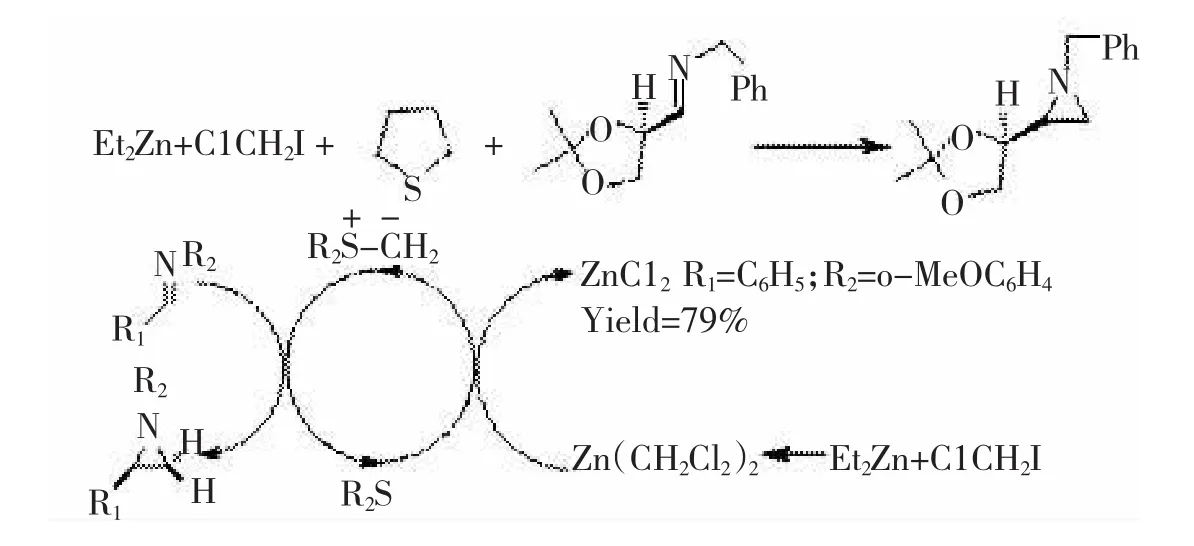
图22锌催化即时生成叶立德合成手性氮杂环丙烷
图22 锌催化即时生成叶立德合成手性氮杂环丙烷
在传统的叶立德形成方面,戴立信小组用烯丙基的硫叶立德和N-磺酰亚胺反应合成氮杂环丙烷,然而反应的顺反选择性非常低[38-40],因此对于这个反应的不对称合成方面没有进行深入的研究了。然而,当他们用带有三甲基硅基的炔丙基锍盐来研究这个反应时,反应的顺反选择性大大得提高了,产物基本上以顺式的氮杂环丙烷为主[41]。采用樟脑衍生的硫化物来进行不对称氮杂化反应,试验了一系列的N-磺酰亚胺,得到了一系列的氮杂环丙烷,但反应的对映选择性比较低。硫化物的结构决定了反应产物的构型,甲硫基和羟基朝上的硫化物所得到的产物以(2R,3S)为主,甲硫基和羟基朝下的硫化物所得到的产物的构型正好相反。反应后手性硫化物可以以大于80%的收率回收,见下图23。
在传统的叶立德形成方面,戴立信小组用烯丙基的硫叶立德和N-磺酰亚胺反应合成氮杂环丙烷,然而反应的顺反选择性非常低[38-40],因此对于这个反应的不对称合成方面没有进行深入的研究了。然而,当他们用带有三甲基硅基的炔丙基锍盐来研究这个反应时,反应的顺反选择性大大得提高了,产物基本上以顺式的氮杂环丙烷为主[41]。采用樟脑衍生的硫化物来进行不对称氮杂化反应,试验了一系列的N-磺酰亚胺,得到了一系列的氮杂环丙烷,但反应的对映选择性比较低。硫化物的结构决定了反应产物的构型,甲硫基和羟基朝上的硫化物所得到的产物以(2R,3S)为主,甲硫基和羟基朝下的硫化物所得到的产物的构型正好相反。反应后手性硫化物可以以大于80%的收率回收,见下图23。
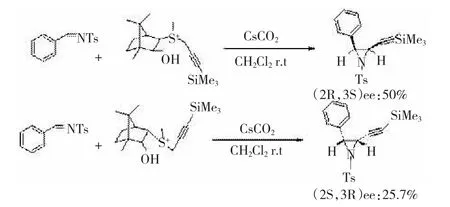
图23樟脑衍生的三甲基硅基的炔丙基锍盐与N-磺酰亚胺的氮杂环丙烷化反应
图23 樟脑衍生的三甲基硅基的炔丙基锍盐与N-磺酰亚胺的氮杂环丙烷化反应
2001年,日本的SAITO小组[42]也从樟脑出发合成了一种新型手性硫化物,并采用催化的方式来进行不对称氮杂环丙烷化反应,他们在反应中使用的溴化物为位阻较大的溴苄而不是炔丙基溴来合成苯基氮杂环丙烷,反应的对映选择性达到了90%以上,见下图24。
2001年,日本的SAITO小组[42]也从樟脑出发合成了一种新型手性硫化物,并采用催化的方式来进行不对称氮杂环丙烷化反应,他们在反应中使用的溴化物为位阻较大的溴苄而不是炔丙基溴来合成苯基氮杂环丙烷,反应的对映选择性达到了90%以上,见下图24。
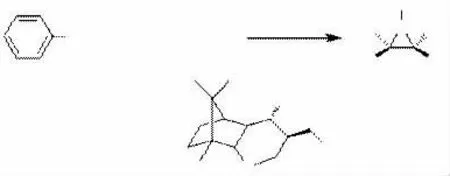
图24樟脑衍生的溴苄锍盐与N-磺酰亚胺的氮杂环丙烷化反应
图24 樟脑衍生的溴苄锍盐与N-磺酰亚胺的氮杂环丙烷化反应
ILLA等[43]采用廉价易得的单质硫、柠檬烯一步合成手性硫化物Isothiocineole,该手性硫化物与醛发生高对映选择性的环氧化反应,与亚胺反应生成氮杂环丙烷,进而可以应用于奎宁和奎尼丁的合成,如图25所示。
ILLA等[43]采用廉价易得的单质硫、柠檬烯一步合成手性硫化物Isothiocineole,该手性硫化物与醛发生高对映选择性的环氧化反应,与亚胺反应生成氮杂环丙烷,进而可以应用于奎宁和奎尼丁的合成,如图25所示。
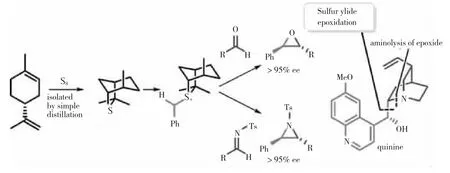
图25手性硫化物不对称环氧化和氮杂环丙烷合成中的应用
图25 手性硫化物不对称环氧化和氮杂环丙烷合成中的应用
4结语
4 结语
手性三元环结构单元广泛存在于天然产物中,同时也是非常重要的有机合成中间体,目前采取手性硫叶立德来进行不对称合成三元环结构取得了一定的成绩,但还存在这许多不足,首先,许多手性硫叶立德的本身的合成步骤冗长,其反应的对映选择性不够理想。其次,目前仅对手性硫叶立德的研究比较深入,而其他叶立德如,砷叶立德、硒叶立德、碲叶立德以及吡啶叶立德等在不对称三元环合成方面的研究比较少。今后在手性三元环不对称合成领域的研究主要是朝高效率、高对映选择性方向发展,同时,将开发砷、硒、碲叶立德等在该研究领域的应用。
手性三元环结构单元广泛存在于天然产物中,同时也是非常重要的有机合成中间体,目前采取手性硫叶立德来进行不对称合成三元环结构取得了一定的成绩,但还存在这许多不足,首先,许多手性硫叶立德的本身的合成步骤冗长,其反应的对映选择性不够理想。其次,目前仅对手性硫叶立德的研究比较深入,而其他叶立德如,砷叶立德、硒叶立德、碲叶立德以及吡啶叶立德等在不对称三元环合成方面的研究比较少。今后在手性三元环不对称合成领域的研究主要是朝高效率、高对映选择性方向发展,同时,将开发砷、硒、碲叶立德等在该研究领域的应用。
[1]ABDEL R A H,KESH K E M,HANNA M A,et al.Synthesis and evaluation of some new spiro indoline- based heterocycles as potentially active antimicrobial agents[J].Bioorg Med Chem,2004,12(9):2483-2488.
[2]SEBAHAR PR,WILLIAMS R M.The Asymmetric Total Synthesis of(+)-and(-)-Spirotryprostatin B[J].JAm Chem Soc, 2000,122(23):5666-5667.
[3]TAN B,CANDEIAS N R,BARBAS CF.Construction of bispirooxindoles containing three quaternary stereocentres in a cascade using a single multi functional organo catalyst[J].Nature Chem,2011,3:473-477.
[4]RAPPOPORTZ.The Chemistry of The Cyclopropyl Group:Volume2[M].London:John Wiley&Sons Ltd,2005.
[5]WONG H N C,HON M Y,TSE CW,etal.Use of cyclopropanes and their derivatives in organic synthesis[J].Chem Rev, 1989,89(1):165-198.
[6]HAY EB,ZHANG H,DENNIS P C.Rearrangement Reactions of1,1-Divinyl-2-phenyl cyclopropanes[J].J Am Chem Soc, 2015,137(1):322-327.
[7]LEBEL H,MARCOUX JR,MOLINARO C,et al.Stereoselective Cyclopropanation Reactions[J].Chem Rev.2003,103: 977-1050.
[8]黄文芳,叶立德.化学[M].广州:华中师范大学出版社,1993.
[9]TROST B M,HAMMEN R F.New synthetic methods:Transfer of chirality from sulfur to carbon[J].JAm Chem Soc,1973,95(3):962-964.
[10]TRONCHET J M,EDER H.Sulfylures Derives De Sucres[J].J Carbohydr Chem,1983,2(2):139-141.
[11]CAVALLO Solladie A,DIEP-vohuule A,ISARNO T.Two-Step Synthesis of trans-2-Arylcyclopropane Carboxylates with 98-100%ee by the Use of a Phosphazene Base[J].Angew Chem Int Ed,1998,37(12):1689-1691.
[12]HUANG K,HUANG Z Z.A Practical and Controllable Enantioselective Synthesis of 2-Phenyl-1-cyclopropanecarboxylates via a Camphor-Derived Sulfonium Ylide[J].Synlett,2005,10:1621-1623.
[13]YES,HUANG Z Z,XIA CA,et al.A Novel Chiral Sulfonium Yilde:Highly Enantioselective Synthesis of Vinylcyclo propanes[J].JAm Chem Soc,2002,124(11):2432-2433.
[14]AGGARWAL V K,ABDEL-Rahman H,JONES R V,et al.Novel Catalytic Cycle for the Synthesis of Epoxides from Aldehydesand Sulfur YlidesMediated by Catalytic Quantitiesof Sulfidesand Rh2(OAc)4[J].JAm Chem Soc,1994,116(4):5973-5974.
[15]AGGARWAL V K,THOMPSON A,JONESR V,et al.The use of chiral sulfides in catalytic asymmetric epoxidation[J]. Tetrahedron:Asymmetry,1995,6(10):2557-2564.
[16]AGGARWAL V K,ABDEL-rahman H,THOMPSON A,etal.A Novel Catalytic Cycle for the Synthesis of Epoxides Using Sulfur Ylides,and Application to the Synthesis of Cyclopropanes and Aziridines[J].Phosphorus,Sulfur Silicon Relat Elem, 1994,95(1-4):283-292.
[17]AGGARWAL V K,SMITH HW,HYND G,et al.Catalytic cyclopropanation of electron deficient alkenes mediated by chiral and achiral sulfides:scope and limitations in reactions involving phenyl diazome thane and ethyl diazoacetate[J].JChem Soc, Perkin Trans1,2000:3267-3276.
[18]AGGARWAL V K,ALONSO E,FANGG Y,et al.Catalytic Asymmetric Synthesis of Epoxides from Aldehydes Using Sulfur Ylides with In Situ Generation of Diazocom pounds[J].Angew Chem IntEd,2001,40(8):1430-1433.
[19]DENG X M,CAI P,TONG Y.Enantioselective Synthesis of Vinylcyclopropanes and Vinylepoxides Mediated by Camphor-Derived Sulfur Ylides:Rationale of Enantioselectivity,Scope,and Limitation[J].JAm Chem Soc,2006,128(30): 9730-9740.
[20]ZHU BH,ZHOUR,ZHENG JC,et al.Highly Selective Ylide-Initiated Michael Addition/Cyclization Reaction for Synthesis of Cyclohexadiene Epoxideand Vinylcyclopropane Derivatives[J].JOrg Chem,2010,75(10):3454-3457.
[21]KENGO A,SHOTA T,NAGAMINE I S,et al.Peptide-Catalyzed Diastereo- and Enantioselective Cyclopropanation of Aromatic α,β -Unsaturated Aldehydes[J].Org Lett,2013,15(19):4964-4967.
[22]JOHNSON A k,LACOUNT R B.9-dimethyoxosulfonium fluorenylide[J].Chem Ind(London),1958(4):1440-1441.
[23]TROST B M,HAMMEN R F.New synthetic methods.Transfer of chirality from sulfur to carbon[J].JAm Chem Soc,1973,95
(3):962-964.
[24]FURUKAWA N,SUGIHARA Y,FUJIHARA H.Camphoryl sulfide as a chiral auxiliary and a mediator for one-step synthesis of optically active1,2-diaryloxiranes[J].JOrg Chem,1989,54(17):4222-4224.
[25]BREAU L,OGILVIE WW,DURST T.Stereochemical studies of epoxides relevant to the ansa chain of the streptovaricins[J]. Tetrahedron Lett,1990,31(1):35-37.
[26]DURST T,BREAU L,BEN R N.Application to the Synthesis of Optically Active Epoxides s[J].Phosphorus,Sulfur,Silicon, 1993,74(1-4):215-232.
[27]LI A H,DAI L X,HOU X L,et al.Preparation of Enantiomerically Enriched(2R,3R)-or(2S,3S)-trans-2, 3-Diaryloxiranes via Camphor-Derived Sulfonium Ylides[J].JOrg Chem,1996,61(2):489-493.
[28]ZANADI J,LERIVEREND C,AUTERT D,et al.A Catalytic Cycle for the Asymmetric Synthesis of Epoxides Using Sulfur Ylides[J].JOrgChem,2001,66(16):5620-5623.
[29]WINCL,BELLANIEB,GOODMAN JM.A highly enantioselective one- pot sulfur ylide epoxidation reaction[J].Tetrahedron Lett.,2002,43(31):5427-5430.
[30]AGGARWAL V K,THOMPSON A,JONESR V,et al.The use of chiral sulfides in catalytic asymmetric epoxidation[J]. Tetrahedron:Asymmetry,1995,6(10):2557-2564.
[31]AGGARWAL V K,ALONSO E,HYND G,et al.Catalytic Asymmetric Synthesis of Epoxides from Aldehydes Using Sulfur Ylideswith In Situ Generation ofDiazocompounds[J].Angew Chem IntEd,2001,40(8):1430-1433.
[32]WU H Y,CHANG CW,CHEIN R J.Enantioselective Synthesis of(Thiolan-2-yl)diphenylmethanoland Its Application in Asymmetric,Catalytic Sulfur Ylide-Mediated Epoxidation[J].JOrg Chem,2013,78(11):5788-5793.
[33]ILLA O,NAMUTEBI M,SAHA C,et at.Practical and Highly Selective Sulfur Ylide- Mediated Asymmetric Epoxidations and Aziridinations Using a Cheap and Readily Available Chiral Sulfide:Extensive Studies To Map Out Scope,Limitations,and Rationalization of Diastereo- and Enantioselectivities[J].JAm Chem Soc,2013,135(32):11951-11966.
[34]AGGARWALV K,THOMPSON A,JONESR V H,etal.Novel Catalytic and Asymmetric Process for Aziridination Mediated by Sulfur Ylides[J].JOrg Chem,1996,61(24):8368-8369.
[35]AGGARWA L V K,ALONSO E,FANG G Y.Application of Chiral Sulfides to Catalytic Asymmetric Aziridination and Cyclopropanation with In Situ Generation of the Diazo Compound[J].Angew Chem IntEd Engl,2001,40(8):1433-1436.
[36]AGGARWAL V K,FERRAR A M,BRIEN C.Scope and limitations in sulfur ylide mediated catalytic asymmetric aziridination of imines:use of phenyldiazomethane,diazoesters and diazoacetamides[J].J Chem Soc,Perkin Trans1,2001,14:1635-1643.
[37]AGGARWAL V K,STENSON R A,JONESR VH.A novelprocedure for the synthesis of aziridines:application of Simmons Smith reagents toaziridination[J].Tetrahedron Lett,2001,42(8):1587-1589.
[38]LI AH,DAI L X,HOU X L.The first efficient preparation of vinylaziridines via an ylide route[J].Chem,Coummun,1996(4): 491-492.
[39]LIA H,DAILX,HOU X L.Facile preparation of vinylaziridines by the reaction of N- sulfonylimines and cinnamyl bromide mediated by a catalytic amount of dimethyl sulfide[J].J Chem Soc,Perkin Trans1,1996,9:867-869.
[40]LIA H,DAIL X,HOU X L,et al.A Direct Route to C-Vinylaziridines:Reaction of N- Sufonylimines with Allylic Ylides under Phase-Transfer Conditionsorwith Preformed Ylidesat Low Temperature[J].JOrg Chem,1996,61(14):4641-4648.
[41]LI A H,ZHOU Y G,DAI L X,et al.Asymmetric Aziridination over Ylides:Highly Stereoselective Synthesis of Acetylenyl-N-sulfonylaziridines[J].Angew Chem IntEd Engl,1997,36(12):1317-1319.
[42]SAITO T,SAKAIRI M,AKIBA D.Enantioselective synthesis of aziridines from imines and alkyl halides using a camphor-derived chiral sulfidemediator via the imino Corey Chaykovsky reaction[J].Tetrahedron Lett,2001,42(32): 5451-5454.
[43]ILLA O,ARSHAD M,ROSA,et al.Practical and Highly Selective Sulfur Ylide Mediated Asymmetric Epoxidations and AziridinationsUsing an Inexpensive,Readily Available ChiralSulfide.Applications to the SynthesisofQuinine and Quinidine[J].JAm Chem Soc,2010,132(6):1828-1830.
【责任编辑:周绍缨410154121@qq.com】Application of chiral sulfur ylides in asymmetric synthesis of three membered ring com pounds
YAN Xue-ming1,ZHANG Hong-ying1,2
(1.College of Chemistry and Chemical Engineering,University of South China,Hengyang 421001,China; 2.Hengyang Finace Economics and Industry Polytechnic,Hengyang 421001,China)
The synthesis and application of the three membered ring structure has get much attentions in recent years.The recent progress in research of chiral sulfur ylides in asymmetric cyclopropanation,propylene oxide, aziridine is summarized.The research direction of asym metric synthesis of chiral threemembered ring in future isput forward.
ylides;threemembered ring;asymmetric synthesis;chiral
TQ032.42
A
1008-0171(2015)05-0071-10
2015-01-15
湖南省教育厅科学研究重点资助项目(14C0157);衡阳市工业科技支撑计划项目(2014KG28);衡阳市科技发展计划项目(2013KJ06);南华大学高层次人才启动基金项目(2012XQD008)
颜雪明(1976-),男,江西永新人,南华大学副教授,博士。
