中空纳米二氧化硅复合微球的制备及其对蛋白的亲和分离
2015-11-30田淑芳邹雪艳卢海涛何建英陈丹云赵彦保郭静玉
田淑芳 邹雪艳 卢海涛 何建英 陈丹云 赵彦保 郭静玉
中空纳米二氧化硅复合微球的制备及其对蛋白的亲和分离
田淑芳1,2邹雪艳*,2卢海涛3何建英1陈丹云1赵彦保2郭静玉1
(1河南大学化学化工学院,开封475004)
(2河南大学特种功能材料重点实验室,开封475004)
(3河南大学民生学院,开封475004)
利用水热法合成了中空巯基纳米二氧化硅微球(SiO2-SH),然后在其表面修饰亚氨基二乙酸基团(-IDA),形成了中空SiO2-SH/IDA双功能化纳米微球。利用该纳米微球表面的-SH和-IDA双功能团,可以更多的吸附溶液中的Ni2+,形成SiO2-SH/IDA-Ni2+复合微球从而可以更好的分离以六聚组氨酸为标签的(His-tagged)蛋白。结果显示制备的样品对分离His-tagged蛋白具有广谱性,并且具有较好的再生能力。
中空微球;SiO2;蛋白分离;功能化;亲和
近年来,随着纳米技术的迅速发展,具有新颖拓扑结构的纳米粒子引起了人们的极大兴趣[1-3]。其中,中空二氧化硅材料因其具有大比表面积、高热稳定性和规则孔道结构等优点在催化吸附、分离提纯、生物材料、纳米材料、环境、能源等领域显示出广泛的应用前景[4-6]。特别是无机氧化物(如TiO2、 SiO2、Fe3O4等)中空微球[7-9],因密度低、热力学稳定性高等特性备受关注。但在实际应用中,仅仅依靠介孔材料骨架二氧化硅的性能还远远不能满足要求,需要对其表面及孔道进行功能化处理[10-12]。镍离子亲和层析法(Immobilized metal ion affinity chromatography,IMAC)随之出现[13-16],它的主要原理为六聚组氨酸链(His-tagged)对某些金属离子(如Ni2+、Cu2+和Co2+)具有亲和能力,能够特异性的固定这些离子,从而达到亲和分离的目的。His-tagged蛋白很容易通过微生物细胞进行表达[17-18],并且通过适当处理,可实现表面修饰金属离子的再生[19-20]。尽管如此,这些合成方法仍有一定的局限性:通过多步嫁接方式很难获得高密度的功能化基团,从而导致有限的比表面积和较低的表面金属离子浓度,最终导致低的蛋白质纯化效率。
为了较好的解决这个问题,本文采用一步法直接合成了中空巯基纳米二氧化硅微球(SiO2-SH),并在其表面修饰-IDA基团,使之成为SiO2-SH/IDA双功能团复合材料,大大提高了表面Ni2+的吸附量。同时由于中空SiO2-SH本身具有较高的比表面积,从而用之分离蛋白具有更大的优势。
1 实验部分
1.1 试剂与仪器
1.1.1 试剂
巯基丙基三甲氧基硅烷(MPS,95%)购自Alfa-Aesar公司;正硅酸乙酯(TEOS)购自天津市福晨化学试剂厂;十六烷基三甲基氯化铵(CTAC,≥98.0%)购自国药集团化学试剂有限公司;三乙醇胺(TEA,≥99.0%),亚氨基二乙酸(IDA,98%),3-(2,3-环氧丙氧)丙基三甲氧基硅烷(GPTMS)均购自阿拉丁公司;十六烷基三甲基氯化铵(CTAC,≥99.0%)均购自天津市科密欧化学试剂有限公司。
1.1.2 仪器
样品的形貌及组成用透射电子显微镜(TEM,JEOL JEM-2010型,日本电子株式会社),傅立叶变换红外光谱仪(FT-IR,AVATAR360型,美国尼高力公司),热重分析仪(TG,TGA/SDTA851e,Merrler-Toledo Instruments公司)进行检测;捕获的Histagged蛋白用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳检测(SDS-PAGE,Power PAC 300,郑州宝赛科贸有限公司),稳压电压是70 V,分离电压是120 V。捕获蛋白的含量用紫外-可见分光光度计(UV-Vis,nanodrop 2000c,美国Thermo公司)进行测定,测定波长为400 nm。
1.2 实验步骤
1.2.1 SiO2-SH的制备
在50 mL烧瓶中加入17 mL水,2.8 mL无水乙醇,0.03 g CTAC,搅拌10 min后加入1.1 mL TEA,继续搅拌20 min后升温至60℃,加入1.4 mL TEOS和1.4 mL MPS的混合物,继续反应3 h。得到的产物转入50 mL高压反应釜中,于110℃反应48 h,自然冷至室温。离心后沉淀用盐酸乙醇溶液洗涤3次。最后用无水乙醇洗涤3次后于60℃烘干,即得到SiO2-SH样品。
1.2.2 SiO2-SH/IDA的制备
称取1.7 g IDA,加入20 mL去离子水溶解在烧瓶中,然后用NaOH调节溶液的pH值为11,在0℃冰浴条件下,边搅拌边加入2 mL GPTMS,随后将溶液加热至65℃,反应12 h。取3 mL GPTMS-IDA溶液将其pH值调制为2,加入0.1 g SiO2-SH微球,分散后升温至90℃反应3 h,溶液离心、洗涤后得到SiO2-SH/IDA样品。
1.2.3 SiO2-SH/IDA微球吸附Ni2+
准确称取3 mg SiO2-SH/IDA样品,分散在50 mL的2 mol·L-1NiCl2溶液中,于25℃水浴震荡反应2 h,之后沉淀用去离子水洗涤6次,分散在1 mL 25%的乙醇中备用,即得SiO2-SH/IDA-Ni2+样品。
1.2.4 SiO2-SH/IDA-Ni2+微球对His-tagged蛋白的分离
文中分离的蛋白为His-tagged Thioredoxin(Histagged TRX)[20],来自于PET-32a质体[21],六聚组氨酸为标签的重组质体被植入大肠杆菌体内,并用常规的方法进行蛋白的表达[22]。一般来说,所有Histagged融合蛋白都可以用亲和分离的方法捕获分离。蛋白分离的具体步骤如下:首先用1 000μL破菌buffer(20 mmol·L-1Tris-HCl,含0.2 mol·L-1NaCl)洗涤SiO2-SH/IDA-Ni2+复合材料,然后将这些复合材料分散到1 500μL细胞裂解液中,在摇床上(90 r· min-1)4℃孵育2 h。随后,将捕获了目标蛋白的复合材料用破菌buffer离心洗涤数次以去除表面残留的蛋白。最后,捕获的His-tagged TRX蛋白用一定浓度的300μL咪唑进行洗脱,取适量洗脱后的蛋白进行SDS-PAGE分析。
2 结果与讨论
2.1 TEM分析
图1为制备样品的TEM图,从图中可以看出,制备的样品为中空微球,内部有多处中空,样品粒径均一,分散性好,平均粒径为90 nm,壳层较厚。

图1 制备SiO2-SH样品的TEM图Fig.1 TEM image of the prepared SiO2-SH sample
2.2 FT-IR分析
图2给出了所制备的SiO2-SH/IDA样品的FTIR图。从图中可以看出,1 124、801和471 cm-1均有明显的红外吸收峰,归因于Si-O-Si的反对称及反对称伸缩吸收峰和弯曲振动吸收峰,说明该样品的主要成分为SiO2[23-24]。2 550 cm-1处的强峰对应微球中-SH基团的伸缩振动[25],说明制备的样品中含有-SH基团。2 926 cm-1为亚甲基的伸缩振动峰,这可能是由于引入-SH或-IDA基团引起的。对比图2b中SiO2-SH(曲线1)和SiO2-SH/IDA(曲线2)的变化可以看出,曲线2在1 623 cm-1处增加了-NH及COO-的伸缩振动峰,1 528 cm-1处增加了N-HⅡ的面内弯曲振动吸收振动峰[26],说明制备样品的表面成功修饰了-IDA基团。

图2 (a)SiO2-SH/IDA的样品的FT-IR图;(b)制备SiO2-SH和SiO2-SH/IDA样品的FT-IR图Fig.2(a)FT-IR spectrum of the parpared SiO2-SH/IDA sample;(b)FT-IR spectrum of the preparedSiO2-SH and SiO2-SH/IDA samples
2.3 TG曲线
图3为制备SiO2-SH和SiO2-SH/IDA样品的TG图,从图中可以看出样品从室温~800℃均有明显的失重,其中室温~240℃为表面吸附水的失重,而主要的失重出现在240~800℃,从曲线1可以看出样品SiO2-SH的失重率约为37.9%,这主要为表面巯基的失重率。从曲线2可以看出,样品SiO2-SH/IDA的失重率为41.7%,这主要是由于表面修饰的-SH和-IDA基团的热分解所致,说明表面具有较高的官能团密度。对比两条曲线可以看出,曲线2比曲线1多失重约3.8%,这可能是由于表面-IDA基团的热分解所引起的。

图3 制备SiO2-SH和SiO2-SH/IDA样品的TG曲线Fig.3 TG curve of the prepared SiO2-SH and SiO2-SH/IDA samples
2.4 捕获蛋白测评
亲和分离是一种常规分离蛋白的方法,它的基本原理是利用载体表面的基团与蛋白质进行特异性结合,从而达到分离目标蛋白的效果。从图4可以看出,样品从制备到分离His-tagged目标蛋白共需要4步:首先水热法一步合成中空SiO2-SH微球,随后在微球表面修饰-IDA基团形成SiO2-SH/IDA,并用其来吸附Ni2+,从而形成SiO2-SH/IDA-Ni2+复合微球,最后将制备的微球直接用于混合蛋白的分离,可将His-tagged融合蛋白从混合蛋白中分离提纯。其可能的作用机理为,-SH和-IDA基团对溶液中的Ni2+具有协同作用,可以吸附更多的Ni2+,从而增加表面离子密度,进而更好的分离His-tagged融合蛋白。而传统的材料中一般只有一种金属螯合基团,如-IDA、-NTA(氨基三乙酸)、-CM-ASP(羧甲基天冬氨酸)[27-28]。

图4 制备样品及分离目标蛋白示意图Fig.4 Scheme of the synthesis of the sample and separation of the target protein by the prepared sample
为了确定最佳的咪唑洗脱浓度,我们考察了不同浓度洗脱条件下制备的SiO2-SH/IDA-Ni2+复合微球分离His-tagged TRX蛋白的效果,图5为不同咪唑浓度洗脱下制备微球分离目标蛋白的SDS-PAGE电泳图,泳道1:混合蛋白;泳道2:0.5 mol·L-1;泳道3:1 mol·L-1;泳道4:2 mol·L-1;泳道5:3 mol·L-1。从图中可以看出,当改变咪唑洗脱浓度时,随着咪唑浓度的增加,洗脱目标蛋白的量逐渐增加,当咪唑浓度为1 mol·L-1时,洗脱下来目标蛋白已达到最大,且几乎没有杂蛋白。当继续增加咪唑浓度时(2、3 mol·L-1),洗脱下来杂蛋白的量也随之增多,因此,我们以下测试选用咪唑的浓度为1 mol·L-1。
为了测试制备样品对目标蛋白的检测限,我们对不同梯度的His-tagged TRX蛋白进行检测。图5泳道6~9为不同His-tagged TRX加入量分离蛋白的SDS-PAGE图:泳道6:His-TRX浓度100μmol· L-1;泳道7:His-TRX梯度10μmol·L-1;泳道8:His-TRX梯度1.0μmol·L-1;泳道9:0.1μmol·L-1。从泳道6~8可以看出,当His-tagged TRX浓度在100~1.0μmol·L-1时,制备的样品对目标蛋白均有较好的检测效果,当蛋白浓度为0.1μmol·L-1时,泳道9的条带较弱,说明样品对目标蛋白的检测能力较弱,即制备样品对His-tagged TRX蛋白的检测限至少为1.0μmol·L-1,具有较好的响应效果。

图5 不同咪唑浓度及不同浓度His-tagged TRX蛋白浓度条件下SiO2-SH/IDA-Ni2+复合微球分离Histagged TRX蛋白的电泳图Fig.5 SDS-PAGE analysis of purified His-tagged TRX proteins by the prepared SiO2-SH/IDA-Ni2+composite NSs in different concentration of imidazole and different concentration His-tagged TRX proteins were used
泳道10为商品凝胶分离混合蛋白的电泳图,从图中可以看出,文中制备样品分离目标蛋白的效果(泳道2)与商品凝胶分离效果(泳道10)相当,由于商品凝胶分离蛋白需要多次过柱子,操作比较繁琐,所以与之相比,制备样品分离目标蛋白的操作更简便、快捷。
为了考察制备SiO2-SH/IDA-Ni2+复合微球的再生能力,我们用EDTA和NiCl2溶液对分离过Histagged TRX蛋白的微球进行处理,然后再用其分离混合蛋白。图6中泳道1为Marker,泳道2为混合蛋白,泳道3~5分别为第一次再生、第二次再生、第三次再生后复合微球对His-tagged TRX蛋白分离的电泳图。从图6可以看出,制备的微球再生3次,仍对混合蛋白中His-tagged TRX蛋白具有较高的分离能力(泳道3~5),说明此微球具有较强的再生能力。
为了考察制备的SiO2-SH/IDA-Ni2+复合微球分离His-tagged融合蛋白的广谱性,我们又考察了SiO2-SH/IDA-Ni2+微球对His-tagged Light Oxygen Voltage(His-tagged LOV)蛋白的分离效果,图7中泳道1为制备的SiO2-SH/IDA-Ni2+样品从混合蛋白中分离His-tagged LOV蛋白的电泳图,泳道2为混合蛋白,泳道3为Marker。从图7可以看出,制备的样品对His-tagged LOV蛋白仍具有较好的特异性分离效果,能够从混合蛋白中将目标蛋白分离出来,说明制备的SiO2-SH/IDA-Ni2+样品对His-tagged的蛋白具有广谱性[29]。

图6 SiO2-SH/IDA-Ni2+复合微球循环分离His-tagged TRX蛋白的SDS-PAGE图Fig.6 SDS-PAGE analysis of purified His-tagged TRX proteins by the prepared SiO2-SH/IDA-Ni2+NSs for four times
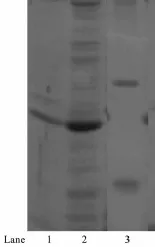
图7 SiO2-SH/IDA-Ni2+复合微球分离His-tagged LOV蛋白的SDS-PAGE图Fig.7 SDS-PAGE analysis of purified His-tagged LOV proteins by the prepared SiO2-SH/IDA-Ni2+NSs
3 结论
本文中,我们通过一步法直接制备了中空巯基二氧化硅纳米微球,然后在其表面修饰-IDA基团,并用其吸附Ni2+,从而形成SiO2-SH/IDA-Ni2+纳米微球。利用该微球可以有效的分离His-tagged融合蛋白,操作简便快捷,对目标蛋白检测灵敏度高,并且通过再生处理,可实现微球的多次循环利用,具有潜在的市场价值。与商品凝胶分离介质相比,分离目标蛋白操作更简便、快捷。
[1]Nanguo L,Bradley S P,Victor IK.J.Am.Chem.Soc.,2006, 128:15362-15363
[2]Li X L,Liu Y Q,Fu L,et al.J.Phys.Chem.C,2007,111: 7661-7665
[3]Han J,Song G P,Guo R.Chem.Mater.,2007,19:973-975
[4]Joo S H,Ryoo R,Kruk M,et al.J.Phys.Chem.,2002,106: 4640-4646
[5]Yamada T,Zhou H S,Hiroishi D,et al.Adv.Mater.,2003, 15:511-513
[6]Yonezawa T,Matsune H,Kimizuka N.Adv.Mater.,2003,15: 499-503
[7]Feng X M,Mao C J,Yang G,et al.Langmuir,2006,22:4384 -4389
[8]Li L L,Chu Y,Liu Y,et al.J.Phys.Chem.,2007,111:2123-2127
[9]Masahiro F,Kumi S,Ikuko S,etal.Nano Lett.,2006,6:2925-2928
[10]Melero J A,Rafael G,Gabriel M,et al.Energy Fuels,2007, 21:1782-1791
[11]Ji X,Hu Q,Hampsey J E,et al.Chem.Mater.,2006,18: 2265-2274
[12]Yang D,Xu Y,Wu D,et al.J.Phys.Chem.C,2007,111: 999-1004
[13]Xie H Y,Zhen R,Wang B,et al.J.Phy.Chem.C,2010,114: 4825-4830
[14]Yang L,Guo C,Chen S,et al.Ind.Eng.Chem.Res.,2009, 48:944-950
[15]Lee I S,Lee N,Park J,et al.J.Am.Chem.Soc.,2006,128: 10658-10659
[16]Lee K S,Lee I S.Chem.Commun.,2008:709-711
[17]Porath J,Carlsson J,Olsson I,et al.Nature,1975,258:598-599
[18]Xu F,Geiger J H,Baker G L,et al.Langmuir,2011,27: 3106-3112
[19]Ahrends R,Pieper S,Neumann B,et al.Anal.Chem.,2009, 81:2176-2184
[20]Kim J,Piao Y,Lee N,et al.Adv.Mater.,2009,22:57-60
[21]Jeng M F,Campbell A P,Begley T,et al.Structure,1994,2: 853-868
[22]LaVallie E R,Rehemtulla A,Racie L A,etal.J.Biol.Chem., 1993,268:23311-23317
[23]ZOU Xue-Yan(邹雪艳),CHU Liu-Jie(褚留杰),DONG Shuo (董烁),et al.Chem.J.Chinese Universities(高等学校化学学报),2012,33(7):1394-1400
[24]Li B J,Zou X Y,Zhao Y B,et al.Mater.Sci.Eng.C,2013, 33:2595-2600
[25]Zou X Y,Li K,Yin Y B,et al.Mater.Sci.Eng.C,2014,34: 468-473
[26]YAN Hong(颜红),WANG Chong(王冲),ZHOU Xiao-Hui(周小会),et al.Chinese J.Inorg.Chem.(无机化学学报),2011, 27:1642-1648
[27]Ma Z Y,Liu X Q,GuanY P,et al.Colloid Surf.A,2006, 275:87-91
[28]SUN Yong-Liang(孙永亮),LI Shu-Juan(李淑娟),HU Dao-Dao(胡道道),et al.J.Shaanxi Normal University(陕西师范大学学报),2007,35:67-71
[29]Xie H Y,Zheng R,Wang B,et al.J.Phys.Chem.C,2010, 114:4825-4830
Synthesis of Nanometer Hollow Silica Composite Microspheres for Affinity Separation of Protein
TIAN Shu-Fang1,2ZOU Xue-Yan*,2LU Hai-Tao3HE Jian-Ying1
CHEN Dan-Yun1ZHAO Yan-Bao2GUO Jing-Yu1
(1College of Chemistry and Chemical Enginerring,Henan University,Kaifeng,Henan 475004,China)
(2Key Laboratory for Special Functional Materials,Henan University,Kaifeng,Henan 475004,China)
(3Henan University Minsheng College,Kaifeng,Henan 475004,China)
Hollow silica nanospheres with thiolgroups(SiO2-SH NSs)have been successfully prepared through a hydrothermal route.Then the SiO2-SH NSs was further modified by conjugating iminodiacetic acid(IDA)to bear dual chelating groups(-SH and-COOH).After chelating Ni2+,these hollow NSs with dual chelating groups were applied to purify histidine-tagged(His-tagged)proteins.Results show thatthese hollow NSs can be widely used to separate His-tagged proteins and have a good reused ability.
hollow microspheres;silica;separation of protein;functionalization;affinity
O613.72
A
1001-4861(2015)07-1329-06
10.11862/CJIC.2015.191
2015-01-24。收修改稿日期:2015-04-25。
河南省教育厅科学技术重点研究项目(No.14B150003),国家自然科学基金(No.21271062)资助项目。
*通讯联系人。E-mail:zouxy182838@163.com
