基于嵌合抗原受体的肿瘤免疫治疗的研究进展
2015-11-30马建波
李 玲,马建波
基于嵌合抗原受体的肿瘤免疫治疗的研究进展
李 玲,马建波
近来关于嵌合抗原受体(chimeric antigen receptor,CAR)修饰T细胞在治疗包括淋巴瘤、白血病、脑胶质瘤、黑色素瘤、肺癌、前列腺癌、胰腺癌及卵巢癌等肿瘤所取得成绩令人振奋。CAR是利用基因工程将能够与肿瘤抗原结合的受体与跨细胞膜的部分和细胞内信号转导的部分结合起来形成的一种新型受体,它可脱离主要组织相容性复合体的限制单独执行杀伤细胞的功能。CAR修饰T细胞因其独特的设计和强效的抗肿瘤作用受到人们的追捧。作者就CAR修饰T细胞在临床治疗中的应用、遇到的问题和对应策略作一综述。
嵌合抗原受体;T细胞;肿瘤;免疫治疗
最近几十年来传统的肿瘤治疗方法(外科手术、化学治疗、放射治疗等)取得很大的进步,但是在生存率、复发和转移等方面仍存在巨大的挑战。随着肿瘤生物学和免疫学研究的进步和深入,近年来,免疫治疗逐步成为肿瘤治疗的新星。其中,基于嵌合抗原受体(chimeric antigen receptor,CAR)肿瘤免疫治疗技术开始崭露头角。CAR修饰的T细胞(chimeric antigen receptor-T cell,CAR-T)治疗这一概念最早是由Gross等[1]于1989年提出,CAR-T因不受主要组织相容性复合物(main histocompatibility complex,MHC)的限制而得到青睐。将近25年的时间里CAR-T在动物实验和临床试验中表现出良好的靶向性、杀伤性和体内持久性,在治疗淋巴瘤[2]、B细胞白血病[3-4]、脑胶质瘤[5]、成神经细胞瘤[6]、卵巢癌[7]等恶性肿瘤方面取得了很好的成效。
1 CAR-T
T细胞是人体内发挥特异性抗肿瘤作用的效应细胞,但其作用的发挥具有MHC限制。而人体内另一种特异性淋巴细胞B细胞的抗原受体及其分泌的抗体可以直接与相应的抗原结合。CAR-T是利用基因工程的方法将非MHC限制性方式识别目标抗原的单链抗体与间隔区、跨膜基序和T细胞的活化基序等结合为一体,并借助病毒等载体转染T细胞,以赋予T细胞更加强大的特异性杀伤肿瘤的能力[8]。多数CAR包括细胞外抗原结合区、细胞内信号转导区和中间的跨膜区域。细胞外抗原结合区是由铰链区连接来源于单克隆抗体轻链和重链的一段单链抗体(single chain fragment variable,scFv),其作用是特异性识别靶细胞表面的特异性抗原,选择合适的细胞外区片段是CAR的研究重点。细胞内信号转导区是介导T细胞内信号传递直至T细胞活化增殖从而最终完成杀伤肿瘤的过程,同样也是研究的重要内容,已经有很多研究聚焦于CAR产生的信号是如何激活T细胞的[9-10]。
CAR的发展可因其刺激信号分子组合方式的不同分为3代。第1代CAR仅含有一个信号单元,大多来自于CD3ζ或者FcRg亚单位[11]。这种方式修饰的T细胞只能产生短暂的分裂,最高的扩增倍数是3.75倍[12];在一些临床应用上T细胞的存活时间不超过63 d,而且在肿瘤位置处没有检测到有T细胞的存在[13-15];分泌的细胞因子较少不足以促使T细胞对抗强大的肿瘤细胞以致T细胞凋亡[16]。因此,第1代CAR在临床上治疗淋巴瘤、成神经细胞瘤、卵巢癌和肾癌等受到了一定的限制[12,17-19]。
第2代CAR的研究更多关注的是如何在第1代CAR的基础上引入1个共刺激分子,也就是T细胞受体与配体相结合的共刺激路径。研究表明,细胞内含有CD28分子与CD3ζ的CAR不仅增加T细胞的扩增倍数而且增强了T细胞的抗肿瘤特性[20-23]。现在已经有大量的研究证明除了CD28分子外,肿瘤坏死因子家族成员CD27、4-1BB(CD137)、OX40 (CD134)等均可以为CAR-T提供协同刺激信号[24-26]。Savoldo等[15]在治疗B细胞淋巴瘤时分别用CD19 CAR-T和CD19-28 CAR-T来比较第1代和第2代CAR的抗肿瘤效果,结果显示在T细胞的扩增和体内持久性方面第2代CAR都优于第1代CAR,目前用于临床试验的主要是第2代CAR。
第3代CAR是在第2代的基础上又增加了1个共刺激分子。有研究表明,2个CD28及4-1BB、CD3ζ偶联形成的第3代CAR可增强T细胞的杀瘤能力,并延长了T细胞在体内的存活时间,尽管一些临床前实验证明第3代CAR在T细胞的扩增倍数、体内存活时间以及分泌细胞因子的能力都较第2代有优势[27-29]。但是美国Morgan等[30]报道的1例结肠癌合并肝和肺转移患者,在应用第3代人类表皮生长因子受体2-CAR-T治疗后第5天死亡的结果表明,第3代CAR技术用于临床仍然存在一定的风险。因此,第3代CAR用于临床还有较长的路要走。CAR结构见图1。
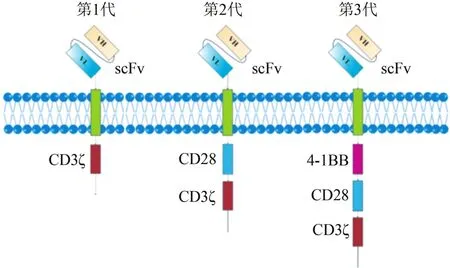
图1 嵌合抗原受体结构
2 CAR-T在临床应用中遇到的问题
目前,CAR-T在淋巴瘤、白血病治疗的临床应用已获得了可喜的成绩,在卵巢癌、乳腺癌、肺癌等研究中也取得了一定的突破(表1)。但是现在CART治疗领域也面临着不少需要解决的问题,如输注细胞数量、T细胞增殖能力、支持性细胞因子、输注细胞时机等在内的临床方案的优化,已经取得成功的CAR-T治疗是否可以进入肿瘤疾病的标准治疗程序。CD19 CAR-T在血液肿瘤治疗中的成功是否可以成功延展到实体恶性肿瘤。此外,CAR-T的研究以及临床应用中还暴露出了一些诸如脱靶效应、“细胞因子风暴”的不良反应,这些都值得关注和需要进一步研究。
2.1 脱靶效应 目前,越来越多的临床试验暴露出CAR-T的安全问题。首先就是脱靶效应,其主要特征是导致针对正常组织的杀伤作用。用于肿瘤治疗的多数靶抗原在人体正常组织中也会有微量的表达,所以对靶抗原亲和力强、杀伤能力强的CAR-T与这类抗原作用势必造成组织损伤,即为“脱靶效应”。肿瘤抗原分为肿瘤特异性抗原(tumor specific antigen,TSA)和肿瘤相关抗原(tumor associated antigen,TAA)。TSA只表达于肿瘤细胞而不表达于正常细胞的抗原。TAA是指一类既表达于肿瘤细胞,也表达于正常细胞的抗原。目前发现和应用的肿瘤抗原中TSA相对较少,大多是TAA,其中研究最多的是以CD19、CD20为靶抗原的CAR-T治疗B细胞恶性肿瘤[31-34]。这类以 CD19、CD20为靶抗原的CAR-T治疗在高效杀伤恶性B细胞的同时也杀伤机体内其他B细胞,导致患者长期处于免疫功能低下状态,需采用特定的维持疗法。

表1 CAR-T治疗肿瘤的临床试验
Lamers等[19]研究表明,用特异性识别碳酸酐酶-ⅨCAR修饰T细胞在治疗转移性肾细胞癌时因为正常肝脏细胞会有少量碳酸酐酶-Ⅸ的表达,对肝细胞造成了一定的毒性,说明CAR-T的脱靶问题在临床治疗中需要持续的关注。研发与靶抗原具有特定亲和力的CAR-T可能不失为一种有效的解决办法;另外,发现和使用肿瘤特异性抗原作为CAR-T治疗的靶点虽然比较困难,但也是最为有效的解决方法。
2.2 细胞因子风暴 第2、3代CAR中引入了1个或多个共刺激分子,细胞活化、增殖、杀伤能力大幅增强,致使细胞治疗过程中多种细胞因子,如白介素(interleukin,IL)-1、IL-6、IL-12、γ-干扰素等大量释放到机体循环系统中,引起恶心、头痛、心动过速、低血压、皮疹、呼吸急促等临床症状,严重者可导致多器官功能衰竭或者急性呼吸窘迫综合征,这就是所谓的“细胞因子风暴”。“细胞因子风暴”常发生于细胞治疗后6~20 d,与患者原有的疾病、基因多态性和CAR的结构因素关系密切。Brentjens等[35]报道的1例慢性淋巴细胞白血病患者死亡的详情,该患者在输入第2代CAR修饰的自体T细胞2 d便出现发热、低血压、呼吸困难和肾衰竭,并于治疗后4 d死亡,“细胞因子风暴”可能是其致死的主要原因之一。
除了以上提到的细胞毒性,CAR-T引起的过敏反应也是值得关注的。Maus等[36]报道了4例鼠源抗体修饰的CAR-T在第3次输入患者体内后,4例均在数分钟内产生过敏反应,接着心脏骤停。可能是因为鼠源性的序列诱导患者体内产生免疫蛋白E抗体,从而导致患者死亡。这项研究说明鼠源抗体也是CAR-T用于临床治疗肿瘤的一个隐患。
3 CAR-T应用的新策略
3.1 效应细胞的选择 目前用于CAR技术的主要效应细胞有T细胞、自然杀伤(natural killer cell,NK)细胞、肿瘤浸润淋巴细胞等,其中大多数是T细胞[37]。研究显示,表达CAR的不同T细胞亚群的临床抗肿瘤效果是有差异的,所以对最有效的T细胞亚群进行精确检测和分离可谓是重中之重;已证实CD8+是主要的效应细胞,CD4+可辅助细胞免疫进行应答,如果将两者共同培养可促进细胞毒效应T细胞的大量制备;初始T细胞和中枢记忆T细胞的侵入能力均优于已经分化了的T细胞[38-40]。Gattinoni等[41]于2011年发现干细胞样记忆T细胞有着兼具初始T细胞和记忆T细胞两者的优势,在临床模型中表现出较好的效果。另外,CAR-T的杀瘤能力和亚型与体外培养所加的细胞因子相关。Xu等[42]研究了CAR-T在体内的持久性及杀瘤能力与体外培养所加的细胞因子之间的关系,发现体外培养时加入IL-7和IL-15可提高CAR-T的杀伤肿瘤能力。Gargett和Brown[43]的研究也发现了同样的结果,而且建议将IL-7、IL-15用于临床治疗时细胞的体外培养。
另外,具有抗肿瘤能力的NK细胞也被用作CAR的效应细胞,早在10年前,Imai等[44]就发现可通过反转录病毒介导CD19 CAR实现NK细胞对ALL的治疗,且共刺激分子CD137能增强其功效。
另一种具有抗肿瘤效应的细胞因子诱导的杀伤细胞,因其具有广谱抗肿瘤作用、不需要接触抗原即可在培养基中快速扩增的特点[45],被越来越多的研发人员尤其是国内的研究人员作为CAR的效应细胞。
3.2 人工调控CAR表达 基因治疗的安全性仍然是人们最为关注的热点之一,而人工调控基因表达是解决基因治疗安全性问题的策略之一。即在进行细胞治疗时可以引入自杀式人工调控开关,发生毒性反应后可通过诱导自杀基因表达来清除基因修饰的T细胞,从而防止严重后果的发生。化学诱导二聚化/半胱天冬酶9、单纯疱疹病毒胸苷激酶/丙氧鸟苷已被引入CAR-T治疗中[46-47]。CAR-T中引入自杀基因可有效地将细胞毒性减到最小,从而提高治疗效果。
3.3 共刺激分子组合的优化 第2、3代CAR因加入了2个或者多个共刺激分子使得T细胞的杀瘤能力、细胞因子的释放和在体内的存留时间都大大增加,可见共刺激分子的数量及组合方式对T细胞的功能有很大的影响。如何才能选择最优的共刺激分子组合并获得最佳的CAR结构是目前研究的重点。Song等[48]和 Redmond等[49]将 CD28、CD134和CD137分别连接到CD3ζ链上,证明增加CD28后增强了T细胞的增殖能力,由此证明了CD28是必要的共刺激分子;后来又分别证明了CD134可增强被CD28修饰的T细胞的活化,CD137有助于延长T细胞的存活时间。可诱导的协同刺激分子的加入能有效地溶解目标细胞[10,25,50]。另外,CAR-T的杀瘤能力也受跨膜区序列的影响[51]。最优的CAR结构仍然是CAR技术开发的要点和热点。
3.4 转导方法的选择 目前应用最多的是以病毒作为载体。慢病毒载体是以人类免疫缺陷Ⅰ型病毒为基础发展起来的基因治疗载体,可有效感染包括干细胞、肿瘤细胞、神经元细胞在内的多种细胞,对处于细胞周期中的任一时期的细胞都有很强的感染能力。同时,慢病毒可避免反转录病毒带来的插入突变,还可以自身失活,这些优势都使得它成为“明星”载体。在CAR-T治疗的实验中,带有CD3或者CD28的慢病毒取得了良好的感染效果,其效率非常之高[52]。另有研究显示,细胞因子IL-7能够增加T细胞的感染率[53]。Lentigen公司的慢病毒包装系统在CAR-T治疗血液系统肿瘤中得到了很好的应用。但是构建重组的慢病毒载体的花费较高,这一缺点限制了慢病毒的使用。
作为基因工具,“睡美人(sleeping beauty,SB)”转座系统是由Ivics等[54]重建鲑鱼基因组中的一个失活基因而得到的,它在基因治疗和基因标签方面都发挥了非常重要的作用。SB转座子系统也能随机整合到人类T细胞基因组中[55]。SB转座系统在靶向CD19的CAR-T研究和靶向p53和T细胞识别黑色素瘤抗原-1的CAR-T研究中转染效率可达20%~30%。此外,Piggybac转座子系统在用于CAR修饰中不仅可以稳定长期的表达外源基因,还可装载长达18 kb的基因片段,能够代替Cre/loxP成为又一理想的载体[56]。最近,Saito等[57]研究Piggybac转座子介导CD19特异性CAR治疗费城染色体阳性急性淋巴细胞白血病的结果证明,Piggybac转座子可为细胞免疫治疗抗药性费城染色体阳性急性淋巴细胞白血病提供一个高效、廉价和安全的手段。
体外转录编码CAR的RNA是转导的另一个选择。研究表明,RNA的体外转导可在较短的时间内刺激更多CAR的表面抗原的表达,而且在治疗前期的模型实验中也证实了mRNA介导的CAR-T能够积极对抗肿瘤细胞[58-60]。虽然在细胞治疗前可直接进行RNA转导,但其存在明显的缺点:①短期内CAR的表达只能刺激少量T细胞的分化进而影响治疗效果,能否达到抵抗肿瘤的作用还有待于进一步研究;②用RNA转导这一方式也无法保证CAR-T在体内的存留时间和记忆效果。
质粒载体在基因治疗中占据着非常重要的地位,与病毒载体相比,质粒载体的构建花费较少,而且不会整合到宿主的基因组上,安全性有一定的保证。但是,质粒载体的构建需要花费更多的时间,其抗性基因以及未甲基化的序列会影响基因的表达,而且人类的体液和细胞免疫会对质粒载体的抗性基因产生免疫反应[14]。微环DNA是一种新颖的小环超螺旋表达框,可通过位点特异性重组得到,它缺乏复制原点、抗性标志基因的细菌序列,增强了临床上的安全性系数[61],在CAR-T治疗中有着自己的应用潜力。
此外,电击穿孔T细胞导入mRNA的转染效率可达90%以上;锌指蛋白核酸酶通过锌指蛋白的特异性识别靶细胞使得整合效率在20%以上[62]。基因组编辑新技术CRISPR-Cas是一种快速、高效、可靠的用于定点构建基因敲除的新方法,在动物模型中的应用前景非常广阔,或将成为细胞免疫治疗中基因转导方法的新选择。
3.5 构建双靶抗原CAR 细胞治疗中靶抗原应具有均一、特异性强且抗原分泌量较少的特点。为了达到以上要求,可以构建双靶抗原CAR来提高肿瘤的靶向性。其策略主要是让1个T细胞表达2个不同的CAR,即使其中一个CAR的抗原在正常组织中有少量表达,也可通过另一个CAR来提高T细胞的特异性。Duong等[63]在2011年的时候发表了1种类似的方法,结果证明表达2个不同CAR的T细胞可有效增强靶细胞的免疫反应。Kloss等[64]构建了针对前列腺特异性膜抗原和前列腺干细胞抗原的双靶抗原受体,研究发现表达双抗原受体的T细胞可有效地杀灭肿瘤细胞,而表达单抗原受体的T细胞只能影响肿瘤细胞的生长。Gheybi等[65]也构建了针对乳腺癌的双靶抗原黏蛋白1和HER2。通过构建双靶抗原可有效增加T细胞的特异性靶向抗肿瘤能力。
3.6 构建“通用”CAR 为了扩大T细胞在肿瘤治疗方面的应用,可以构建对多种肿瘤都起作用的“通用CAR(universal CAR,uCAR)”。Tamada等[66]和Urbanska等[67]构建的uCAR不仅使目的肿瘤分子溶解产生大量的细胞因子,还可以使T细胞迅速扩增。近来,Kudo等[68]构建的uCAR的细胞外信号区为高亲和性的CD16可变区和CD8a铰链区,且研究表明这种CAR对多种肿瘤都有很强的亲和力,而且T细胞的增殖也非常稳定。
另外,还可以构建抑制性CAR,用来拮抗痕量的CAR与正常组织的靶抗原作用后效应T细胞的激活。同时,还可以构建亲和性可调节的CAR,使其以不同的亲和性识别抗原表达量不同的肿瘤细胞。
4 展望
随着现代生物科学技术的快速发展,CAR-T在肿瘤治疗的临床应用中越来越被人们重视。时至今日,CAR的肿瘤免疫治疗已由第1代发展到第3代,CAR-T的优势和临床前期实验结果显示CAR-T在治疗肿瘤方面更是有着无可取代的应用前景。2014年9月4日美国食品和药物管理局批准了第1个程序性死亡受体1阻断药 Keytruda®(pembrolizumab),本品被誉为免疫肿瘤之星。在CAR-T治疗带来兴奋的同时也应该看到,肿瘤免疫治疗仍就处于发展阶段,有关CAR的大多数研究和临床试验仍以血液肿瘤为主,在实体性肿瘤方面还有很大的发展空间[69-70]。目前,越来越多的研究人员投入到对CAR肿瘤免疫治疗方法的探索和完善中,在现今医疗水平与日俱争的时代,有理由相信CAR-T在细胞免疫治疗肿瘤的舞台上将散发出更加璀璨的光芒。
[1]Gross G,Waks T,Eshhar Z.Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity[J].Proc Natl Acad Sci USA,1989,86(24):10024-10028.
[2]Kochenderfer JN,Rosenberg SA.Treating B-cell cancer with T cells expressing anti-CD19 chimeric antigen receptors[J].Nat Rev Clin Oncol,2013,10(5):267-276.
[3]Mazzarella L.Tales from the Jazz ASH:highlights from the 2013 American Society of Haematology meeting[J].Ecancermedicalscience,2014,8:390.
[4]Grupp SA,Kalos M,Barrett D,et al.Chimeric antigen receptor-modified T cells for acute lymphoid leukemia[J]. N Engl J Med,2013,368(16):1509-1518.
[5]Shen CJ,Yang YX,Han EQ,et al.Chimeric antigen receptor containing ICOS signaling domain mediates specific and efficient antitumor effect of T cells against EGFRvⅢexpressing glioma[J].J Hematol Oncol,2013,6(1):33.
[6]Pule MA,Savoldo B,Myers GD,et al.Virus-specific T cells engineered to coexpress tumor-specific receptors: persistence and antitumor activity in individuals with neuroblastoma[J].Nat Med,2008,14(11):1264-1270.
[7]Lanitis E,Poussin M,Hagemann IS,et al.Redirected antitumor activity of primary human lymphocytes transduced with a fully human anti-mesothelin chimeric receptor[J]. Mol Ther,2012,20(3):633-643.
[8]Ramos CA,Dotti G.Chimeric antigen receptor(CAR)-engineered lymphocytes for cancer therapy[J].Expert Opin Biol Ther,2011,11(7):855-873.
[9]Finney HM,Lawson AD,Bebbington CR,et al.Chimeric receptors providing both primary and costimulatory signaling in T cells from a single gene product[J].Immunol,1998,161(6):2791-2797.
[10]Milone MC,Fish JD,Carpenito C,et al.Chimeric receptors containing CD137 signal transduction domains mediate enhanced survival of T cells and increased antileukemic efficacy in vivo[J].Mol Ther,2009,17(8):1453-1464.
[11]Weijtens ME,Willemsen RA,Valerio D,et al.Single chain Ig/gamma gene-redirected human T lymphocytes produce cytokines,specifically lyse tumor cells,and recycle lytic capacity[J].Immunol,1996,157(2):836-843.
[12]Till BG,Jensen MC,Wang J,et al.Adoptive immunotherapy for indolent non-Hodgkin lymphoma and mantle cell lymphoma using genetically modified autologous CD20-specific T cells[J].Blood,2008,112(6):2261-2271.
[13]Louis CU,Savoldo B,Dotti G,et al.Antitumor activity and longterm fate of chimeric antigen receptor-positive T cells in patients with neuroblastoma[J].Blood,2011,118(23): 6050-6056.
[14]Jensen MC,Popplewell L,Cooper LJ,et al.Antitransgene rejection responses contribute to attenuated persistence of adoptively transferred CD20/CD19-specific chimeric antigen receptor redirected T cells in humans[J].Biol Blood Marrow Transplant,2010,16(9):1245-1256.
[15]Savoldo B,Ramos CA,Liu E,et al.CD28 costimulation improves expansion and persistence of chimeric antigen receptor-modified T cells in lymphoma patients[J].Clin Invest,2011,121(5):1822-1826.
[16]Brocker T,Karjalainen K.Signals through T cell receptorzeta chain alone are insufficient to prime resting T lymphocytes[J].Exp Med,1995,181(5):1653-1659.
[17]Kershaw MH,Westwood JA,Parker LL,et al.A phaseⅠstudy on adoptive immunotherapy using gene-modified T cells for ovarian cancer[J].Clin Cancer Res,2006,12 (20):6106-6115.
[18]Park JR,DiGiusto DL,Slovak M,et al.Adoptive transfer of chimeric antigen receptor re-directed cytolytic T lymphocyte clones in patients with neuroblastoma[J].Mol Ther,2007,15(4):825-833.
[19]Lamers CH,Sleijfer S,Vulto AG,et al.Treatment of metastatic renal cell carcinoma with autologous T-lymphocytes genetically retargeted against carbonic anhydraseⅨ:first clinical experience[J].Clin Oncol,2006,24(13):20-22.
[20]Gong MC,Latouche JB,Krause A,et al.Cancer patient T cells genetically targeted to prostate-specific membrane antigen specifically lyse prostate cancer cells and release cytokines in response to prostate-specific membrane antigen[J].Neoplasia,1999,1(2):123-127.
[21]Brentjens RJ,Latouche JB,Santos E,et al.Eradication of systemic B-cell tumors by genetically targeted human T lymphocytes co-stimulated by CD80 and interleukin-15 [J].Nat Med,2003,9(3):279-286.
[22]Maher J,Brentjens RJ,Gunset G,et al.Human T-lymphocyte cytotoxicity and proliferation directed by a single chimeric TCRzeta/CD28 receptor[J].Nat Biotechnol,2002,20(1):70-75.
[23]Alvarez-Vallina L,Hawkins RE.Antigen-specific targeting of CD28-mediated T cell co-stimulation using chimeric single-chain antibody variable fragment-CD28 receptors [J].Eur J Immunol,1996,26(10):2304-2309.
[24]Imai C,Mihara K,Andreansky M,et al.Chimeric receptors with 4-1BB signaling capacity provoke potent cytotoxicity against acute lymphoblastic leukemia[J].Leukemia,2004,18(4):676-684.
[25]Finney HM,Akbar AN,Lawson AD.Activation of resting human primary T cells with chimeric receptors:costimulation from CD28,inducible costimulator,CD134,and CD137 in series with signals from the TCR zeta chain[J]. Immunol,2004,172(1):104-113.
[26]Song DG,Ye Q,Poussin M,et al.CD27 costimulation augments the survival and antitumor activity of redirected human T cells in vivo[J].Blood,2012,119(3):696-706.
[27]Burns WR,Zhao Y,Frankel TL,et al.A high molecular weight melanoma-associated antigen-specific chimeric antigen receptor redirects lymphocytes to target human melanomas[J].Cancer Res,2010,70(8):3027-3033.
[28]Zhao Y,Wang QJ,Yang S,et al.A herceptin-based chimeric antigen receptor with modified signaling domains leads to enhanced survival of transduced T lymphocytes and antitumor activity[J].Immunol,2009,183(9):5563-5574.
[29]Carpenito C,Milone MC,Hassan R,et al.Control of large,established tumor xenografts with genetically retargeted human T cells containing CD28 and CD137 domains[J]. Proc Natl Acad Sci USA,2009,106(9):3360-3365.
[30]Morgan RA,Yang JC,Kitano M,et al.Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2[J].Mol Ther,2010,18(4):843-851.
[31]Kalos M,Levine BL,Porter DL,et al.T cells with chimeric antigen receptors have potent antitumor effects and can establish memory in patients with advanced leukemia[J].Sci Transl Med,2011,3(95):95ra73.
[32]Porter DL,Levine BL,Kalos M,et al.Chimeric antigen receptormodified T cells in chronic lymphoid leukemia[J]. N Engl J Med,2011,365(8):725-733.
[33]Brentjens RJ,Davila ML,Riviere I,et al.CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia[J]. Sci Transl Med,2013,5(177):177ra38.
[34]Till BG,Jensen MC,Wang J,et al.CD20-specific adoptive immunotherapy for lymphoma using a chimeric antigen receptor with both CD28 and 4-1BB domains:pilot clinical trial results[J].Blood,2012,119(17):3940-3950.
[35]Brentjens R,Yeh R,Bernal Y,et al.Treatment of chronic lymphocytic leukemia with genetically targeted autologous T cells:case report of an unforeseen adverse event in a phaseⅠ clinical trial[J].Mol Ther,2010,18(4):666-668.
[36]Maus MV,Haas AR,Beatty GL,et al.T cells expressing chimeric antigen receptors can cause anaphylaxis in humans[J].Cancer Immunol Res,2013,1(1):26-31.
[37]June CH,Blazar BR,Riley JL.Engineering lymphocyte subsets:tools,trials and tribulations[J].Nat Rev Immunol,2009,9(10):704-716.
[38]Berqer C,Jensen MC,Lansdorp PM,et al.Adoptive transfer of effector CD8+T cells derived from central memory cells establishes persistent T cell memory in primates[J]. J Clin Invest,2008,118(1):294-305.
[39]Hinrichs CS,Borman ZA,Cassard L,et al.Adoptively transferred effector cells derived from naive rather than central memory CD8+T cells mediate superior antitumor immunity[J].Proc Natl Acad Sci USA,2009,106(41): 17469-17474.
[40]Klebanoff CA,Gattinoni L,Palmer DC,et al.Determinants of successful CD8+T-cell adoptive immunotherapy for large established tumors in mice[J].Clin Cancer Res,2011,17(16):5343-5352.
[41]Gattinoni L,Lugli E,Ji Y,et al.A human memory T cell subset with stem cell-like properties[J].Nat Med,2011,17(10):1290-1297.
[42]Xu Y,Zhang M,Ramos CA,et al.Closely related T-memory stem cells correlate with in vivo expansion of CAR. CD19-T cells and are preserved by IL-7 and IL-15[J]. Blood,2014,123(24):3750-3759.
[43]Gargett T,Brown MP.Different cytokine and stimulation conditions influence the expansion and immune phenotype of third-generation chimeric antigen receptor T cells specific for tumor antigen GD2[J].Cytotherapy,2015,17 (4):487-495.
[44]Imai C,Iwamoto S,Campana D.Genetic modification of primary natural killer cells overcomes inhibitory signals and induces specific killing of leukemic cells[J].Blood,2005,106(1):376-383.
[45]Schmidt-Wolf I,Lefterova P,Mehta BA,et al.Phenotypic characterization and identification of effector cells involved in tumor cell recognition of cytokine-induced killer cells [J].Exp Hematol,1993,21(13):1673-1679.
[46]Bonini C,Ferrari G,Verzeletti S,et al.HSV-TK gene transfer into donor lymphocytes for control of allogeneic graft-versus-leukemia[J].Science,1997,276(5319): 1719-1724.
[47]Casucci M,Bondanza A.Suicide gene therapy to increase the safety of chimeric antigen receptor-redirected T lymphocytes[J].Cancer,2011,2:378-382.
[48]Song DG,Ye Q,Carpenito C,et al.In vivo persistence,tumor localization and antitumor activity of CAR-engineered T cells is enhanced by costimulatory signaling through CD137(4-1BB)[J].Cancer Res,2011,71(13): 4617-4627.
[49]Redmond WL,Ruby CE,Weinberg AD.The role of OX40-mediated co-stimulation in T-cell activation and survival [J].Crit Rev Immunol,2009,29(3):187-201.
[50]Shen CJ,Yang YX,Han EQ,et al.Chimeric antigen receptor containing ICOS signaling domain mediates specific and efficient antitumor effect of T cells against EGFRvⅢexpressing glioma[J].Hematol Oncol,2013,6:33.
[51]Bridgeman JS,Ladell K,Sheard VE,et al.CD3ζ-based chimeric antigen receptors mediate T cell activation via cisand trans-signalling mechanisms:implications for optimization of receptor structure for adoptive cell therapy[J]. Clin Exp Immunol,2014,175(2):258-267.
[52]Frecha C,Lévy C,Cosset FL,et al.Advances in the field of lentivector-based transduction of T and B lymphocytes for gene therapy[J].Mol Ther,2010,18(10):1748-1757.
[53]Gilham DE,Lie-A-Ling M,Taylor N,et al.Cytokine stimulation and the choice of promoter are critical factors for the efficient transduction of mouse T cells with HIV-1 vectors [J].Gene Med,2010,12(2):129-136.
[54]Ivics Z,Hackett PB,Plasterk RH,et al.Molecular reconstruction of Sleeping Beauty,a Tc1 like transposon from fish,and its transposition in human cells[J].Cell,1997,91(4):501-510.
[55]Huang X,Guo H,Tammana S,et al.Gene transfer efficiency and genome-wide integration profiling of Sleeping Beauty,To12,and piggyBac transposons in human primary T cells[J].Mol Ther,2010,18(10):1803-1813.
[56]Yusa K.Seamless genome editing in human pluripotent stem cells using custom endonuclease-based gene targeting and the piggyBac transposon[J].Nat Protoc,2013,8 (10):2061-2078.
[57]Saito S,Nakazawa Y,Sueki A,et al.Anti-leukemic potency of piggyBac-mediated CD19-specific T cells against refractory Philadelphia chromosome-positive acute lymphoblastic leukemia[J].Cytotherapy,2014,16(9):1257-1269.
[58]Birkholz K,Hombach A,Krug C,et al.Transfer of mRNA encoding recombinant immunoreceptors reprograms CD4+and CD8+T cells for use in the adoptive immunotherapy of cancer[J].Gene Ther,2009,16(5):596-604.
[59]Zhao Y,Moon E,Carpenito C,et al.Multiple injections of electroporated autologous T cells expressing a chimeric antigen receptor mediate regression of human disseminated tumor[J].Cancer Res,2010,70(22):9053-9061.
[60]Barrett DM,Zhao Y,Liu X,et al.Treatment of advanced leukemia in mice with mRNA engineered T cells[J].Hum Gene Ther,2011,22(12):1575-1586.
[61]Chen ZY,He CY,Meuse L,et al.Silencing of episomal transgene expression by plasmid bacterial DNA elements in vivo[J].Gene Ther,2004,11(10):856-864.
[62]Maier DA,Brennan AL,Jiang S,et al.Efficient clinical scale gene modification via zinc finger nuclease-targeted disruption of the HIV co-receptor CCR5[J].Hum Gene Ther,2013,24(3):245-258.
[63]Duong CP,Westwood JA,Berry LJ,et al.Enhancing the specificity of T-cell cultures for adoptive immunotherapy of cancer[J].Immunotherapy,2011,3(1):33-48.
[64]Kloss CC,Condomines M,Cartellieri M,et al.Combinatorial antigen recognition with balanced signaling promotes selective tumor eradication by engineered T cells[J].Nat Biotechnol,2013,31(1):71-75.
[65]Gheybi E,Amani J,Salmanian AH,et al.Designing a recombinant chimeric construct contain MUC1 and HER2 extracellular domain for prediagnostic breast cancer[J]. Tumour Biol,2014,35(11):11489-11497.
[66]Tamada K,Geng D,Sakoda Y,et al.Redirecting genemodified T cells toward various cancer types using tagged antibodies[J].Clin Cancer Res,2012,18(23):6436-6445.
[67]Urbanska K,Lanitis E,Poussin M,et al.A universal strategy for adoptive immunotherapy of cancer through use of a novel T-cell antigen receptor[J].Cancer Res,2012,72 (7):1844-1852.
[68]Kudo K,Imai C,Lorenzini P,et al.T lymphocytes expressing a CD16 signaling receptor exert antibody-dependent cancer cell killing[J].Cancer Res,2014,74(1):93-103.
[69]Stephan MT,Ponomarev V,Brentjens RJ,et al.T cell-encoded CD80 and 4-1BBL induce auto-and transcostimulation,resulting in potent tumor rejection[J].Nat Med,2007,13(12):1440-1449.
[70]Ascierto PA,Addeo R,Cartenì G,et al.The role of immunotherapy in solid tumors:report from the Campania Society of Oncology Immunotherapy(SCITO)meeting,Naples 2014[J].J Transl Med,2014,12(1):291.
Advances in cancer immunotherapy based on chimeric antigen receptor
LI Ling,MA Jianbo
[Zhongzhengdaohe(Beijing)Bio-Technology Co.,Beijing 100176,China]
Recently,application of chimeric antigen receptor(CAR)modified T cells in the treatment of lymphoma,leukemia,brain glioma,melanoma,lung cancer,prostate cancer,pancreatic cancer and ovarian cancer has made very exciting progress.CAR is a kind of genetically engineered receptor,the common form of these molecules consists of extracellular antigen recognition region,spacer,transmembrane domain(TM)and intracellular endodomain,the antigen recognition region generally is single-chain variable fragments(scFv)derived from monoclonal antibodies which can recognize target antigen without MHC restriction,and the intracellular endodomain generally is comprised of CD3 zeta and co-stimulating molecules.This kind of unique design and strong antitumor effect make the CAR-T more and more widely used.In this review,we highlight recent advances of CAR-T in clinical applications,discovered problems and possible solving strategies in cancer therapy.
Chimeric antigen receptor(CAR);T cell;Tumor;Immunotherapy
R730.51
A
2095-3097(2015)02-0097-08
10.3969/j.issn.2095-3097.2015.02.010
2014-12-02 本文编辑:冯 博)
100176北京,中政道和(北京)生物科技有限公司(李玲,马建波)
马建波,E-mail:majianbo@gmail.com
