微小 RNA-383 对骨肉瘤细胞生物学特性的影响
2015-11-30李帅郜勇王琨刘伟宋雨杨述华杨操
李帅 郜勇 王琨 刘伟 宋雨 杨述华 杨操
微小 RNA-383 对骨肉瘤细胞生物学特性的影响
李帅 郜勇 王琨 刘伟 宋雨 杨述华 杨操
金资助项目:国家自然科学基金 ( 81072187 )
目的 观察微小 RNA ( miR ) -383 对骨肉瘤细胞生物学特性的影响。方法 脂质体转染骨肉瘤细胞 ( U-2OS ),检测对细胞凋亡、增殖的影响,并检测细胞迁移侵袭能力、克隆形成能力的改变。结果细胞凋亡情况:空白对照组、无义序列组和实验组细胞的凋亡率分别为 ( 8.56±1.45 ) %、( 12.6l±1.37 ) %、( 33.20±2.59 ) %,差异有统计学意义 ( P<0.05 );细胞迁移实验:空白对照组、无义序列组和实验组分别为( 82±5 ) 个、( 68±3 ) 个和 ( 45±7 ) 个,差异有统计学意义 ( P<0.05 );细胞迁移与侵袭实验:空白对照组、无义序列组和实验组细胞穿膜数分别为 ( 82±5 ) 个、( 68±3 ) 个和 ( 45±7 ) 个,以及 ( 35±9 ) 个、( 32±4 ) 个和 ( 13±5 ) 个,差异有统计学意义 ( P<0.05 );克隆形成实验:空白对照组、无义序列组和实验组克隆数分别为 ( 12.7±4.1 ) 个、( 12.3±3.6 ) 个和 ( 6.4±2.7 ) 个。结论 抑制 miR-383 使骨肉瘤细胞凋亡增加,使细胞增殖、侵袭与迁移及克隆形成受到抑制。
骨肉瘤;细胞凋亡;基因表达调控;RNA,肿瘤;微小 RNA-383
骨肉瘤是青少年最常见的恶性肿瘤,其标准治疗是外科手术结合新辅助化疗,但仍有 30% 患者出现肿瘤复发、恶化,其治疗一直是骨科界亟待解决的难题之一[1]。随着分子靶向治疗的出现和发展,人们开始寻找针对骨肉瘤的分子靶点[2]。
越来越多研究结果提示,表观遗传的改变在骨肉瘤的发病过程中起重要作用,特别是在间充质干细胞向成骨细胞分化过程中起重要作用[3]。miRNAs对细胞、组织的正常增殖、分化调控有重要作用[4]。研究发现 miRNAs 的异常表达与多种肿瘤发生发展密切相关,如乳腺癌、淋巴癌、 直肠癌、肺癌、骨肉瘤等[5]。miRNA 作为癌基因或者抑癌基因发挥作用,主要由其调控编码的靶基因决定,但其在骨肉瘤发生发展中的作用机制尚不清楚[6]。
前期通过收集四种人骨肉瘤细胞系 ( MG63、U2OS、MNNG / HOS 和 Saos-2 ) 和人成骨细胞系( hFOB ),应用 miRNA 表达谱芯片进行扫描筛查,建立了骨肉瘤细胞系的 miRNA 表达谱。本研究选取在骨肉瘤细胞系中呈差异性表达的微小 RNA ( miR ) -383 作为研究对象,对骨肉瘤细胞转染 miR-383,观察骨肉瘤细胞凋亡、增殖、迁移以及侵袭等生物学行为受到的影响,探讨 miR-383 在骨肉瘤中的调控作用及其相应机制。
材料与方法
一、材料
骨肉瘤细胞株 MG63、U2OS、MNNG / HOS 和Saos-2 及成骨细胞 hFOB 1.19 购自中国典型培养物保藏中心,胎牛血清、RPMI 1640 培养基、DMEM / F12、胰蛋白酶购自美国 Gibco 公司。TaqMan MicroRNA 检测试剂盒购自美国 Ambion 公司;Lipofectamine 2000、RNA 提取试剂 Trizol 购自美国Invitrogen 公司;miR-383 及无义序列寡核苷酸由广州市锐博生物科技有限公司合成;Transwell 细胞培养小室购自美国 Corning 公司;细胞凋亡试剂盒购自南京凯基生物。
二、细胞培养
U2OS、MG-63、MNNG / HOS 骨肉瘤细胞用含 10% 胎牛血清、100 U / ml 青霉素、0.1 g / L 链霉素的 RPMI 1640 培养基培养,hFOB 1.19 细胞用含10% 胎牛血清、100 U / ml 青霉素、0.1 g / L 链霉素的 DMEM / F12 培养基培养,Saos-2 用 1 g / L 链霉素的 DMEM 培养。细胞置于 37 ℃、5% CO2培养箱中,每 3 天传代 1 次,用含 0.25% 胰蛋白酶 ( 其内含 0.01% EDTA ) 消化,以 1∶3 传代。
三、反义 miR-383 转染
取处于对数生长期的 U2OS 骨肉瘤细胞,细胞生长至 70%~80% 融合时,经胰酶消化后,用RPMI 1640 培养液重新悬浮后,对细胞进行计数,按 1×104个 / 孔铺入 96 孔培养板中。将其分为3 组:( A ) 空白对照组:仅用空白的 Lipofectamine 2000 脂质体进行处理;( B ) 无义序列组:加入无义序列和 Lipofectamine 2000 脂质体复合物,无义序列为:5'-AGCUCACAGUCACCUCUGAUCU-3';( C ) 实验组:加入反义 miR-383 / Lipofectamine 2000 脂质体复合物,“反义 miR-383 序列为5'-AGCCACAGUCACCUUCUGAUCU',进行基因转染。在 37 ℃、5% CO2培养箱中培养 12 h 后,用RPMI 1640 培养液代替转染时的培养液。
四、RNA 提取和实时荧光定量 PCR ( qRT-PCR )检测各组细胞的 miR-383 表达量
按照 RNA 提取试剂盒的操作步骤,提取细胞总 RNA,分析鉴定其浓度和纯度后,按照 TaqMan MicroRNA 检测试剂盒的操作步骤及要求,在罗氏LightCycler®480 实时荧光定量 PCR 系统下进行实时荧光定量 PCR 操作,反应条件为:95 ℃ 下 20 s 预变性,95 ℃ 10 s,60 ℃ 20 s,70 ℃ 10 s,40 个循环,所有反应设立 3 个复孔。
五、流式细胞仪及 Caspase 3 活性检测骨肉瘤细胞凋亡
常规消化收集 3 组处于对数生长期的细胞,用0.25% 的胰酶消化,制备 1 ml 单细胞悬液,调整待测细胞浓度,浓度为 5×105~1×106个 / ml,离心收集细胞,PBS 洗涤 3 次后,按南京凯基生物有限公司膜联蛋白 V- 异硫氰酸荧光素 ( AnneXin V-FITC ) 细胞凋亡试剂盒说明书,将细胞重悬于 500 μl 的结合缓冲液中,加入 5 μl Annexin V-FITC 和 5 μl 的 PI,轻轻混匀,避光室温反应 15 min,1 h 内流式细胞仪检测细胞凋亡。实验重复 6 次,以百分数表示凋亡率。Caspase 3 活性检测:按 Roche 公司 Caspase 3 Activity Assay 检测试剂盒进行。
六、 MTT 法检测细胞增殖
分别收集 A、B、C 组细胞,以每孔 200 μl 细胞悬液接种于 96 孔板 ( 细胞量约为 4000 个 / 孔 ),每组接种 6 孔,置于 37 ℃、5% CO2的条件下培养,分别于 12、24、36、48、72 h 后加入 20 μl的 MTT 溶液 ( 5 g / L ),于培养箱内培养 4 h,吸去上清,每孔加二甲基亚砜 ( DMSO ) 150 ml,振荡10 min 待结晶溶化后,于酶标仪 ( 490 nm 波长 ) 上读取处吸光度 ( A ) 值。
七、骨肉瘤细胞迁移实验与侵袭实验
按 Coring 公司的产品说明书,将无 Matrigel 包被的 Transwell 小室于 24 孔培养板中培养。将 3 组细胞用 10 g / L 的牛血清白蛋白 ( BSA ) 进行重悬后,于 Transwell 小室上室每孔加 600 μl 细胞悬液,下室加 600 μl 含 10% FBS 的培养基,每组设置 3 个复孔,于 37 ℃,5% CO2培养 12 h。每孔随机选取5 个视野计算细胞数,实验重复 3 次。
Matrigel 用 RPMI 1640 培养基以 1∶4 稀释,每室加 50 μl,覆盖膜上所有微孔。用含 1.5% 胎牛血清的 RPMI 1640 培养基液调整细胞浓度为 5×108/ L,加 200 μl 于侵袭小室。置于 24 孔板,下室内加含10% 胎牛血清的 RPMI 1640 培养基,培养 24 h。用棉签擦尽上室基底胶及残余细胞,甲醇固定、结晶紫染色计数,每孔随机选取 5 个高倍镜视野 ( ×400 )计数,实验至少重复 3 次。
八、克隆形成实验
实验分为 3 组,每组接种细胞数 1×103个于4 g / L 的琼脂糖凝胶培养基中培养,每 5 天换液1 次,接种后 3 周在显微镜下计数细胞数>50 个的克隆数,实验重复 3 次。
九、Western blot 实验
用裂解液裂解细胞后,提取细胞总蛋白,按照western-blot 标准流程操作,简单总结为:按湿法将电泳产物转 PVDF 膜,5% 脱脂奶粉 4 度 2 h,一抗 4 度孵育过夜,TTBS 洗膜 10 min×3 次,TBS 洗膜 10 min,二抗常温孵育 2 h,TTBS 洗膜 10 min× 4 次,TBS 洗膜 10 min,ECL 发光液发光、压片、显影、定影。
十、统计学方法
应用 SPSS 14.5 统计软件分析,采用两独立样本非参数检验。数据均以±s 表示。
结 果
一、骨肉瘤 miR-383 表达情况与转染后骨肉瘤细胞 miR-383 表达量
应用 qRT-PCR 检测 miR-383 表达情况,与成骨细胞 hFOB 1.19 相比,骨肉瘤细胞 MG-63、 Saos-2、U2OS 和 HOS 的 miR-383 表达显著增加,相对表达量分别为 1.004±0.075、1.479±0.087、1.366±0.112、1.716±0.092、1.683±0.124 ( 图 1a )。miR-383 在 3 组 U2OS 细胞的相对表达量为:空白对照组为 1.727±0.039,无义序列组为 1.655±0.051,实验组为 0.973±0.046 ( 图 1b )。
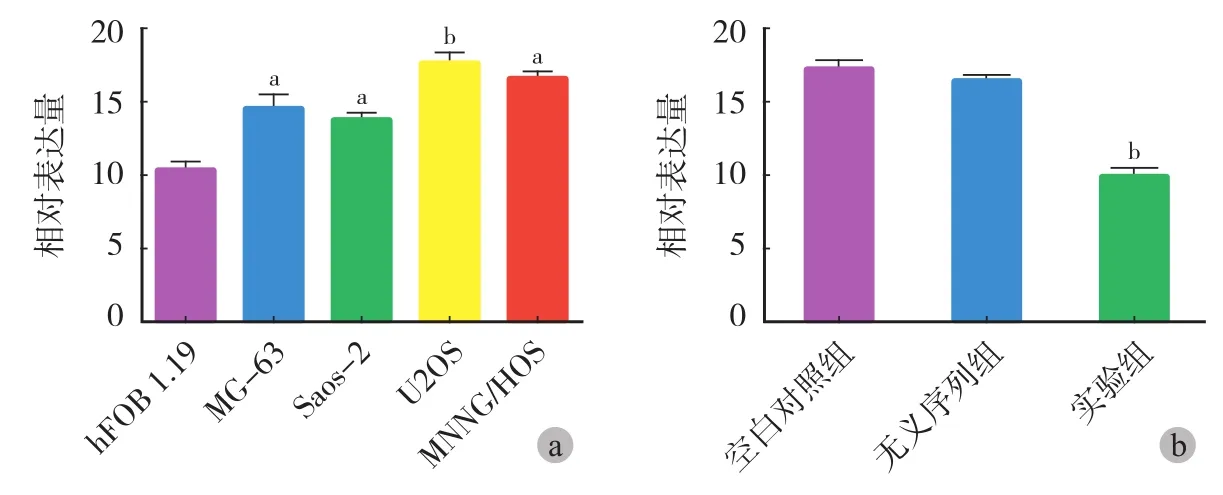
图 1 miR-383 表达情况 a:骨肉瘤细胞系 miR-383 的相对表达情况,其中在 U2OS 骨肉瘤细胞中表达水平最高;b:miR-383 转染 U2OS 后,实验组miR-383 表达水平明显减少 (aP < 0.05,bP < 0.01 )Fig.1 miR-383 expression a: miR-383 was increased in four OS cell lines compared with that in human osteoblast cell line, with highest expression in U2OS; b: miR-383 expression was decreased after transfecting with anti-miR-383 (aP<0.05,bP<0.01 )
二、骨肉瘤细胞凋亡与增殖检测
收集 3 组细胞按凋亡试剂盒说明书操作检测,空白对照组、无义序列组和反义 miR-383 组细胞的凋亡率分别为 ( 8.56±1.45 ) %、( 12.6l±1.37 ) %、( 33.20±2.59 ) %,转染 miR-383 反义寡核苷酸链组较空白对照组、无义序列组细胞凋亡率明显升高,差异有统计学意义 ( P<0.01 )。应用 MTT 法检测细胞:反义 miR-383 转染的骨肉瘤细胞组生长速度较空白对照组、无义序列组明显降低,差异有统计学意义 ( P<0.05 ),细胞生长曲线见图 2。

图 2 骨肉瘤细胞凋亡与增殖情况,实验组细胞凋亡比例较其它两组明显增加,细胞增殖明显受到抑制 (aP < 0.05,bP < 0.01 )Fig.2 Apoptosis and proliferation in osteosarcoma cells, apoptotic rate in anti-miR-383 group was higher than the other two groups and proliferation was suppressed in anti-miR-383 group (aP<0.05,bP<0.01 )
三、骨肉瘤细胞迁移与侵袭实验
3 组细胞均能够移行进入下室。空白对照组、无义序列组和实验组 miR-383 组细胞分别为 ( 82± 5 ) 个、( 68±3 ) 个和 ( 45±7 ) 个,组间差异有统计学意义 ( P<0.05 )。骨肉瘤细胞侵袭实验:3 组细胞均可穿过铺有 Matrigel 的滤膜,空白对照组、无义序列组和实验组 miR-383 组细胞穿膜细胞数分别为( 35±9 ) 个、( 32±4 ) 个和 ( 13±5 ) 个,差异有统计学意义 ( P<0.05 ) ( 图 3a、b ) 。
四、miR-383 抑制细胞克隆形成能力
空白对照组、无义序列组和实验组 miR-383 组细胞均可见细胞克隆球出现,3 组细胞的每高倍视野形成细胞数>50 的克隆数分别为 ( 12.7±4.1 ) 个、( 12.3±3.6 ) 个和 ( 6.4±2.7 );实验组 miR-383 组形成克隆球数量少,体积小,差异有统计学意义 ( P<0.05 ) ( 图 3c )。

图 3 实验组细胞迁移能力较其它两组明显减少,细胞侵袭能力明显受到抑制,细胞克隆形成明显减少 (aP < 0.05 )Fig.3 Transfection of anti-miR-383 significantly suppressed U2OS cell migration, invasion and clony formation (aP<0.05 )
五、miR-383 靶向调控 perp 及 Caspase 3 活性测定
与空白对照组、无义序列组相比实验组,Caspase 3 活性显著增加差异有统计学意义( P<0.05 )。通过查询 Target Scan Human 6.2 及 microrna.org,对比后明确 miR-383 靶向调控 perp。骨肉瘤细胞中miR-383 高水平表达,结合于 3'-UTR,抑制 perp 表达。反义转染 miR-383 后抑制其表达,上调 perp 表达,骨肉瘤细胞增殖减少、凋亡增加,无义序列组及对照组的 perp 表达水平无明显改变 ( 图 4 ),差异有统计学意义 ( P<0.05 )。
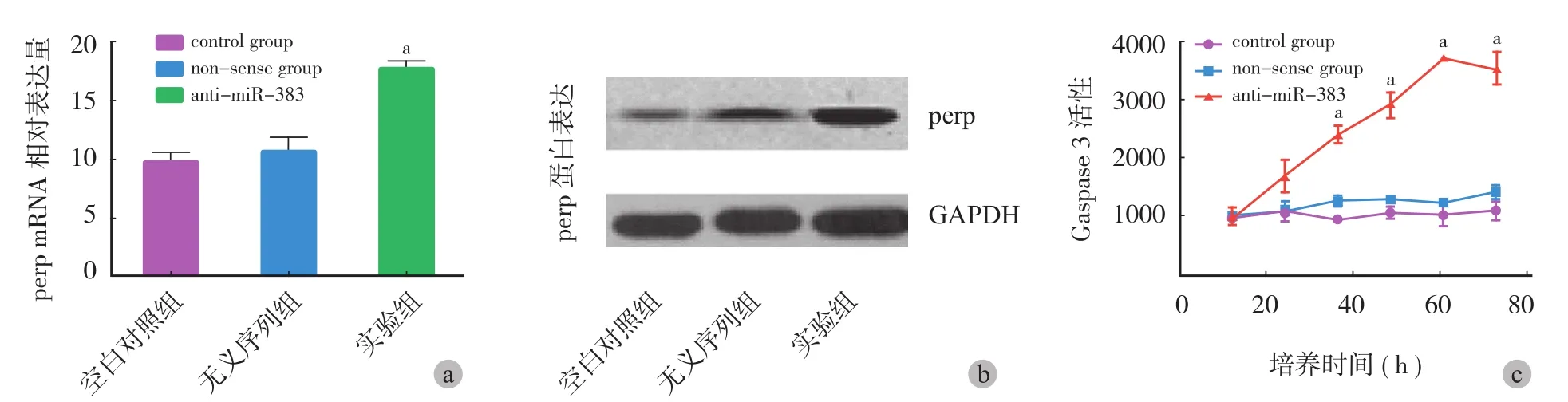
图 4 骨肉瘤 perp 表达情况及 Caspase 3 活性测定,实验组细胞 perp 的 mRNA 和蛋白表达较其它两组明显增加,实验组 Caspase 3 活性明显增加 (aP < 0.05 )Fig.4 Detection of perp and caspase 3 activity, the expressions of perp mRNA and protein were increased in anti-miR-383 group compared with other two groups and Caspase 3 activity was increased significantly (aP<0.05 )
讨 论
miRNAs 是一类内源性的调节小 RNA,其长度为 22 个核苷酸,由外显子 miRNA 及内含子 miRNA组成,经 2 次酶切后产生成熟的 miRNA。miRNA 互补结合靶 mRNA 的 3' 端非翻译区 ( UTR ) 部分,对人 30% 的基因有调控作用,主要是调控靶 mRNA 转录后的表达[7]。目前已发现多种肿瘤的 miRNA 表达异常,如横纹肌肉瘤中 miR-26a、miR-29、miR-133b、miR-203、miR-214 表达显著减少,肺癌中的miR-200、miR-21、miR-135b 表达明显增加等。学者在骨肉瘤细胞中也发现类似情况,miR-33、miR-140、miR-215、miR-142-3p,miR-223 及 miR-451在骨肉瘤表达显著增加,而 miR-126,miR-142-5p及 miR-195 表达明显减少[8]。
目前 miR-383 在骨肉瘤中的作用机制还不清楚,目前 miR-383 的研究主要集中在喉鳞状细胞癌、髓母细胞瘤、胶质瘤、睾丸胚胎癌及糖尿病等,但其在肿瘤侵袭、转移及抗凋亡中的具体作用机制,目前还不明确[9]。有研究表明 miR-383 可能通过作用于 E2F1 对细胞周期产生影响,同时作用于PRDX3、IGF1R 和 FMRP,进而促进肿瘤生长[10-11]。本研究结果表明,与成骨细胞相比,骨肉瘤细胞的miR-383 表达水平明显增加。miR-383 的靶基因为perp,perp 属于 PMP-22 / gas3 家族,是受 p53 / p63调控的靶基因,进而对细胞凋亡产生影响,其具有抑制肿瘤、促凋亡作用[12]。骨肉瘤中 miR-383 高水平表达,改变 miR-383 的表达可以调控 perp 的表达,因此提示 miR-383 通过调控 perp 表达进而对骨肉瘤的增殖与凋亡中发挥一定的作用。有学者报道,perp 表达受抑是鳞状细胞癌发生的重要事件,而且其表达受抑提示复发几率增加、高度恶性[13]。而且学者发现肿瘤组织的 perp 表达水平与患者的预后有明确关联性,可以作用判断预后的指标[14]。沉默 miR-383 后,perp 表达增加,同时骨肉瘤细胞凋亡明显增加、增殖明显受到抑制,同时转染后的骨肉瘤细胞迁移与侵袭的速度明显减慢,克隆数明显减少,骨肉瘤的肿瘤生物学特性受到抑制。
本研究结果表明 miR-383 的过表达与骨肉瘤细胞的存活、增殖及侵袭与转移密切相关,沉默 miR-383,通过调控 perp 的表达,可促进骨肉瘤细胞的凋亡、减少骨肉瘤细胞的增殖,减少骨肉瘤细胞的克隆形成,同时可减少骨肉瘤细胞的迁移与侵袭,是骨肉瘤未来靶向治疗的一个新靶点,为骨肉瘤治疗提供新的方法与途径。
[1] Brasme JF, Morfouace M, Grill J, et al. Delays in diagnosis of paediatric cancers: a systematic review and comparison with expert testimony inlawsuits. Lancet Oncol, 2012, 13(10): e445-459.
[2] Collard TJ, Urban BC, Patsos HA, et al. The retinoblastoma protein (Rb) as an anti-apoptotic factor: expression of Rb is required for the anti-apoptotic function of BAG-1 protein in colorectal tumour cells. Cell Death Dis, 2012, 3:e408.
[3] Baglìo SR, Devescovi V, Granchi D, et al. MicroRNA expression profiling of human bone marrow mesenchymal stem cells during osteogenicdifferentiation reveals Osterix regulation by miR-31. Gene, 2013, 527(1):321-331.
[4] Boehm M, Slack FJ. MicroRNA control of lifespan and metabolism. Cell Cycle, 2006, 5(8):837-840.
[5] Garzon R, Calin GA, Croce CM. MicroRNAs in Cancer. Annu Rev Med, 2009, 60:167-179.
[6] Namløs HM, Meza-Zepeda LA, Barøy T, et al. Modulation of the osteosarcoma expression phenotype by microRNAs. PLoS One, 2012, 7(10):e48086.
[7] Ramachandran V, Chen X. Degradation of microRNAs by a family of exoribonucleases in Arabidopsis. Science, 2008, 12, 321(5895):1490-1492.
[8] Ding S, Liang Y, Zhao M, et al. Decreased microRNA-142-3p/5p expression causes CD4+ T cell activation and B cell hyperstimulation in systemic lupus erythematosus. Arthritis Rheum, 2012, 64(9):2953-2963.
[9] Yin M, Wang X, Yao G, et al. Transactivation of miR-320 by miR-383 regulates granulosa cell functions by targeting E2F1 and SF-1*. J Biol Chem, 2014, 27, 289(26):18239-18257.
[10] Huang H, Tian H, Duan Z, et al. microRNA-383 impairs phosphorylation of H2AX by targeting PNUTS and inducing cell cycle arrest in testicular embryonal carcinoma cells. Cell Signal, 2014, 26(5):903-911.
[11] He Z, Cen D, Luo X, et al. Downregulation of miR-383 promotes glioma cell invasion by targeting insulin-like growth factor 1 receptor. Med Oncol, 2013, 30(2):557.
[12] Singaravelu K, Devalaraja-Narashimha K, Lastovica B, et al. PERP, a p53 proapoptotic target, mediates apoptotic cell death in renal ischemia. Am J Physiol Renal Physiol, 2009, 296(4):F847-F858.
[13] Proestling K, Hebar A, Pruckner N, et al. The Pro allele of the p53 codon 72 polymorphism is associated with decreased intratumoral expression of BAX and p21, and increased breast cancer risk. PLoS One, 2012, 7(10):e47325.
[14] Kong CS, Cao H, Kwok S, et al. Loss of the p53/p63 target PERP is an early event in oral carcinogenesis and correlates with higher rateof local relapse. Oral Surg Oral Med Oral Pathol Oral Radiol, 2013, 115(1):95-103.
( 本文编辑:李贵存 )
Effects of microRNA-383 on biological behaviors of osteosarcom
LI Shuai, GAO Yong, WANG Kun, LIU Wei, SONG Yu, YANG Shu-hua, YANG Cao.
Department of Orthopaedics, Xiehe Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan, Hubei, 430022, PRC Corresponding author: YANG Cao, Email: yangcaom@gmail.com
Objective To investigate effects of miRNA-383 on biological behaviors of osteosarcoma. Methods MiR-383 plasmid vectors were constructed and transfected into osteosarcoma cells. Flow cytometer was used to calculate the apoptotic rate. MTT Cell Proliferation Assay measured the cell proliferation rate. An analysis of cell migration and invasion was performed by Transwell Cell Migration / Invasion Matrigel Assay. Analysis of cell clonogenic ability was performed by Colony formation Assay. Results Apoptotic rate of control group, nonsense group and anti-miR-383 group: ( 8.56±1.45 ) %, ( 12.6l±1.37 ) %, ( 33.20±2.59 ) % with statistical significance ( P<0.05 ). Migration test of control group, non-sense group and anti-miR-383 group: ( 82±5 ), ( 68±3 ) and ( 45±7 ) with statistical significance ( P<0.05 ). Migration and invasion test of control group, non-sense group and anti-miR-383 group: ( 82±5 ), ( 68±3 ) and ( 45±7 ) compared with ( 35±9 ), ( 32±4 ) and ( 13±5 ) respectively, with statistical significance ( P<0.05 ). The clonogenic units of 3 groups: ( 12.7±4.1 ), ( 12.3±3.6 ) and ( 6.4±2.7 ). Conclusions MiR-383 can promote osteosarcoma cells' apoptosis, and restrain proliferation, migration and invasion, and the colony formation.
Osteosarcoma; Apoptosis; Gene expression regulation; RNA, neoplasm; MicroRNA-383
10.3969/j.issn.2095-252X.2015.09.011
R738.1
430022 武汉,华中科技大学同济医学院附属协和医院骨科
杨操,Email: yangcaom@gmail.com
2014-10-28 )
