一种丙肝病毒滴度测定方法
2015-11-29李亚东李智华毕研伟陈晨寸韡
李亚东,李智华,毕研伟,陈晨,寸韡
1.中国医学科学院&北京协和医学院 医学生物学研究所,云南 昆明 650118;2.云南省重大传染病疫苗研发重点实验室,云南 昆明 650118
1989年Choo等[1]通过克隆方法鉴定了丙肝病毒(hepatitis C virus,HCV)基因组,加速了HCV 研究进程;2005 年,HCV 2a 型JFH1 分离株在少数细胞系内获得体外培养[2-3]。病毒研究过程中常须对其滴度进行测定,但HCV 感染细胞后产生的细胞病变效应(CPE)不明显,这为HCV 滴度测定带来了一定难度。2005 年,免疫荧光法(IFA)被用于HCV 滴度的测定[4],至今仍是测定HCV 滴度的主要方法。由于塑料细胞培养板在荧光显微镜下会产生衍射,干扰实验结果,而玻璃细胞培养板较为昂贵,因此一般都采用细胞爬片进行IFA 实验,但取出细胞爬片时易导致部分被感染的细胞损失,影响实验结果的精确性。另一方面,由于显微镜下一个视野不能观察到整块细胞爬片,因此计数误差较大。该方法也难以避免病毒二次感染的产生,造成实验结果的不精确。
2009 年,免疫组化技术(IHC)被用于HCV 滴度的测定,该方法无须制备细胞爬片,可直接在96 孔细胞培养板内感染并进行后续免疫组化实验,统计96 孔板中被感染孔计算TCID50,得到HCV 滴度[5]。这相比IFA 测定滴度方法更加精确,但成本依然相对较高。我们对IHC 技术测定HCV 滴度的方法加以改进,建立了一种更加简便、经济、安全的测定HCV 滴度的方法,为HCV 的基础研究及临床药物评估提供有效手段。
1 材料与方法
1.1 材料
Huh7 细胞购于中国科学院动物研究所;HCV JFH1 病毒株为本实验室保存;DMEM 培养基、非必需氨基酸购于Hyclone 公司;胎牛血清(FBS)购于Gibco 公司;抗HCV 核心蛋白单克隆抗体购于Viro-Stat 公司;羊抗鼠二抗-HRP 购于Thermo Pierce 公司;ImmPress羊抗鼠二抗-HRP及ImmPACT DAB 显色试剂购于Vector 公司;琼脂糖购于Invitrogen 公司;甲基纤维素购于Sigma 公司;96 孔板购于Costar公司。
1.2 病毒感染
Huh7 细胞按8×103/孔于96 孔板中采用含10%FBS 的DMEM 完全培 养基培 养16 h,取10 μL HCV,用DMEM 完全培养基按1/10 梯度稀释为10-1~10-5,吸弃96 孔板中的培养基,将病毒稀释液按50 μL/孔轻轻加入96孔板,每个稀释度设定3个复孔以验证此方法的可重复性,摇匀后置于37℃、5% CO2培养箱中进行感染,每隔1 h轻轻摇晃96孔板,使病毒均匀感染细胞,10 h 后吸弃病毒稀释液,按100 μL/孔加入甲基纤维素-DMEM(含2%FBS)半固体培养基,于37℃、5% CO2培养箱中培养4 d。
1.3 HCV滴度测定
感染HCV 的Huh7细胞培养4 d后,轻轻吸弃甲基纤维素-DMEM 培养基,每孔加入100 μL 于-20℃预冷的甲醇,-20℃固定10 min,吸弃甲醇,PBS 轻洗2次,用100 μL含3% H2O2的PBS室温处理5 min[5];PBS洗2次,加入50 μL含1% BSA和0.2%脱脂奶粉的PBS,4℃封闭过夜;吸弃封闭液,每孔加入30 μL用PBST(含0.5‰吐温-20的PBS)以1∶500稀释的抗HCV 核心蛋白单克隆抗体,室温轻轻摇动1 h;吸弃一抗,PBS 洗2 次,PBST 洗1 次;每孔加入30 μL 用PBST以1∶1稀释的辣根过氧化物酶(HRP)标记的羊抗鼠聚合二抗,室温轻轻摇动30 min;吸弃二抗,PBS 洗2 次,PBST 洗1 次;每孔加入50 μL 新鲜配制的DAB显色试剂,室温作用1~10 min至看到棕色病毒斑;吸弃DAB 染液,PBS 洗2 次,加100 μL PBS,在低倍倒置显微镜下观察感染病毒的细胞斑块并计数。
2 结果
2.1 聚合二抗联合DAB 能够使被HCV 感染的细胞清晰显色
目前测定HCV 滴度的主要方法是IFA 法,鉴于IFA 法测定HCV 滴度存在的一些不足,我们拟通过免疫组化技术在96 孔板内使被感染细胞显色,减少IFA 法制备细胞爬片过程中造成的细胞损失,在一定程度上提高结果的准确性。
为了能够完好地保存细胞内病毒的抗原性进行免疫组化实验,需要对细胞进行固定。常用的固定剂有95%酒精、4%多聚甲醛、10%福尔马林溶液、0.5%戊二醛、冷丙酮、冷甲醇等[6]。本实验比较了冷甲醇、4%多聚甲醛、10%福尔马林溶液3种常用的固定剂,均能起到很好的固定效果(图1)。由于冷甲醇相对较易获得,固定细胞的同时能够灭活病毒,对人体的危害相对较小,因此本研究后续试验采用甲醇进行细胞固定。
固定后的细胞保持了蛋白的抗原性,可以进行后续免疫组化实验。然而,我们采用常规免疫组化技术进行后续操作,即封闭后用抗HCV 核心蛋白单克隆抗体进行孵育,利用辣根过氧化物酶(HRP)标记的羊抗鼠二抗识别鼠源一抗并采用DAB 显色时,未观察到细胞显色;换用了HRP 标记的羊抗鼠聚合二抗及DAB 显色试剂,结果能观察到明显的棕色病毒感染斑(图1)。
2.2 采用0.8%~1%的甲基纤维素能够限制病毒在胞间感染形成肉眼可见斑块
测定HCV 滴度时,细胞被病毒感染会形成二次感染,通过免疫组化技术将被感染细胞显色,通过TCID50方法可计算病毒滴度,但较浪费抗体,成本较高。因此,我们拟采用噬斑法计数病毒滴度。病毒感染细胞后,通过在细胞表面添加覆盖物,可以限制病毒在细胞间感染。常用于病毒滴度测定的覆盖物为琼脂糖,但HCV 感染细胞不能形成可见的噬斑,因此在病毒感染细胞后,需要将覆盖物移除以便于后续进行免疫组化实验,而琼脂糖覆盖后凝固成块状,不易除去,因此需要选用一种既不完全凝固又能在病毒颗粒中自由流动的覆盖物。甲基纤维素呈半固体状,对细胞无毒害,易吸除,且不会同时吸走细胞,可以作为被实验的覆盖物。我们选用粘度为4000 cP 的甲基纤维素进行实验,比较了0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.5%、2%共8 个不同终浓度的甲基纤维素进行覆盖,综合考虑其对病毒自由流动的限制以及移除的难易,发现终浓度为0.8%~1.0%的甲基纤维素既容易移除同时也能很好地限制病毒于细胞间感染,形成明显斑块(图2)。
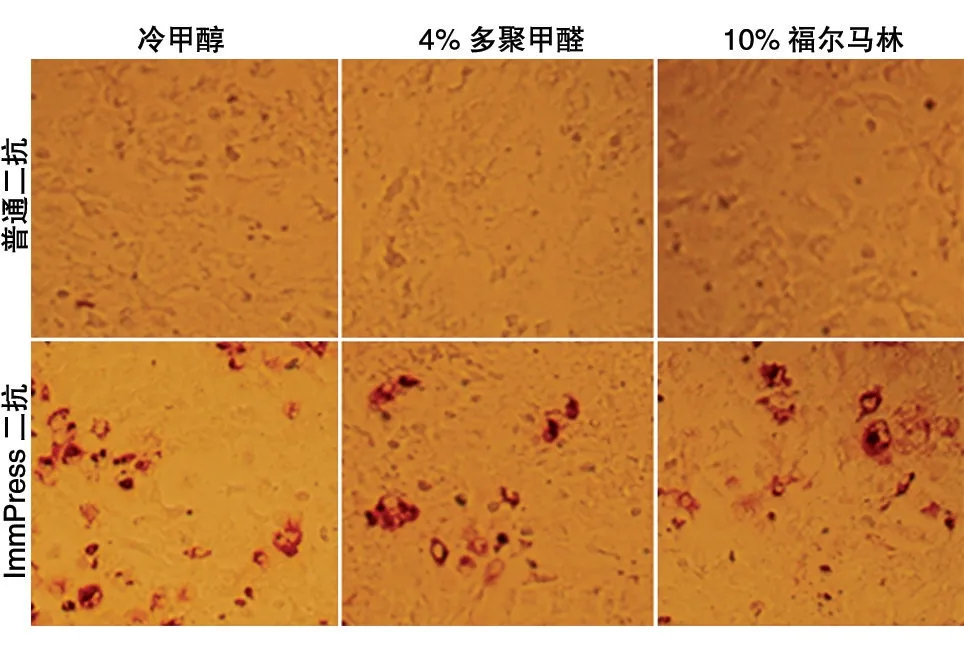
图1 不同固定液及酶标二抗使被感染细胞显色结果
2.3 建立的滴度测定方法具有可重复性
为了验证所建立的滴度测定方法的稳定性与可重复性,测滴度时样品设立3 个复孔,低倍显微镜下对感染斑计数。为了提高计数的准确性,将96 孔板每个孔呈“十”字划线,-3 稀释度的感染斑分布较均匀,感染斑个数为30±5(3 个复孔感染斑个数分别为32、26、35),各复孔之间感染斑个数无显著性差异,说明该滴度测定方法具有稳定性和可重复性(图3)。以此稀释度计算,此批HCV 的滴度为6.2×105FFU/mL。
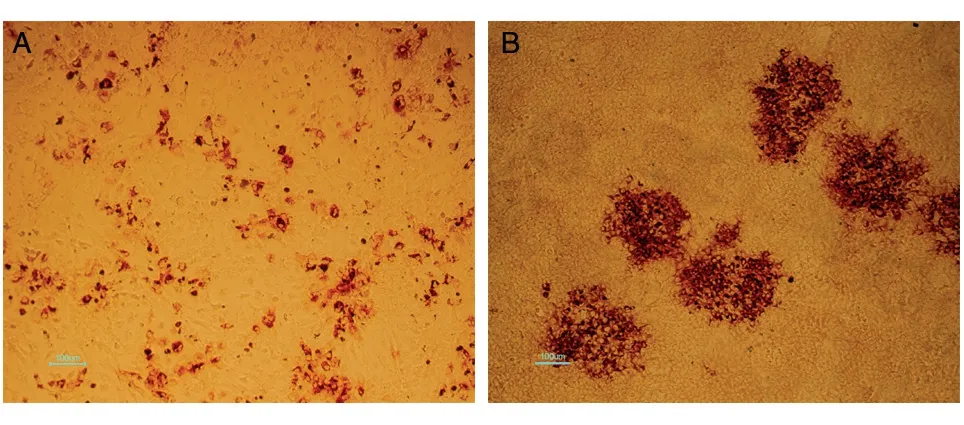
图2 显微镜下HCV形成的感染斑
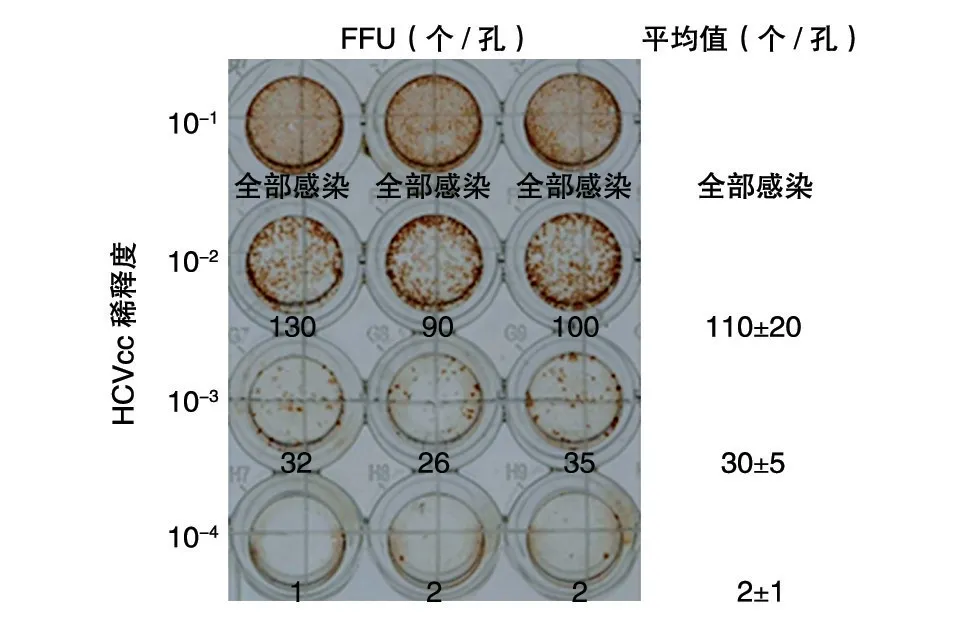
图3 96孔板HCV滴度计算
3 讨论
HCV 实现体外培养后,免疫学技术被运用到HCV 滴度测定中,发展出IFA 测定方法[4,7-8],成为HCV 滴度测定的主要方法,但仍然存在取出细胞爬片过程中会导致被感染细胞的损失,以及荧光显微镜下计数误差等不足。2009 年,IHC 技术被用于HCV 滴度测定[5],将HCV 感染Huh7 细胞后,采用特异性的一抗识别HCV 蛋白,再采用HRP标记的二抗与一抗特异性结合,最后用DAB 显色,通过统计HCV 感染细胞情况计算出HCV 的TCID50,从而得到病毒滴度。TCID50法测定HCV 滴度要浪费大量抗体,成本较高。本研究建立的测定HCV 滴度的方法,通过加入甲基纤维素限制病毒于胞间感染,利用聚合二抗及DAB 显色形成肉眼可见的病毒斑块,仅需一块96 孔板就可测定4~6 个HCV 滴度,在保证结果精确的同时较为节约抗体。
本研究采用辣根过氧化物酶标记的羊抗鼠二抗识别鼠源抗HCV 核心蛋白的单克隆抗体,再用DAB显色剂显色,结果常规Western印迹所用的酶标二抗未使DAB 显色;换用了高灵敏度的聚合型酶标二抗后,能够使DAB 底物较好地显色,使HCV 感染斑清晰呈现出来。在感染斑计数时,稀释度较低,感染斑个数较多,导致各个感染斑之间有相连的情况,计数误差较大;而稀释度较高时,各孔之间感染斑个数差异较大,若以此计算滴度,则会导致大的误差。本实验中,10-3稀释度在96 孔板各孔中出现约30 个感染斑,各感染斑之间分布较均匀,且复孔之间感染斑数无显著性差异,因此以此感染斑数计算病毒的滴度。由于显微镜下计数易导致漏计或重复计数,可将每个孔划线分成数个区域,以提高计数的准确度。同时,该方法形成的感染斑达到了肉眼可见的程度,可以直接计数或拍成照片后计数,若以更大的24孔板测定HCV 滴度,直接通过肉眼计数感染斑会更加容易。
[1]Choo Q L,Kuo G,Weiner A J,et al.Isolation of a cDNA clone derived from a blood-borne non-A,non-B viral hepatitis genome[J].Science,1989,244(4902):359-362.
[2]Wakita T,Pietschmann T,Kato T,et al.Production of infectious hepatitis C virus in tissue culture from a cloned viral genome[J].Nat Med,2005,11(7):791-796.
[3]Steinmann E,Pietschmann T.Cell culture systems for hepatitis C virus[J].Curr Top Microbiol Immunol,2013,369:17-48.
[4]Zhong J,Gastaminza P,Cheng G,et al.Robust hepatitis C virus infection in vitro[J].Proc Natl Acad Sci USA,2005,102(26):9294-9299.
[5]Lindenbach B D.Measuring HCV infectivity produced in cell culture and in vivo[J].Methods Mol Biol,2009,510:329-336.
[6]周会芹,杨江辉,余琦,等.固定液对细胞学涂片染色效果的影响[J].中国误诊学杂志,2009,9(30):7352-7353.
[7]Hishiki T,Shimizu Y,Tobita R,et al.Infectivity of hepatitis C virus is influenced by association with apolipoprotein E isoforms[J].J Virol,2010,84(22):12048-12057.
[8]Jiang J,Luo G.Apolipoprotein E but not B is required for the formation of infectious hepatitis C virus particles[J].J Virol,2009,83(24):12680-12691.
