用于细胞培养实验的定量抽气-充气方法及相配装置
2015-11-29潘轩李璟熊蕾唐文岘张君汪保和
潘轩,李璟,熊蕾,唐文岘,张君,汪保和,3
1.湖南师范大学 生命科学学院,湖南 长沙 410081;2.湖南省老年医院,湖南 长沙 410016;3.湖南省生物发育工程及新产品研发协同创新中心,湖南 长沙 410081
将细胞培养器皿或其放置容器内的空气抽出,充入组分不同或组分配比不同的气体,这是建立细胞培养气体环境的一种方法。然而,细胞培养实验中沿用的抽气-充气方法存在一些不足之处,主要问题是气体组分定量困难、适用面不宽、耗气多、耗时长等[1-3]。本文报告一种定量抽气-充气法及其相配的抽气-充气装置和配气-输气装置,能更好地用于细胞培养气相环境的建立和维持,以及细胞培养基的预先气体平衡。
1 材料与方法
1.1 抽气-充气装置的构造
如图1、2 所示,抽气-充气装置由培养容器口组件、抽气组件、气体组分充入组件、检压计和气压平衡袋构成。培养容器是指细胞培养瓶、细胞培养器皿放置盒等容器(本文统称培养容器),培养容器口组件包括密封塞(或盖)、抽气管和充气管。抽气组件包括负压瓶、注射器、二通阀、三通阀1 和连接管。负压瓶口由硅胶瓶塞密封,瓶塞中贯穿吸气管和抽水管。吸气管的瓶内端与瓶塞下表面相平,瓶外端与三通阀1 连接。三通阀1 的另两个端口分别经管道与培养容器口抽气管和检压计连接。抽水管的瓶内端接近瓶底,瓶外端依次串接二通阀和注射器。气体组分充入组件包括气体过滤器(用于阻挡气体中的微生物和杂质微粒)、三通阀2、贮气袋、气体注射器和连接管。气体过滤器的一端连接于培养容器口充气管,另一端与三通阀2 连接,三通阀2 的另两个端口分别连接贮气袋和气体注射器。气压平衡袋为小容量医用输液袋,使用时,将其与三通阀1连接。

图1 抽气-充气装置结构示意图

图2 本实验室自制抽气-充气装置
1.2 抽气-充气装置的使用
在等温条件下,将培养容器内1/2 的气体抽出,接着向容器内充入气体,其组分或组分配比与抽出气体不同,而体积与抽出气体相等。如此进行的一次抽气和一次充气计为一轮抽气-充气。培养容器内气体环境的建立需要R(≥1)轮抽气-充气,前R-1轮抽气-充氮或抽气-充氧,第R轮抽气-充气将满足所需配比的各种气体组分充入容器。
1.2.1 抽气-充气轮数的计算
①培养容器内需O2浓度低于大气O2浓度的混合气体,进行R轮抽气-充气时,前R-1轮充入N2,第R轮充入各种气体组分,达到组分配比的要求。用式(1)计算所需的抽气-充气轮数R:

式中,Rl-O2为培养容器内气相空间O2体积分数减至一定数值所需抽气-充气轮数;Fi-O2为抽气-充气前培养容器内气相空间的O2体积分数,一般实验环境条件下,其取值是20.0%;Fc-O2为细胞培养时培养容器内气相空间所需O2体积分数。
若算得Rl-O2是正整数,直接用其作为实际操作的抽气-充气轮数R;若算得Rl-O2是正分数,则用比其大的最小正整数作为实际操作的抽气-充气轮数R。
②培养容器内需O2浓度高于大气O2浓度的混合气体,进行R轮抽气-充气时,前R-1轮充入O2,第R轮充入各种气体组分,达到组分配比的要求。用式(2)计算所需的抽气-充气轮数R:

式中,Rh-O2为培养容器内气相空间O2体积分数增至一定数值所需抽气-充气轮数。
按算得的Rh-O2,实际操作所用抽气-充气轮数R的取值方法与Rl-O2相同。
1.2.2R-1 轮抽气-充气后培养容器内气相空间O2体积分数的计算
用式(3)计算R-1轮抽气-充氮后培养容器内气相空间O2体积分数Fl-O2:

用式(4)计算R-1轮抽气-充氧后培养瓶内气相空间O2体积分数Fh-O2:

1.2.3 第R轮抽气-充气中培养容器内需充入气体组分体积的计算
用式(5)计算第R轮抽气-充气中需充入培养容器内的气体组分体积Vgc:

式中,Vgc包括Vgc-O2、Vgc-CO2、Vgc-N2、Vgc-X,X 表示非O2/非CO2/非N2气体;Fc为细胞培养时培养容器内气相空间所需气体组分体积分数,包括Fc-O2、Fc-CO2、Fc-N2和Fc-X,其中Fc-N2=100%-(Fc-O2+Fc-CO2+Fc-X+Fc-Va),Fc-Va表示细胞培养时培养容器内水蒸汽的体积分数;Fpr为R-1 轮抽气-充气后培养容器内气相空间气体组分的体积分数,包括Fpr-O2、Fpr-CO2、Fpr-N2和Fpr-X,其中Fpr-O2包括Fl-O2和Fh-O2,Fpr-CO2和Fpr-X均等于0,Fpr-N2=100%-(Fpr-O2+Fpr-CO2+Fpr-X+Fpr-Va);Vgcp为培养容器内气相空间的体积;Ti为周围环境(实验室内)绝对温度(K);Tc为细胞培养时培养容器内绝对温度(K)。
1.2.4 抽气-充气操作方法
抽气-充气装置的部件经灭菌处理备用,抽气-充气操作在超净工作台的无菌条件下进行,操作步骤如下:①安装好培养容器口组件;在负压瓶内装满蒸馏水,用瓶塞紧塞瓶口;②连通培养容器与负压瓶,用注射器将负压瓶内水抽出,当抽出水体积等于培养容器内气相空间+抽气管路内腔之和时,停止抽水,关闭三通阀1;③连通培养容器与N2或O2贮气袋,贮气袋内气体进入培养容器;④连通培养容器和检压计,适度挤压贮气袋,将袋内气体继续充入容器;当容器内气压与周围大气压相等时,停止挤压贮气袋,关闭三通阀1 和2;⑤如果抽气-充气轮数R≥3,重复进行步骤②~④,直至完成R-1轮抽气-充气;⑥重复步骤②;⑦用气体注射器从贮气袋内抽取体积Vgc的一种气体组分,将气体组分注入培养容器;如此重复操作,将所需各种气体组分注入培养容器;⑧取下抽气组件和气体组分充入组件,在三通阀1上连接气压平衡袋或配气-输气装置(下述)。
1.3 配气-输气装置的构造
为了抵消培养时细胞消耗O2和产生CO2的影响,维持培养容器内气体组分浓度的稳定,可向容器内输送既定组分配比的混合气体,配气-输气装置用于混合气体的配制和输送。
如图3、4 所示,配气-输气装置由通水动力瓶、配气袋、检压计、蠕动泵、气体过滤器、湿化瓶、气阀和连接管路组成。通水动力瓶的主体是下嘴玻璃瓶,其容量为2~5 L,瓶口由硅胶塞密封,瓶塞中贯穿排气管和通气管。排气管的瓶内端与瓶塞的下表面相平,其瓶外端连接硅胶管。通气管的瓶内端伸入玻璃瓶内约2 cm,连接配气袋;瓶外端连接三通阀1。三通阀1 的另两个端口分别连接贮气袋和三通阀2。在三通阀2的另两个端口上,一个连接检压计,一个依次串接三通阀3、气体过滤器和湿化瓶。湿化瓶口由瓶塞密封,瓶塞中贯穿进气管和输气管,进气管的瓶内端接近瓶底,瓶外端连接气体过滤器;输气管的瓶内端与瓶塞下表面相平,瓶外端经硅胶管与培养容器口组件的充气管连接。通水动力瓶的下嘴也由硅胶塞密封,一根通水管贯穿下嘴塞。通水管的瓶外端连接三通阀4,三通阀4的另两个端口分别连接蠕动泵和放水管。
1.4 配气-输气装置的使用
①用式(6)计算配气袋内配制混合气体所需各种气体组分的体积:


图3 配气-输气装置结构示意图

图4 本实验室自制配气-输气装置
式中,Vgc'为配气袋内需充入的气体组分体积;Fc和Fc-Va同式(5);Vm为配气袋内需配混合气体的体积;②在通水动力瓶内加约一满瓶水,用注射器将配气袋内气体抽净,将配气袋置入瓶内,并用硅胶塞紧塞瓶口;③通过通水管向玻璃瓶内注水,使瓶内水面上方的气体经排气管排出,然后将排气管夹闭;④取装有第1 种气体组分的贮气袋,将其与三通阀1 连接,使配气袋与贮气袋连通,也与检压计连通;⑤由放水管放出通水动力瓶内的水,贮气袋内气体进入配气袋,当放出水的体积达到第1 种气体组分所需体积Vgc'时,停止放水;在配气袋内气压与周围大气压平衡的状态下,关闭三通阀1;⑥用装有第2 种气体组分的贮气袋替换第1 种气体组分贮气袋,按步骤④和⑤同法操作,将第2 种气体组分充入配气袋内;如此类推,将第3 种或更多种气体组分充入配气袋;然后,取下配气-输气装置上的贮气袋和检压计;⑦在湿化瓶中加接近一满瓶37℃无菌蒸馏水,塞紧瓶塞,连通配气袋与湿化瓶;⑧开动蠕动泵,以一定流速向通水动力瓶内注水,配气袋内的混合气体经湿化瓶输气管排至外界;当管路中充满配气袋内输出的混合气体时,将与输气管与培养容器口充气管连接,并打开培养容器口抽气管上的三通阀;调低蠕动泵向玻璃瓶内注水的流速(一般可为10~100 L/min),使配气袋内混合气体输入培养容器。
1.5 气体组分体积分数的检测
开启空调,保持室温为20℃;在25 mL培养瓶内加入DMEM 培养液2.5 mL,使用上述抽气-充气装置,以Ti=293K、Tc=310K、N2为平衡气,在培养瓶内分别混配O2和CO2不同配比(见结果部分)的4 种混合气体;通过培养容器口组件向培养瓶内注入DMEM培养液10 mL,同时从培养瓶内抽出10 mL 混合气体;将抽出的混合气体注入放有干燥剂片并已抽真空的塑料袋中,5 min 后从袋内抽出干燥的混合气,注入CO2和氧气记录分析仪(TFS-CO2/O2 型,株洲市拓达电子有限公司),检测O2体积分数和CO2体积分数;将检测值乘以0.94(Fc-Va=6%),算出培养瓶气相空间的O2和CO2体积分数。
使用配气-输气装置,在其配气袋内,以Fc-Va=6%、N2为平衡气,分别混配O2和CO2不同配比(见结果部分)的4 种混合气体;向配气袋所在下嘴玻璃瓶内注水10 mL,从配气袋内抽出10 mL混合气体,用上述CO2和氧气记录分析仪检测O2体积分数和CO2体积分数。
1.6 培养基气体平衡
配制含20%胎牛血清的DMEM 液,加入30 mL容量的玻璃瓶中,每瓶10 mL,塞紧硅胶瓶塞;用抽气-充气装置,分别在这些玻璃瓶内配制3 种混合气体,O2浓度分别为1%、20%、40%,各种混合气体的CO2浓度均为10%,均用N2作为平衡气体;将配好混合气体的玻璃瓶置于水平回旋摇床,以10/min 的频率回旋30 min,贮存备用。
1.7 MC-3T3-E1细胞的培养
用胰酶法将贴壁生长至亚融合的MC-3T3-E1细胞消化下来,离心洗涤后重悬,计数,制成含10%胎牛血清的DMEM 单细胞悬液,细胞浓度1×104/mL。将单细胞悬液种入12.5 cm2培养瓶,2.5 mL/瓶。细胞分为1%、20%、80% O2浓度组,各组CO2浓度均为10%,N2作为平衡气体。各组培养瓶内的混合气体均用前述抽气-充气法配制。将各组细胞置于37℃恒温培养箱,培养48 h 后行Wright-Giemsa染色,按参考文献[4]做原位细胞计数,拍照。
1.8 CFU-F集落形成实验
用颈椎脱臼法处死KM 小鼠,无菌条件下取股骨和胫骨骨髓,制成骨髓单细胞悬液,计数。骨髓细胞混悬于含20%胎牛血清的DMEM 液中,细胞浓度1×106/mL,种入35 mm 培养皿,2 mL/皿。细胞分为1%、20%、40% O2浓度组,各组CO2浓度均为10%,N2作为平衡气体。各组培养皿分别放入自制的细胞培养环境盒,用前述抽气-充气法在各组环境盒内配制混合气体。将环境盒置于37℃恒温培养箱,培养2 d 后,吸出培养皿内培养液和未贴壁细胞,换入前述已做气体平衡培养液。将培养皿再放入细胞培养环境盒,仍按上述组分配比分别在3 个实验组的环境盒内配制混合气体,并使用前述配气-输气装置配制与环境盒内组分配比相同的混合气体,以20 L/min的流速将混合气体分别输入环境盒,在37℃下培养,每天输气12 h。继续培养7 d 后,行Wright-Giemsa染色,显微镜下计数CFU-F集落(≥20个成纤维细胞的聚合计为1个集落),拍照。
1.9 统计学分析
2 结果
2.1 培养瓶内混配气体的组分体积分数
培养瓶内4 种混合气体的O2和CO2体积配比预定值见表1。在各种配比的混合气体中,O2体积分数检测值与预定值的差值在1%以内。配比1 混合气体的O2体积分数检测值与预定值的差值仅0.17%,但由于预定值小,误差达17%;配比2、3、4 混合气体的O2体积分数检测值相对于预定值的误差≤6%。各种配比混合气体的CO2体积分数检测值与预定值的差值在1.2%以内,误差<12.0%。
2.2 配气袋内混配气体的组分体积分数
配气袋内4 种混合气体的O2和CO2体积配比预定值见表2。配比1 混合气体的O2体积分数检测值与预定值的差值为0.13%,误差为11%;配比2、3、4混合气体的O2体积分数检测值与预定值的差值在0.8%以内,误差<3%。各种配比混合气体中,CO2体积分数检测值与预定值的差值在0.5%以内,误差<6%。
2.3 不同O2浓度条件下MC-3T3-E1细胞的生长
在1%、20%和80% O2浓度培养条件下,MC-3T3-E1 细胞的生长表现出明显差异,培养瓶细胞计数结果依次为(96.5±29.6)×103、(250.4±81.0)×103和(8.8±3.9)×103。与20% O2组比,1% O2组和80% O2组的细胞数均减少,差异均有显著性意义(图5)。
2.4 不同O2浓度培养条件下CFU-F集落的形成
在1%、20%和40% O2浓度的培养条件下,小鼠骨髓CFU-F 集落的生成表现出明显差异(图7),每106骨髓有核细胞的CFU-F 集落数依次为8.0±3.3、17.7±4.7 和2.3±0.8。与20% O2组比,1% O2组和40% O2组的CFU-F集落形成率均减低,差异均有显著性意义(图6)。

表1 培养瓶内气体组分体积分数的预定值和检测值(n=3)
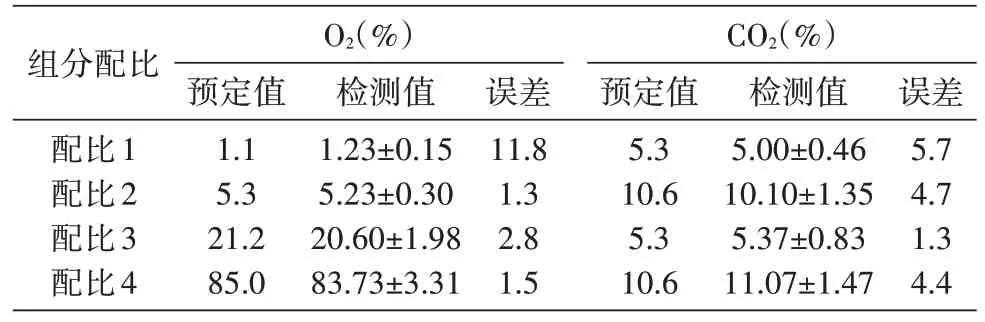
表2 配气袋内气体组分体积分数的预定值和检测值(n=3)
3 讨论
上述混配气体组分体积分数检测结果表明,在培养瓶内和培养器皿放置容器内,用定量抽气-充气法(该方法已获专利授权,专利号201420836800.2)能直接配制细胞培养环境所需组分配比的混合气体;细胞培养结果进一步证明了这种抽气-充气法用于细胞培养实验的可靠性和有效性。这种方法也能用于细胞培养基的预先气体平衡。
不论在细胞培养器皿或其放置容器内建立细胞培养气相环境,还是在细胞培养基贮器内进行预先气体平衡,都须将容器内空气置换成一定组分配比的混合气体。常用方法是将已配好的混合气体持续通入容器,同时使容器内的空气排出,通过逐渐稀释作用,建立细胞培养气相环境[5-7]。这一方法费时费气,并且需要预配混合气体。为克服其弊端可采用另一种方法,即先将容器中的原有气体部分抽出,然后把组分气体和被试气体定量充入容器[3,8-9]。这种方法要求抽气和充气定量进行,但是其定量问题并未得到有效可行的解决[10-11]。本文报道了用于定量抽气-充气的一系列公式,这些公式的推导除了以抽气-充气容器内气相空间体积、容器内原有气体的组分浓度和细胞培养环境所需气体组分浓度为基本参数,还充分考虑了水蒸汽和温度等因素。在常规细胞培养温度(37℃)下,水蒸汽在气相环境中所占体积比约达6%;一般室温与细胞培养温度具有一定的差值,对培养器皿或其放置容器内抽气和充气的定量产生影响[12],而在以往细胞培养气相环境的建立中,忽略了这些因素的影响[13]。将这些公式用于抽气-充气的定量计算,能更好地满足细胞培养气相环境中各种组分和被试气体的定量要求。
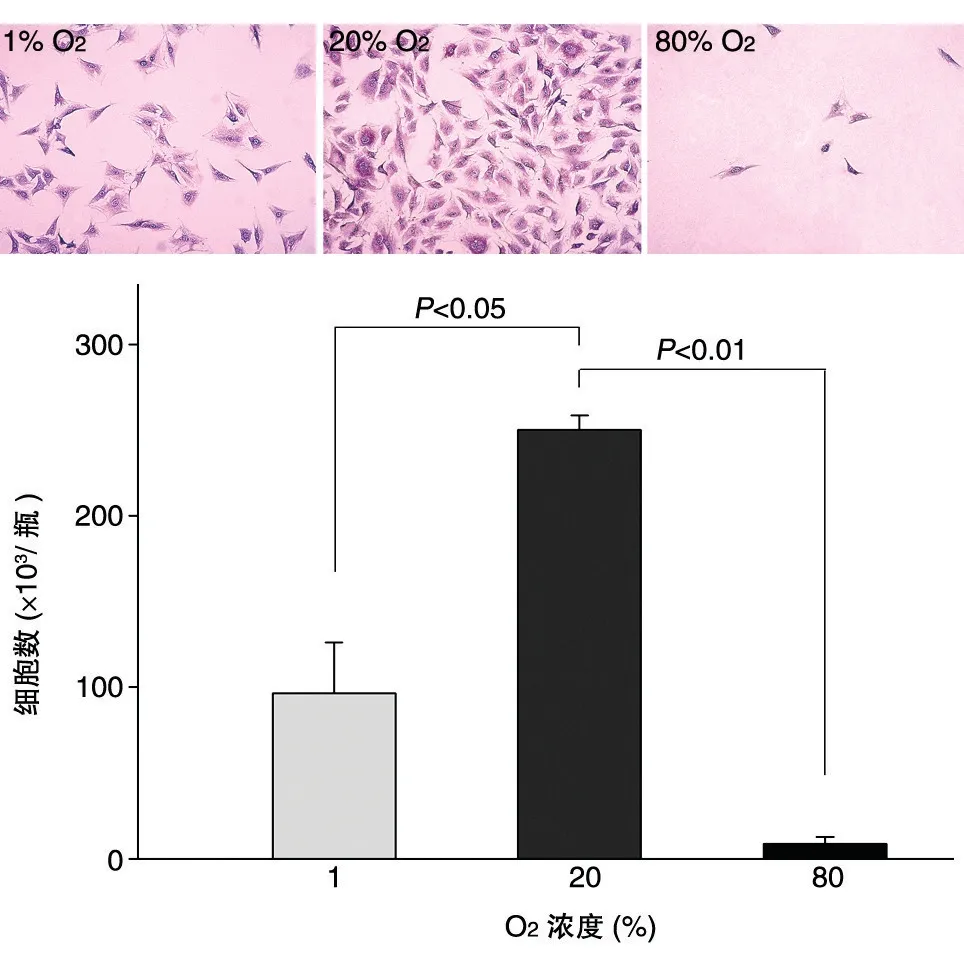
图5 不同O2浓度培养条件下MC-3T3-E1细胞的生长

图6 不同O2浓度培养条件下CFU-F集落的形成
在操作上,本文的抽气-充气法比细胞培养实验沿用的抽气-充气法更为简便实用。使用注射器进行手工操作,就能将容器内1/2 的气体抽出,而不必用电动真空泵抽气。借助与被抽气容器相连通的负压瓶,通过从瓶内抽水造成负压而抽出容器内气体,使得抽气定量更加自如,抽气量不受注射器容量的限制。抽气之后的容器内充气可由贮气袋直接输入,或用注射器从袋内抽取气体后注入容器。通过气体组分定量加入容器,能在容器内建立各种气体组分配比的气相环境,不须预先配好混合气体,还省时省气。而且,使用贮气袋装纳组分气体和被试气体,可用气体种类多、来源广,除了市售气体,还可采集各种环境气体和实验室自制气体,不受气体量少的限制。因此,本文的抽气-充气法除了能方便地用于各级O2、CO2和N2浓度条件下的细胞培养实验,也能方便地用于研究各种环境污染气体、麻醉气体和其他气体生物效应和有害作用的细胞培养实验。
直接在培养容器内建立所需气相环境后,如果在容器密闭条件下进行长时间细胞培养,细胞代谢的O2消耗和CO2产生将使气相环境的气体组分浓度有所改变。为了严格维持细胞培养环境中的O2和CO2浓度的稳定,可向容器内输送既定组分配比的混合气体。本文所述配气-输气装置运用水-气等量置换技术,能按组分配比要求配制各种组分浓度的混合气体,并能将所配混合气体控速输入细胞培养器皿或其放置容器(已申请该装置的专利,申请号201310365440.2)。如果细胞培养所需时间较短,相对于容器内O2和CO2总量来说,细胞的O2消耗量和CO2产生量极少,培养环境中O2和CO2浓度的变化可被忽略[14]。这种情况下,可不必向容器内输送气体。但是,将容器密闭从室温条件下放入恒温培养箱后,升温性气体膨胀将使容器内气压高于周围大气压[15]。使用本文所述气压平衡袋,能简单而可靠地保持培养容器内气压与周围大气压之间的平衡。
总之,本文所述抽气-充气法及相配装置的可靠性高、适用性强、费用低廉,可作为细胞培养气相环境建立和维持方法和装置的有益选择。
[1]Nishimura R,Okuda K.Hypoxia is important for establishing vascularization during corpus luteum formation in cattle[J].J Reprod Dev,2010,56(1):110-116.
[2]Shen J,Lee W,Gu Y,et al.Ginkgo biloba extract(EGb761)inhibits mitochondria-dependent caspase pathway and prevents apoptosis in hypoxia-reoxygenated cardiomyocytes[J].Chin Med,2011,6:8.
[3]Boyette L B,Creasey O A,Guzik L,et al.Human bone marrow-derived mesenchymal stem cells display enhanced clonogenicity but impaired differentiation with hypoxic preconditioning[J].Stem Cells Transl Med,2014,3(2):241-254.
[4]朱海林,彭彬,吴晶晶,等.培养板单层贴壁细胞的原位计数方法[J].细胞生物学杂志,2009,31(5):719-725.
[5]Xie H,Liu Q,Qiao S,et al.Delayed cardioprotection by sevoflurane preconditioning:a novel mechanism via inhibiting Beclin 1-mediated autophagic cell death in cardiac myocytes exposed to hypoxia/reoxygenation injury[J].Int J Clin Exp Pathol,2015,8(1):217-226.
[6]Lima C B,Santos S A,Andrade Júnior D R.Hypoxic stress,hepatocytes and CACO-2 viability and susceptibility to Shigella flexneri invasion[J].Rev Inst Med Trop Sao Paulo,2013,55(5):341-346.
[7]薛奋龙,陈庆良,简锴陶,等.缺氧预处理对骨髓来源内皮祖细胞生物学功能的影响[J].天津医药,2014,42(3):231-234.
[8]程楠,池信锦,黑子清,等.组胺对大鼠正常肝细胞及缺氧/复氧时肝细胞活力的影响.中国病理生理杂志,2010,26(5):997-999.
[9]于慧卿,孟云辉,李永新,等.四妙勇安汤合生脉饮对缺氧/复氧乳鼠心肌细胞凋亡的影响[J].中国中医药信息杂志,2013,20(12):35-37.
[10]王关嵩,钱桂生,陈维中.低浓度一氧化碳和缺氧气体处理培养细胞容器的研制及其应用[J].中国动脉硬化杂志,2001,9(1):67-70.
[11]王卫东,陈正堂,段玉忠,等.一种用于定量研究细胞缺氧的简易模型[J].中国病理生理杂志,2003,19(8):1151-1152.
[12]Mather J P,Roberts P E.Introduction to cell and tissue culture:theory and technique[M].New York:Plenum Press,1998.
[13]Konigsberg M,Pérez V I,Ríos C,et al.Effect of oxygen tension on bioenergetics and proteostasis in young and old myoblast precursor cells[J].Redox Biol,2013,1:1475-1482.
[14]Wagner B A,Venkataraman S,Buettner G R.The rate of oxygen utilization by cells[J].Free Radic Biol Med,2011,51(3):700-712.
[15]Lennon D P,Edmison J M,Caplan A I.Cultivation of rat marrow-derived mesenchymal stem cells in reduced oxygen tension:effects on in vitro and in vivo osteochondrogenesis[J].J Cell Physiol,2001,187(3):345-355.
