LSECtin-CRD-GST融合蛋白的原核表达、纯化及复性
2015-11-29汪明群丛建波程莉董国福王少霞郑文王长振吴可
汪明群 ,丛建波,程莉,董国福,王少霞,郑文,王长振,吴可
1.宜宾市第一人民医院,四川 宜宾 644000;2.军事医学科学院 放射与辐射医学研究所,北京 100850
C 型凝集素树突细胞特异性细胞间黏附分子3结合非整合素分子(dendritic cell-specific intercellular adhesion molecule-3-grabbing nonintegrin,DC-SIGN)家族成员肝脏免疫调控蛋白LSECtin(liver and lymph node sinusoidal endothelial cell Ctype lectin)是近年来克隆鉴定的新型凝集素蛋白,在肝脏和淋巴结表达[1-2],活体分离的外周血和胸腺树突细胞(DC)及体外培养的活化巨噬细胞也有表达[3],并被证实是肝脏重要的免疫调控蛋白[4-5]。其基因与DC-SIGN、DC-SIGNR(DC-SIGN related protein)和CD23 的基因紧密排列于染色体19p13.3 区域。它们均属于Ⅱ型C 型凝集素家族,具有相似的结构,由一个N 端的胞内结构域、一个穿膜部分、一个含卷曲螺旋的颈部结构域和一个C 端糖基识别结构域(carbohydrate recognition domain,CRD)组成,其中CRD 结构域是参与病毒感染及配体结合的主要功能结构域[1,6]。近年来对LSECtin 分子的研究虽有较多进展,但对其功能结构域在溶液状态的结构特点及其在与配体相互作用时的动态结构变化并未得到很好的阐明,这也是该领域研究中需要解决的重点和热点问题。
我们拟采用基因克隆的方法构建LSECtin-CRD的原核表达载体,并对其表达纯化,旨在获得足量可溶融合蛋白,为后续LSECtin-CRD 结构域的功能与构象变化研究打下实验基础。
1 材料与方法
1.1 材料
LSECtin-CRD 模板(军事医学科学院蛋白质组与基因组学实验室提供);pGEX-6p-1(中国农业科学院质标所惠赠);大肠杆菌DH5α、Origami(DE3)感受态细胞(Novagen 公司);高保真DNA 聚合酶,DNA纯化试剂盒,限制性内切酶EcoRⅠ、NotⅠ(Promega公司);DL2000 DNA marker、λHindⅢ、T4DNA 连接酶(NEB 公司);蛋白质分子量marker(Fermentas 公司);GST 抗体、HRP 标记的羊抗兔抗体(Santa Cruz Biotechnology公司)。
1.2 原核表达载体构建
根据LSECtin 基因序列和原核表达载体pGEX-6p-1 的多克隆位点设计上游引物P1(5'-CCGGAA TTCGGCTCCTGCTACTTTTT-3')和下游引物 P2(5'-CCCGCGGCCGCGCAGTTGTGGCCTTTTCT-3')。上、下游引物分别引入EcoRⅠ和NotⅠ酶切位点。用上述引物以LSECtin 为模板扩增360 bp 的LSECtin-CRD 基因序列,目的片段纯化、EcoRⅠ/NotⅠ双酶切后与经同样双酶切的原核表达载体pGEX-6p-1 用T4DNA 连接酶连接,转化大肠杆菌DH5α感受态细胞,阳性克隆经酶切和测序鉴定。
1.3 重组表达载体的诱导表达
将测序正确的表达质粒pGEX-6p-1-LSECtin-CRD 转化宿主菌Origami(DE3)进行重组蛋白诱导表达。小量菌种培养过夜,1%接种量转接后,D600nm为0.5~0.8 时加入终浓度为0.5 mmol/L 的IPTG,20℃低温诱导6 h,离心收集菌体,用TBS 吹匀,洗3 次,离心后加TBST,超声波破碎(超声3 s 停2 s,共5 min,连续3 次后停5 min,重复操作5~8 次,直至溶液变得澄清),将得到的样品(未诱导全菌为阴性对照)经SDS-PAGE检测。
1.4 包涵体的复性、纯化及Western印迹鉴定
将诱导表达的菌液于5000 r/min 离心10 min,弃上清,用TBS 洗2 次,收集菌体,按每克菌体加10 mL STET 缓冲液(pH8.0)的比例重悬,超声波破菌后1000 r/min离心10 min,弃上清,沉淀用10 mL包涵体洗涤液洗涤3 次,再用9 倍体积的含4 mol/L 尿素的TE 缓冲液(含20 mmol/L Tris-HCl,1 mmol/L EDTA,pH8.0)洗涤,过夜,分别保留上清和沉淀,按10 mL/g 的比例用含8 mol/L 尿素的缓冲液(含0.2 mol/L NaCl,0.1 mol/L Tris-HCl,1 mmol/L EDTA,1 mmol/L DTT,pH8.0)溶解沉淀,4℃搅拌过夜,4℃低温离心,上清即为目的蛋白。上述包涵体裂解液用含8 mol/L 尿素的缓冲液(含20 mmol/L Tris-HCl,1 mmol/L EDTA,pH8.0)稀释至0.2 mg/mL,加入DTT 至终浓度1 mmol/L,室温放置4 h,用含4、3、2 mol/L 尿素的透析外液(含20 mmol/L Tris-HCl,1 mmol/L EDTA,3 mmol/L GSH,0.5 mmol/L GSSG,pH8.0)进行4℃梯度透析复性24 h,将复性的溶液进行GST 柱亲和纯化,SDS-PAGE 检测收集流出液,对纯化的蛋白进行Western印迹鉴定。
对纯化蛋白进行12% SDS-PAGE;选用标准湿式转膜装置,将蛋白移到PVDF 膜,设定转膜电流为300~400 mA,时间为60 min,为了避免发热现象,将转膜槽置于冰浴中;转膜结束后,把PVDF 膜置入洗涤液漂洗2 min,去除洗涤液,加入含5%脱脂牛奶的TBST封闭液,在摇床上缓慢摇动,室温封闭60 min;用兔源单克隆抗体GST(1∶1000)孵育,4℃缓慢摇动过夜,TBST 洗3 次,每次10 min;用羊抗兔辣根过氧化物酶(HRP)标记的二抗室温孵育1 h,TBST 洗3次,每次10 min;ECL暗室曝光显影。
2 结果
2.1 pGEX-6p-1-LSECtin-CRD原核表达载体的构建
用EcoRⅠ/NotⅠ双酶切胶回收扩增的目的基因小片段,与同样经双酶切的质粒载体大片段连接后构建表达载体pGEX-6p-1-LSECtin-CRD,挑克隆扩大培养,酶切鉴定(图1),显示250~500 bp有特异的DNA 带,大小与预计相符,初步表明目的片段已成功插入。对呈阳性结果的克隆保存菌种,取1.0 mL送Invitrogen 公司测序,结果表明基因序列正确匹配,被测片段包括了编码LSECtin-CRD 的全部核苷酸序列及两端的引物。
2.2 LSECtin-CRD-GST融合蛋白的诱导表达
将酶切鉴定及测序正确的pGEX-6p-1-LSECtin-CRD 转化大肠杆菌Origami(DE3)宿主菌,外源基因表达后离心收集融合蛋白,SDS-PAGE 检测表达情况,结果见图2,在相对分子质量约40×103处有蛋白表达,与预计的融合蛋白大小吻合,表明表达载体转化宿主菌后诱导出大量融合蛋白,但以包涵体形式存在,上清液里未发现可溶蛋白。
2.3 包涵体的复性、纯化及Western印迹鉴定
对包涵体进行洗涤裂解及梯度透析复性处理后用GST柱亲和纯化,纯化的样品经SDS-PAGE(图3)分析,结果显示获得纯度高的目的蛋白。Western 印迹(图4)检测证明目的蛋白有特异的GST抗原性。
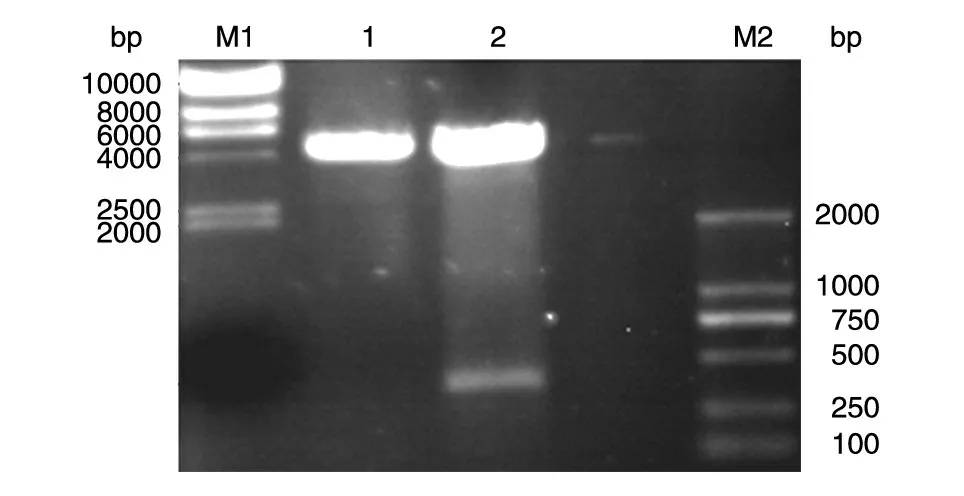
图1 pGEX-6p-1-LSECtin-CRD表达载体的双酶切鉴定
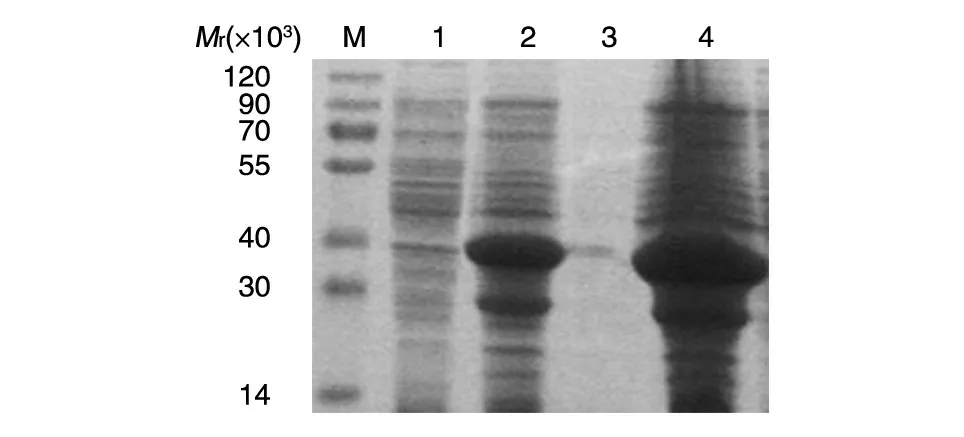
图2 pGEX-6p-1-LSECtin-CRD在宿主菌中的诱导表达
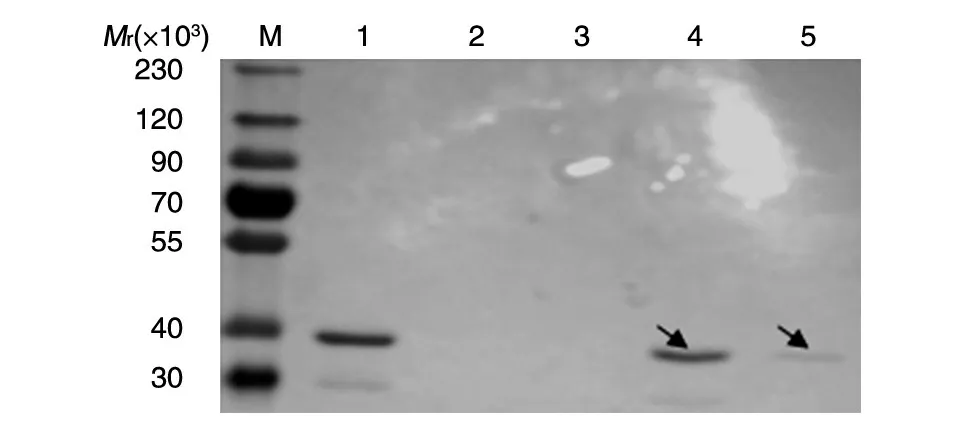
图3 融合蛋白纯化的SDS-PAGE分析

图4 Western印迹验证融合蛋白
3 讨论
LSECtin 系肝脏及淋巴结窦内皮细胞C 型凝集素,属于疏水性强、富含二硫键的Ⅱ型跨膜糖蛋白。已有研究表明LSECtin-CRD在原核系统中以包涵体形式表达[5,7-8]。本实验中,我们选择了有助于膜蛋白二硫键正确折叠的表达载体pGEX-6p-1。pGEX 质粒载体将基因或基因片段与GST 融合后,不但能在细胞内高水平诱导表达,而且有助于提高表达蛋白的活性。我们还选择大肠杆菌Origami(DE3)作为重组蛋白的宿主菌。Origami(DE3)是硫氧还蛋白还原酶(TrxB)突变的BL21 衍生菌,它能促进重组蛋白在胞质中形成二硫键,而普通的大肠杆菌不利于二硫键的形成,并且在同类衍生菌中,Origami(DE3)形成二硫键的活力是最强的[9]。有研究表明,在整体水平相当的情况下,采用Origami(DE3)宿主,曾使一个含二硫键的重组蛋白的表达活性提高了10 倍[10],同样是包涵体,但用Origami(DE3)宿主菌更有利于翻译后修饰,有效降低了重组蛋白的无序聚集,有益于下一步的复性。
虽然我们在低温、低IPTG 浓度、丰富培养基、短时诱导、错开目的蛋白等电点等方面进行了摸索,依然没能实现目的蛋白的可溶性表达。但本实验揭示宿主菌Origami 与表达载体pGEX-6p-1 是一对较佳的组合,这一组合有效地提高了表达蛋白的活性,降低了重组蛋白的无序折叠,易化了后续复性工作,对表达融合蛋白具有重要的借鉴意义。
[1]Liu W,Tang L,Zhang G,et al.Characterization of a novel C-type lectin-like gene,LSECtin:demonstration of carbohydrate binding and expression in sinusoidal endothelial cells of liver and lymph node[J].J Biol Chem,2004,279:18748-18758.
[2]Domínguez-Soto A,Aragoneses-Fenoll L,Gómez-Aguado F,et al.The pathogen receptor liver and lymph node sinusoidal endotelial cell C-type lectin is expressed in human Kupffer cells and regulated by PU.1[J].Hepatology,2009,49(1):287-296.
[3]Domínguez-Soto A,Aragoneses-Fenoll L,Martin-Gayo E,et al.The DC-SIGN-related lectin LSECtin mediates antigen capture and pathogen binding by human myeloid cells[J].Blood,2007,109(12):5337-5345.
[4]Tang L,Yang J,Liu W,et al.Liver sinusoidal endothelial cell lectin,LSECtin,negatively regulates hepatic T-cell immune response[J].Gastroenterology,2009,137(4):1498-1508.
[5]Tang L,Yang J,Tang X,et al.The DC-SIGN family member LSECtin is a novel ligand of CD44 on activated T cells[J].Eur J Immunol,2010,40:1185-1191.
[6]Pokidysheva E,Zhang Y,Battisti A J,et al.Cryo-EM reconstruction of dengue virus in complex with the carbohydrate recognition domain of DC-SIGN[J].Cell,2006,124(3):485-493.
[7]Wang C Z,Yang J T,Zhou Y,et al.Mobility study of individual residue sites in the carbohydrate recognition domain of LSECtin using SDSL-EPR technique[J].Appl Biochem Biotechnol,2012,167:2295-2304.
[8]王长振,杨俊涛,周宇,等.LSECtin CRD结构域的运行性研究[J].生物物理学报,2009,25:85-86.
[9]梅乐和,曹毅,姚善泾.蛋白质化学与蛋白质工程基础[M].北京:化学工业出版社,2011.
[10]Prinz W A,Aslund F,Holmgren A,et al.The role of the thioredoxin and glutaredoxin pathways in reducing protein disulfide bonds in the Escherichia coli cytoplasm[J].J Biol Chem,1997,272(25):15661-15667.
