人表皮生长因子的原核优势表达与复性
2015-11-29孙卫国杨栗坤熊志红杨秉芬刘艳华张灵霞
孙卫国,杨栗坤,熊志红,杨秉芬,刘艳华,张灵霞
解放军第309医院 结核病研究所,全军结核病防治重点实验室,北京 100091
人表皮生长因子(human epidermal growth factor,hEGF)是由53 个氨基酸残基组成的单链多肽,广泛存在于人体各种组织内。人体内EGF含量不足易导致一系列的病理变化,如胃肠道溃疡病,而补充外源性EGF 能大大缩短慢性胃溃疡的疗程[1]。EGF表达过量增加鸟氨酸脱羧酶的活性及多胺水平,也与多种肿瘤的发生、发展有关[2]。hEGF能促进烧伤、创伤及外科伤口的愈合,在烧伤、创伤、皮肤和角膜移植、外伤性皮肤溃疡等治疗中有重要作用。EGF也是某些化妆品的添加剂,具有较大的市场价值。目前利用原核系统表达重组hEGF(rhEGF)的主要弊端是表达量较低,生物活性不高,很难规模化生产。我们根据原核表达系统特点,优化影响rhEGF表达量的诸多因素,对基因核酸序列的mRNA 结构、密码子偏爱性,表达宿主菌的生长状态进行综合考虑,通过同义密码子置换合成hEGF 全基因序列,构建原核表达载体pET-24b-hEGF,获得hEGF 在原核系统内的高表达,其表达量占菌体总蛋白的15%左右。经过复性条件的优化,包涵体的复性率达90%以上,为原核系统规模化生产rhEGF打下了基础。
1 材料与方法
1.1 材料
BALB/c3T3 细胞,大肠杆菌BL21(DE3)和载体pET24b 由本室保存;EGF 标准品由中国药品生物制品检定所提供;优化后的hEGF编码序列和测序由北京华大基因生物工程公司合成;酵母提取物、胰蛋白胨购自Oxoid 公司;hEGF 抗体购自ABcam 公司;酶标羊抗兔IgG(HRP 标记)购自中杉生物工程技术公司;MTT 购自Sigma 公司;亲和色谱填料购自GE 公司;其他生化试剂均为国产分析纯。
1.2 hEGF全基因序列优化与合成
根据生物软件对hEGF可能表达量的预测,对其编码序列按同义密码子进行全合成,使mRNA 的二级结构自由能满足最优表达需要,同时3′端加入大肠杆菌偏好终止密码子TAA。合成的全序列为:AACAGCGACTCTGAATGCCCGCTGTCCCACGATGGTTACTGCCT GCATGATGGTGTGTGCATGTATATTGAAGCATTGGACAAGTATG CATGCAACTGCGTTGTTGGCTACATCGGTGAGCGTTGCCAGTAC CGTGACCTGAAGTGGTGGGAACTGCGC。
1.3 hEGF基因克隆与表达
对合成的含有hEGF 全序列载体pUC-hEGF 以限制性内切酶NdeⅠ/XhoⅠ于37℃酶切10 h,琼脂糖胶回收酶切后小片段,与经同样双酶切的表达载体pET-24b 在T4DNA 连接酶的作用下于16℃连接4 h,连接产物转化感受态大肠杆菌BL21(DE3)后,挑选阳性克隆测序,取测序结果同预期结果完全一致的菌落保存。将携带有hEGF 序列的原核表达载体命名为pET-24b-hEGF。
将阳性菌落接种含卡那霉素的LB 培养基,37℃振摇过夜活化后,按1∶100 的比例重新接种LB 培养基,检测细菌的生长密度,当菌液D600nm达0.4 时,加入IPTG 使其终浓度为0.3 mmol/L,37℃诱导表达7 h,离心收集沉淀菌体,加入PBS缓冲液混匀,冰浴超声波破碎,表达菌液加入5×上样缓冲液,煮沸后取20 μL 进行20% SDS-PAGE,分析目的蛋白在原核系统内的表达量和表达形式。
1.4 rhEGF包涵体的复性与纯化
电泳鉴定rhEGF 在原核系统中以包涵体的形式生成,对包涵体进行初步纯化。收集rhEGF 沉淀包涵体,用1%的Triton X-100 洗涤3 次,4℃、5000 r/min 离心10 min;室温条件下取rhEGF 包涵体,以含8 mol/L 尿素的Tris 缓冲液(50 mmol/L,pH8.8)溶解,高速离心后取溶液上清过Q Sepharose Fastflow阴离子交换柱,并用含8 mol/L 尿素的Tris 缓冲液(50 mmol/L,pH8.8)+NaCl 进行梯度洗脱,分别收集穿过峰和各洗脱峰蛋白;采用透析复性的方法对rhEGF 包涵体进行复性,将纯化的包涵体尿素溶液以含5 mmol/L EDTA、0.1 mmol/L GSH、0.1 mmol/L GSSG 的Tris 缓冲液(50 mmol/L,pH8.8)在4℃条件下以1∶20 的体积进行透析,12 h 更换透析液一次,透析5 次后以50 mmol/L Tris 缓冲液(pH8.8)透析,整个透析过程均没有沉淀产生;取透析后复性的rhEGF进行SDS-PAGE分析。
1.5 rhEGF的Western印迹与活性检测
取纯化的rhEGF 行20%的SDS-PAGE,电转移后将硝酸纤维素膜(NC 膜)置于含5%脱脂奶粉的PBS 缓冲液中,室温封闭1 h,用TBST 漂洗3 次;将NC 膜与兔抗hEGF 抗体(1∶3000 稀释)于4℃孵育过夜,用TBST 洗涤3 次,再与适当稀释的酶标记的羊抗兔二抗于37℃反应1 h,用TBST 洗涤4 次;ECL 暗室中自动曝光显影,验证重组蛋白的抗原性。
BALB/c3T3 细胞用RPM1640 培养基培养,将对数生长期的细胞按7×103/孔加入96 孔细胞培养板,24 h 后更换成含0.5%胎牛血清的1640 培养基继续培养24 h,依次加入用维持培养液稀释的不同浓度的EGF,每浓度梯度做3 个平行孔,37℃、5% CO2培养48~72 h,MTT 法检测各孔的D490nm值,绘制D490nm-EGF浓度关系图[3]。
2 结果
2.1 hEGF原核表达载体构建
对含有hEGF 全序列的载体pUC-hEGF 进行扩增后用NdeⅠ/XhoⅠ双酶切,回收酶切后的小片段,通过连接酶克隆到表达载体pET-24b 中,筛选阳性克隆,提取质粒pET-24b-hEGF,经NdeⅠ/XhoⅠ双酶切鉴定,10 g/L 琼脂糖电泳结果显示,酶切后生成的条带位于目标大小160 bp处(图1)。
2.2 rhEGF的原核表达
取测序正确的含有质粒pET-24b-hEGF 的重组大肠杆菌BL21(DE3)接种含卡那霉素的LB培养基,37℃振荡培养,在菌液D600nm值约为0.4 时加入IPTG诱导表达7 h,离心收集沉淀,超声波破碎,20%SDS-PAGE 分析目的蛋白的表达量和表达形式。结果如图2,在相对分子质量6×103处,诱导后有rhEGF明显表达,其表达量占总蛋白的15%以上,且基本以包涵体的形式存在于超声波后的沉淀中。
2.3 rhEGF包涵体的复性与纯化
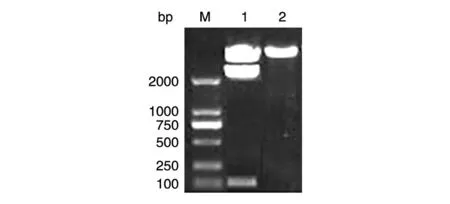
图1 pET-24b-hEGF双酶切产物的琼脂糖电泳
对表达的rhEGF 包涵体用Triton X-100 洗涤,除去脂类和降解的核酸,然后分别用2、4、6、8 mol/L的尿素溶解。SDS-PAGE 检测发现,在6 mol/L 的尿素溶液里rhEGF 包涵体得到部分溶解,而在8 mol/L的尿素溶液里全部溶解。取变性后的上清液过Q Sepharose Fastflow 阴离子交换柱,用含8 mol/L 尿素的Tris缓冲液(50 mmol/L,pH8.8)+NaCl进行梯度洗脱。当盐浓度为0.4 mol/L 时洗脱目的蛋白,一步纯化的纯度达90%以上。对洗脱上清透析复性,整个透析过程均没有沉淀产生,复性率达90%以上。取复性的rhEGF 经SDS-PAGE 分析纯度,结果如图3,纯化复性后rhEGF的Image软件扫描纯度可达93%。
2.4 rhEGF的Western印迹与活性分析
取纯化的rhEGF,经SDS-PAGE 后电转至硝酸纤维素膜上,分别和相应的一抗和二抗孵育、洗涤。与ECL 结合1 min,暗室曝光显影,结果如图4,纯化的rhEGF能与其抗体结合,具有强的抗原性。
用BALB/c3T3 细胞通过MTT 增殖法测定rhEGF的活性,以生物制品检定所提供的EGF为阳性对照,阴性对照为培养液,细胞接种数为7×103/孔。结果如图5,rhEGF 活性约为2.5×106U/mL。20~160 ng/mL 的rhEGF 对成纤维细胞具有明显的促增殖作用,与标准品表现一致,两者在统计学分析上无差异。
3 讨论
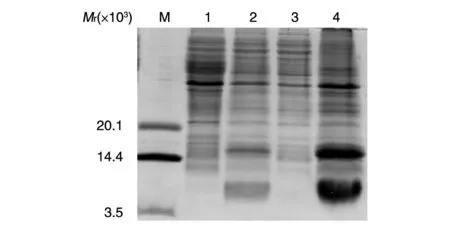
图2 hEGF原核表达形式的SDS-PAGE分析

图3 rhEGF纯化后的SDS-PAGE分析

图4 rhEGF的Western印迹

图5 rhEGF对BALB/c3T3细胞的促增殖作用
诸多因素影响外源基因在原核系统中的表达效率,如外源基因结构、密码子偏性、mRNA 翻译起始区结构,目的蛋白的毒性、氨基酸组成,表达条件的优化等[4]。成熟hEGF 具有广泛的生理功能,如加速受伤表皮细胞的修复和治疗胃肠道溃疡等[5]。目前用原核表达系统生产rhEGF 的表达量非常低。Ferrer-Soler等利用pET-22b载体获得了单体rhEGF,但表达量很低[6]。为了获得EGF 单体的高表达量,可对其氨基酸密码子进行同义置换,改变其mRNA 序列自由能,使其适合原核表达系统的特点。我们采用生物信息学方法,参照生物软件Vector NTI Suitor 7.0 对hEGF 核酸序列进行分析和合成,实现其在原核系统内的优势表达,表达量约占菌体总蛋白的15%;同时,对rhEGF 包涵体的复性进行了摸索研究,使包涵体的复性率达到90%以上。本实验为进一步研究hEGF的结构和功能奠定了基础,也可为获得重组蛋白在原核系统的高表达提供借鉴和参考。
[1]路莉,吴勇杰,高明堂,等.重组人表皮生长生长因子胶囊对大鼠慢性胃溃疡愈合质量的影响[J].中国药理学通报,2004,20(1):75-78.
[2]Bloomer C W,Kenyon L,Hammond E,et al.Cyclooxygenase-2(COX-2) and epidermal growth factor receptor expression in human pituitarymacroadenomas[J].Am J Clin Oncol,2003,26(4):75-80.
[3]郑敏,严莉,黄清松.EGF 在比赤酵母中的表达及活性测定[J].解剖学研究,2013,35(1):36-38.
[4]杨吉吉,李太华.大肠杆菌中外源基因表达的研究进展[J].微生物学免疫学进展,2000,28(2):69-72.
[5]Loot M A,Kenter S B,Au F L,et al.Fibroblasts derived from chronic diabetic ulcers differ in their response to stimulation with EGF,IGF-I,BFGF,and PDGF-AB compared to controls[J].Eur J Cell Biol,2002,81(3):153-160.
[6]Ferrer-Soler L,Cedano J,Querol E,et al.Cloning,expression and purification of human epidermal growth factor using different expression systems[J].J Chromatogr B Analyt Technol Biomed Life Sci,2003,788:113-123.
