MMP-2和MMP-9在食管鳞状细胞癌患者癌组织中的表达及其意义
2015-11-28孙晓宏房福元庞作良李惠武
孙晓宏,房福元,李 卉,尹 娜,庞作良,李惠武
(1.新疆医科大学附属肿瘤医院胸外科,新疆 乌鲁木齐 830011;2.广东省深圳市人民医院胸外科,广东 深圳 518020;3.新疆医科大学基础医学院科研中心,新疆 乌鲁木齐 830001)
食管癌是居于全球第8位的恶性肿瘤,在全球癌症死亡原因中位列第6位。2008年,全球被诊断为食管癌患者482300例,有406800例死于食管 癌[1]。2003—2007 年 我 国 食 管 癌 发 病 率 为19.24/10万,在癌症发病构成中排列第6位,同期食管癌死亡率为15.39/10万,在癌症死亡原因中列第4位[2]。中国食管癌发病占全球的53.8%,死亡占全球的51.9%[3]。肿瘤细胞的转移与细胞外基质 (extra cellular matrix,ECM)的降解有密切关联[4]。ECM由多种蛋白裂解酶降解,其中包括基质金属蛋白酶 (matrix metalloproteinase,MMP)。国外鲜有关于MMP与食管癌发生发展关系的研究,国内对于MMP的研究多采用免疫组织化学法,且多是单独针对MMP中某一单一基因的研究。本研究应用逆转录-聚合酶链式反应 (RTPCR)技术检测基质金属蛋白酶2(MMP-2)和基质金属蛋白酶9(MMP-9)基因在食管癌组织及其相应的癌旁组织中的表达情况,同时采用Western blotting技术在蛋白水平予以验证,从基因转录水平和蛋白表达水平探讨两者在食管癌发生发展和转移中的作用,阐明两者之间的关联性。
1 资料与方法
1.1 一般资料
选取2009年12月—2011年10月在新疆医科大学附属肿瘤医院行食管癌根治性切除的100例患者的手术标本,均为经病理检查证实的食管鳞状细胞癌标本,每例标本分别取癌组织及其相应癌旁组织各1份,于液氮冷冻后在-80℃冰箱储存留待检测。100例患者中,男性72例,女性28例;年龄37~80岁,中位年龄为57.4岁。食管癌TNM分期:T1+T2期24例,T3+T4期76例;有淋巴结转移者52例,无淋巴结转移者48例;高分化者77例,中、低分化者23例。
1.2 主要试剂和仪器
实验所用Trizol试剂盒购自美国Invitrogen公司,逆转录试剂盒购自美国Promega公司,PCR试剂盒购自上海生物工程有限公司,溴化乙锭(EB)、琼脂糖、氯仿、无水乙醇、异戊醇和异丙醇等由新疆医科大学基础医学院科研中心提供;PCR扩增仪和DC 2000凝胶成像分析仪为美国Bio-Rad公司生产。
1.3 RT-PCR法检测 MMP-2和 MMP-9mRNA 阳性表达率
1.3.1 组织标本中总RNA的提取及其浓度检测
按照Trizol试剂盒的操作步骤提取组织标本总RNA,于紫外分光光度计下分别测定提取的1μg RNA在260和280nm处的吸光度A260和A280值,计算A260/A280比值,使其在1.8~2.1以保证所提取的RNA的浓度和纯度。取5μL RNA于1.2%琼脂糖凝胶中进行电泳,凝胶成像分析仪观察提取的RNA 18S和28S条带,确保所提RNA的质量。
1.3.2 合成cDNA 在1μL总RNA标本中分别加引物1μL和双蒸水9μL,将其混匀后72℃恒温温浴10min后取出,将混合液置于冰上,依次加dNTP 2μL、MgCl24μL、RNA酶抑制剂0.5μL、10×缓冲液2μL和逆转录酶0.5μL混匀,42℃恒温1h,95℃恒温5min,取出并放置在冰上,再加入双蒸水80μL使最终逆转录产物体积为100μL。
1.3.3 PCR反应 向6μL双蒸水中依次加入目的基因正、反向引物各1μL和2倍浓度的PCR试剂盒反应液10μL,再加已合成的cDNA 2μL,使PCR反应体系终体积为20μL。各基因引物序列、产物大小和PCR反应温度值见表1。

表1 MMP-2、MMP-9和GAPDH的引物序列和PCR反应条件Tab.1 Primer sequences of MMP-2,MMP-9and GAPDH and reaction conditions of PCR
1.3.4 PCR扩增产物的判定 于5μL PCR反应产物中加入缓冲液 (buffer)1μL后,行2%琼脂糖凝胶电泳,在DC 2000凝胶成像分析仪下观察目的基因条带并保存图像。在499bp附近出现亮色条带,则 MMP-2表达阳性,否则为阴性;在308bp附近出现亮色条带,则MMP-9表达阳性,否则为阴性。
1.4 Western blotting法检测 MMP-2和 MMP-9蛋白表达
选用Trizol法制备蛋白样品,测定蛋白水平,电泳完毕后转膜,然后封闭蛋白膜,分别加一抗孵育和二抗孵育,孵育结束后给予化学发光、显影及定影,用凝胶图像处理系统分析目标条带的相对分子质量和A值。
1.5 统计学分析
采用SPSS 16.0统计软件进行统计学分析。癌组织和癌旁正常组织中 MMP-2和 MMP-9阳性表达率比较采用χ2检验。MMP-2和MMP-9阳性表达率的相关性分析采用Pearson相关分析。
2 结 果
2.1 RT-PCR法检测癌组织和癌旁正常组织中MMP-2mRNA 和 MMP-9mRNA 表达率
100例癌组织标本中MMP-2mRNA阳性表达率为 89.0% (89/100),对应癌旁正常组织中MMP-2mRNA的阳性表达率为76.0%(76/100),MMP-2mRNA在癌组织中的阳性表达率高于癌旁正 常组织(χ2=5.853,P=0.016);癌组织中MMP-9mRNA阳性表达率为48.0% (48/100),对应癌旁正常组织中MMP-9mRNA的阳性表达率为16.0% (16/100),MMP-9mRNA 在癌组织中的阳性表达率高于癌旁正常组织 (χ2=23.529,P=0.000)。见图1。

图1 癌组织和癌旁正常组织中 MMP-2mRNA和MMP-9 mRNA表达电泳图Fig.1 Electrophoregram of expreesions of MMP-2mRNA and MMP-9mRNA in tumor tissue and adjacent normal tissue
2.2 Western blotting法检测癌组织和癌旁正常组织中MMP-2和MMP-9蛋白表达水平
随机选取5例标本,Western blotting检测结果与对应的RT-PCR检测结果基本一致。见图2。
2.3 不同临床病理特征食管鳞状细胞患者癌组织中 MMP-2和MMP-9mRNA阳性表达率
MMP-2mRNA和 MMP-9mRNA阳性表达率与肿瘤浸润深度有关联 (P<0.05),与肿瘤淋巴结转移、患者的性别、年龄和肿瘤分化程度均无关联 (P>0.05)。见表2。
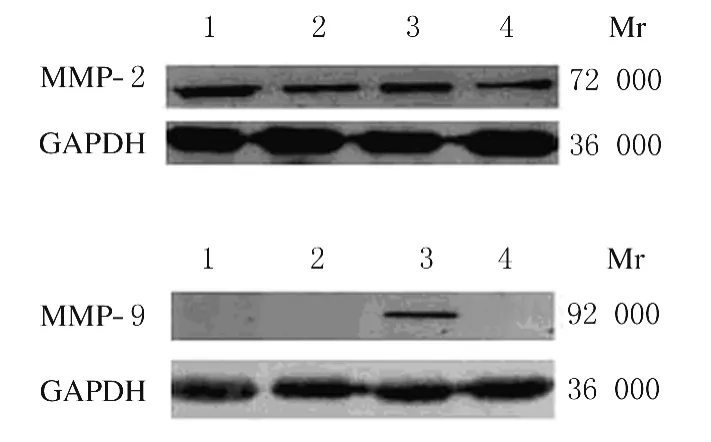
图2 癌组织和癌旁正常组织中MMP-2和 MMP-9蛋白表达电泳图Fig.2 Electrophoregram of expressions of MMP-2and MMP-9proteins in tumor tissue and adjacent normal tissue
2.4 癌组织中 MMP-2mRNA 和 MMP-9mRNA阳性表达率的相关性分析
Pearson相关分析结果显示:MMP-2mRNA与MMP-9mRNA阳性表达率呈正相关关系 (r=0.274,P=0.006)。见表3。
3 讨 论
MMPs是一类能够降解ECM和基底膜组分的蛋白水解酶,其家族成员目前已超过20个,根据各自降解底物的特异性和自身结构的不同分为胶原酶、间质溶解素和明胶酶。关于MMP-2在各种肿瘤组织及正常组织中的表达情况有多位学者进行了研究,因所采用的研究方法不同,其研究结果不尽相同,甚至有些结果是截然相反的。李秀梅等[4]采用RT-PCR法检测食管癌组织中MMP-2表达结果显示:食管癌组织中MMP-2的表达较正常组织增高。多位学者[5-8]采用免疫组织化学法检测食管癌组织中MMP-2的表达结果显示:MMP-2在食管癌组织中的表达水平明显高于癌旁正常组织。本研究结果显示:食管鳞状细胞癌组织中的 MMP-2 mRNA的表达水平明显高于癌旁正常组织,并且MMP-2mRNA的表达与肿瘤浸润深度有关联。本研究结果与上述研究结果一致,故认为MMP-2在食管癌发生和浸润性生长过程中发挥了重要作用。Hong等[9]和 Koskensalo等[10]应用免疫组织化学法检测结直肠癌组织中 MMP-2的表达,结果显示:MMP-2与结直肠癌的淋巴结转移无关联。Hwang等[11]应用免疫组织化学法观察胃癌组织中MMP-2的表达结果显示:MMP-2与肿瘤淋巴结转移无关。于维娜等[12]应用免疫组织化学法检测食管癌组织中 MMP-2的表达结果显示:MMP-2蛋白表达与淋巴结转移无关联。本研究结果显示:MMP-2的表达与肿瘤淋巴结转移无关联,与上述研究结果一致,故认为MMP-2在食管癌淋巴结转移方面不发挥关键作用。

表2 不同临床特征食管鳞状细胞癌患者癌组织中MMP-2mRNA和MMP-9mRNA阳性表达率Tab.2 Positive expression rates of MMP-2mRNA and MMP-9mRNA in tumor tissue of patients with different clinical characteristics
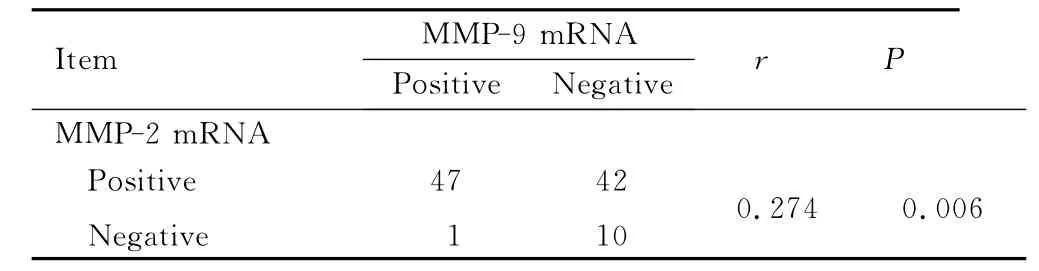
表3 癌组织中MMP-2mRNA和MMP-9mRNA表达水平的相关性Tab.3 Correlation between expressions of MMP-2mRNA and MMP-9mRNA in tumor tissue
近年研究[13-14]显示:MMPs在多种肿瘤组织中均高表达,且与肿瘤浸润有关联。MMP-9在胃癌组织中的表达水平高于癌旁正常胃黏膜组织,且MMP-9的表达与胃癌浸润深度有关联;Chen等[15]对食管癌的研究发现:胎盘生长因子(PLGF)促进食管癌的转移是通过对MMP-9的激活实现的。Li等[16]研究发现:环孢菌素A/MMP-9信号通路有助于食管癌细胞的恶性转变。有关食管癌的其他研究[17]也显示:癌组织中MMP-9的表达水平高于癌旁正常组织,且其表达与食管癌浸润深度有关联。本研究结果显示:癌组织中 MMP-9 mRNA阳性表达率明显高于癌旁正常组织,并且其表达与肿瘤浸润深度有关联。本研究结果与上述各研究结论一致,故认为MMP-9在食管癌发生及浸润性生长过程中发挥了重要作用。Koskensalo等[10]应用免疫组织化学法对结直肠癌的研究显示:MMP-9的表达与肿瘤淋巴结转移无关联。Durlik等[18]应用免疫组织化学法对胰腺癌的研究发现:MMP-9的表达与淋巴结转移无关联。Oshima等[19]应用RT-PCR法对结直肠癌的研究发现:MMP-9与肿瘤淋巴结转移无关联。Lu等[20]应用免疫组织化学法对食管癌的研究发现:MMP-9与淋巴结转移无关联。本研究结果显示:MMP-9的表达与肿瘤淋巴结转移无关联,与上述研究结果一致,故认为MMP-9在食管癌淋巴结转移方面不发挥关键作用。
本研究结果显示:MMP-2与 MMP-9mRNA的表达呈正相关关系,说明 MMP-2mRNA和MMP-9mRNA的表达之间有相互促进的作用,可能相互协同促进肿瘤的发生和进展。
综上所述,食管癌的发生发展不是单一基因控制的反应过程。本研究结果显示:MMP-2和MMP-9可能促进了食管鳞状细胞癌的发生,同时可能增强了食管鳞状细胞癌的浸润生长能力;MMP-2和 MMP-9与食管癌的淋巴结转移可能均无关联;MMP-2和 MMP-9表达水平的上调可能是食管癌发病的机制之一;对 MMP-2和 MMP-9的联合检测可评价食管鳞状细胞癌的浸润生长程度。本研究结果为进一步阐明食管癌的发生发展和转移机制提供了实验依据。
[1]Jemal A,Bray F, Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61 (2):69-90.
[2]张思维,张 敏,李光琳,等.2003-2007年中国食管癌发病与死亡分析 [J].中国肿瘤,2012,21 (4):241-247.
[3]Wei WQ,Yang J,Zhang SW,et al.Analysis of the esophageal cancer mortality in 2004-2005and its trends during last 30years in China [J].Zhonghua Yu Fang Yi Xue Za Zhi,2010,44 (5):398-402.
[4]李秀梅,陈 艳,王洪江,等.哈萨克族食管癌中MMP-1、MMP-2、MMP-7、TIMP-1和 MTA1的表达及其临床病理意义 [J].癌变·畸变·突变,2011,23 (3):190-193,198.
[5]刘 敏,郭晓娟,张红霞,等.食管癌中EGFRvⅢ、MMP-2的表 达特点 及意 义 [J].现代肿 瘤医学,2010,18 (1):62-66.
[6]陈超伍,马洪升.基质金属蛋白酶在食管癌组织中的表达及与微量元素含量之间的关系 [J].世界华人消化杂志,2010,18 (19):1995-2000.
[7]岳庆峰,向 明,李方明,等.食管癌组织DcR3、MMP-2表达及其对生存率的影响 [J].中国癌症杂志,2010,20 (10):745-750.
[8]Li Y,Ma J,Guo Q,et al.Overexpression of MMP-2and MMP-9in esophageal squamous cell carcinoma [J].Dis Esophagus,2009,22 (8):664-667.
[9]Hong SW, Kang YK, Lee B, et al. Matrix metalloproteinase-2and-7expression in colorectal cancer [J].Korean Soc Coloproctol,2011,27 (3):133-139.
[10]Koskensalo S,Hagström J,Linder N,et al.Lack of MMP-9expression is a marker for poor prognosis in Dukes’B colorectal cancer[J].BMC Clin Pathol,2012,12 (7):12-24.
[11]Hwang TL,Lee LY,Wang CC,et al.Claudin-4expression is associated with tumor invasion, MMP-2and MMP-9 expression in gastric cancer [J].Exp Ther Med,2010,1 (5):789-797.
[12]于维娜.MMP-2、TIMP-2、PINCH在食管鳞状细胞癌中的表达意义及相关性研究 [D].石家庄:河北医科大学,2011.
[13]董刚强,王永占,蒲 红,等.基质金属蛋白酶MMP-9在胃癌中的表达及其临床意义 [J].肿瘤预防与治疗,2012,25 (4):240-242.
[14]陈其军,吕自力,党裔武,等.MMP-9和TIMP-1在胃癌组织中的表达失衡及其与ZHX2的相关性 [J].世界华人消化杂志,2012,20 (20):1832-1837.
[15]Chen Y,Jiang T,Mao A,et al.Esophageal cancer stem cells express PLGF to increase cancer invasion through MMP9 activation[J].Tumour Biol,2014,35 (12):12749-12755.
[16]Li Y,Guo H,Dong D,et al.Expression and prognostic relevance of cyclophilin A and matrix metalloproteinase 9in esophageal squamous cell carcinoma [J].Diagn Pathol,2014,18 (8):207-212.
[17]关耀武.食管鳞状细胞癌组织中VEGF、MMP-9的表达及意义 [J].山东医药,2011,51 (6):86-87.
[18]Durlik M,Gardian K.Metalloproteinase 2and 9activity in the development of pancreatic cancer[J].Pol Przegl Chir,2012,84 (8):377-382.
[19]Oshima T, Kunisaki C, Yoshihara K, et al.Clinicopathological significance of the gene expression of matrix metalloproteinases and reversion-inducing cysteine-richprotein with Kazal motifs in patients with colorectal cancer:MMP-2gene expression is a useful predictor of liver metastasis from colorectal cancer [J].Oncol Rep,2008,19 (5):1285-1291.
[20]Lu CL,Ji Y,Ge D,et al.The expression of CXCR4and its relationship with matrix metalloproteinase-9/vascular endothelial growth factor in esophageal squamous cell cancer[J].Dis Esophagus,2011,24 (4):283-290.
