DNMT1基因多态性对胃癌患者术后生存时间的影响
2015-11-28贾志芳尤丽丽曹东慧曹雪源
武 兴,贾志芳,尤丽丽,曹东慧,王 川,曹雪源,姜 晶
(1.吉林大学第一医院临床流行病学研究中心,吉林 长春 130021;2.吉林大学第一医院胃结直肠外科,吉林 长春 130021)
胃癌在我国恶性肿瘤中发病率居第2位,并且发现时以中晚期为主,预后较差,5年生存率仅为20%左右[1]。研究[2-3]发现:遗传变异特别是基因的单核苷酸多态性(single nucleotide polymorphisms,SNPs)与胃癌的发生、发展和预后密切相关。
近年来,随着表观遗传学的兴起,与基因转录过程相关酶的基因多态性研究已成为热点。DNA甲基转移酶1(DNA methyltransferase1,DNMT1)是DNA甲基化过程的关键酶,对新合成的DNA链进行甲基化修饰以维持其甲基化水平,其功能的紊乱可引起抑癌基因的高甲基化而失活,从而导致肿瘤的发生。DNMT1在许多恶性肿瘤如胃癌和乳腺癌中表达升高,且表达强度与肿瘤的分化程度、临床分期相关,提示DNMT1可能参 与 了 肿 瘤 的 发生发展过程[4-5]。 已有研究[6-7]显示:DNMT1基因多态性与乳腺癌、卵巢癌等肿瘤易感性有密切关联。既往国内外研究大多只关注于DNMT1基因变异与肿瘤发生的关系,但目前尚未见DNMT1基因多态性与胃癌预后的相关报道。本研究选择DNMT1基因上的5个标签SNPs,旨在探讨SNP与胃癌预后的关系,以期寻找预测胃癌预后的可能的标志物,为个体化治疗提供合理的参考依据。
1 资料与方法
1.1 研究对象的选择 选取2008年1月—2010年12月在吉林大学第一医院确诊为胃癌的患者共447例纳入研究队列。纳入标准:来自吉林省长春地区,中国北方汉族人,年龄30~90岁,在本院胃结直肠外科进行胃癌根治术治疗,并经组织病理学确诊为胃癌 (非贲门癌)的患者。排除标准:年龄小于30岁或大于90岁者,非中国汉族北方人群,并发其他严重疾病可能会影响到胃癌病情进展者。本研究获得吉林大学第一医院伦理委员会批准,所有研究对象签署知情同意书同意参加研究并捐献4mL EDTA抗凝血。
1.2 术后随访管理 由随访员于患者术后3个月、6个月和之后每6个月1次对所有研究对象进行电话随访,收集胃癌患者术后治疗、复发进展和死亡等资料,患者最后一次随访截止日期为2014年11月24日,全部患者完成了5.8~76.7个月的随访 (中位随访时间为51.3个月)。生存分析时,观察终点为患者由于胃癌复发或转移引起死亡,其他与胃癌无关的心脑血管疾病等导致的死亡均按失访处理。生存时间定义为从手术日期到死亡日期 (如果对象死亡),或到末次随访时间 (如果尚存活),或到上一次有随访信息的时间 (如果失访)。若研究对象出院后至第一次随访 (术后3个月)间失访或死于手术并发症,生存分析时予以排除。
1.3 胃癌患者基因组DNA的提取 采集422例胃癌患者外周静脉血各4mL,分离出白细胞层,采用Axyprep血基因组DNA提取试剂盒(Axygen公司,美国)提取外周血DNA。采用NanoDrop 2000核酸测定仪 (Thermo Fisher Scientifc公司,美国)检测DNA浓度及纯度,以A280/A260比值 (比值应在1.8~2.0之间,若明显降低,说明样本已被蛋白污染,需重新制备)来判断DNA样本纯度,计算DNA样本的浓度,标准化到20μg·L-1待用。将提取好的DNA置于-80℃冰箱中恒温保存待用。
1.4 SNPs位点的选择和分型 应用SNP browserTMv 4.0软件筛选中国汉族人群DNMT1基因的标签SNPs,要求其最小等位基因频数(MAF)>0.05且r2>0.8[8],共27个SNPs位点满足MAF>0.05,其中21个SNPs显示与标签SNPs完全连锁不平衡 (D’=1且r2>0.8),并且由于rs8108166与rs2228611完全连锁不平衡(D’=1且r2=1),故将rs8108166予以排除。最终选 择了 rs16999593、rs10420321、rs2288349、rs2228611和rs2228612共5个位点。采用TaqMan技术 (Applied Biosystems公司,美国)进行基因分型,由此避免了常规PCR操作中带来的诸多污染源,可保证结果的良好重复性。BIORAD S1000TM 热循环仪 (Bio-Rad公司,美国)设置的反应条件为:95℃、10min,95℃、15s,60℃、1min,共40个循环。
1.5 统计学分析 采用SPSS 18.0软件进行统计学处理。采用Kaplan-Meier法计算同一位点不同基因型患者的术后中位生存时间并绘制生存曲线,Log-rank检验分析各基因型的生存曲线有无差异。Cox单因素回归模型定量计算肿瘤分化程度、临床分期等与生存的关系。在调整性别、年龄和临床分期等因素后,采用Cox多因素回归模型计算不同基因型的胃癌患者生存率的风险比 (hazard ratio,HR)及95%可信区间 (confidence interval,CI)。检验水准α=0.05。
2 结 果
2.1 研究对象的一般特征 447例胃癌手术治疗的患者中,有22例患者围手术期死于手术并发症,3例术后出院后即失访,因此422例研究对象纳入生存分析。其中,男性305例 (72.3%),女性117例 (27.7%);手术时年龄中位数为61岁(35~90岁),纳入患者的一般特征见表1。
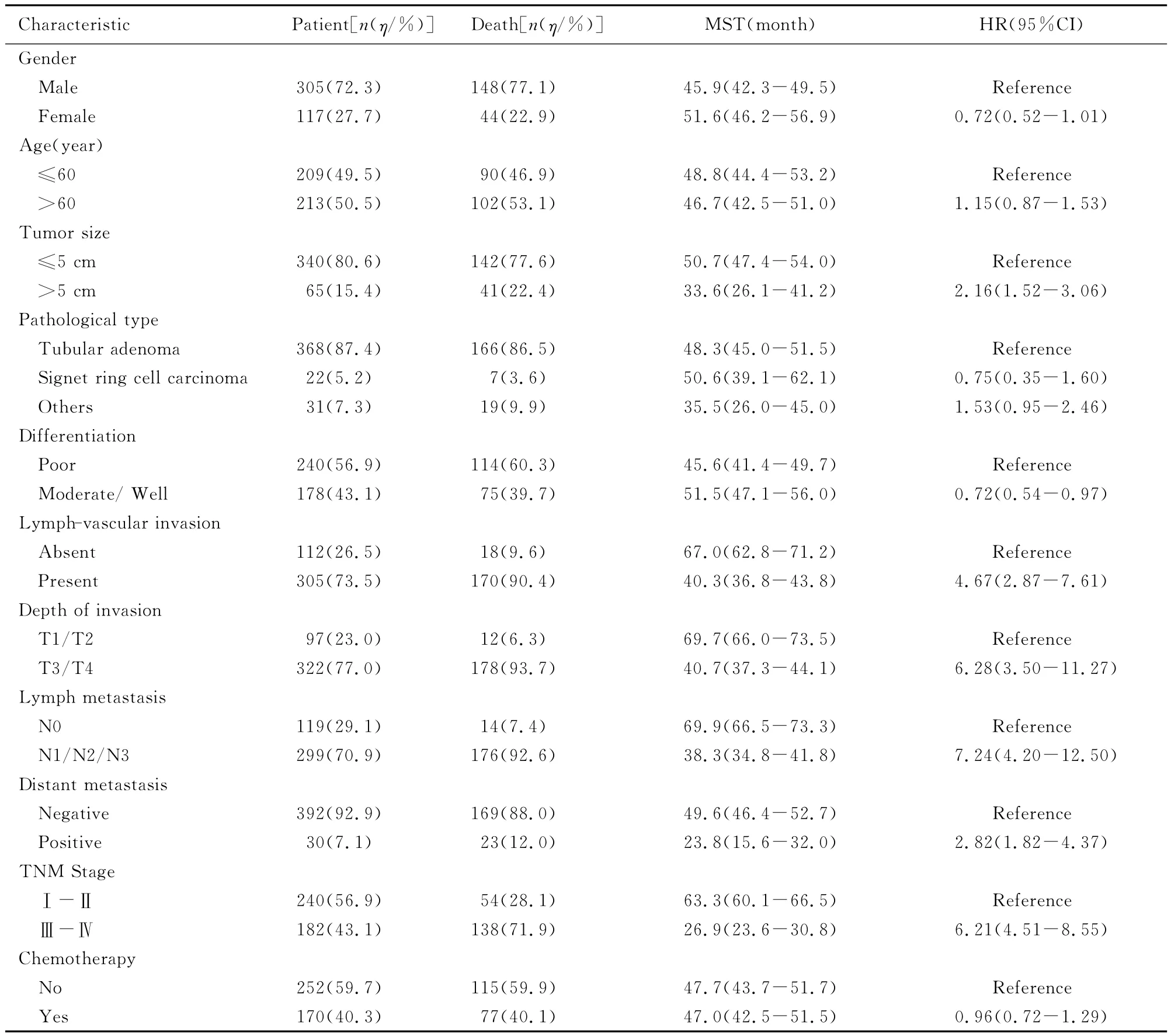
表1 不同临床病理特征胃癌患者的生存时间Tab.1 Survival time of patients with different clinicopathological characteristics
截止到最后一次随访,422例研究对象的中位随访时间为51.3个月,最长为76.7个月。期间有175例患者死于胃癌,10例患者死于其他原因,7例患者失访,230例患者仍存活。单因素Cox回归模型显示:肿瘤直径>5cm、有脉管浸润、分化程度低的患者术后死亡风险升高。随着肿瘤浸润深度、淋巴结转移程度、远处转移程度和临床分期的升高胃癌患者的中位生存时间明显缩短 (P<0.01)。未发现患者的年龄、性别、胃癌病理类型及有无术后化疗与生存时间有关联 (P>0.05)。
2.2 DNMT1基因多态性对胃癌预后的影响Log-rank检验结果显示:携带rs2228611GA/AA基因型的胃癌患者较携带GG基因型的患者术后死亡风险明显降低 (Log-rank P=0.006,图1A)。在调整了年龄、性别和临床分期后,携带rs2228611GA/AA基因型的患者术后死亡风险较GG基因型的患者降低了34% (HR:0.66,95%CI:0.49~0.88)。 与 rs2228611 相 反, 携 带rs2288349GA/AA基因型患者术后死亡风险是GG基因型患者的1.33倍 (HR:1.33,95%CI:1.00~1.77,图 1B)。未发 现其他3 个 位 点(rs16999593、rs10420321和rs2228612)与胃癌患者术后的生存有关联 (表2)。
2.3 胃癌患者预后的多因素Cox回归分析 为了鉴别影响胃癌预后的独立因素,采用逐步回归的方法分别将rs2228611和rs2288349基因多态性与胃癌术后患者生存的关系进行多因素Cox回归分析(表3),将单因素分析结果中具有统计学意义的变量纳入多因素回归模型。肿瘤直径大小、有无脉管浸润、临床分期和rs2228611(GA+AA vs GG)是影响胃癌预后的独立因素,且rs2228611 GA/AA基因型与胃癌术后死亡风险降低有关(HR:0.68,95%CI:0.50~0.92)。经多因素回归模型调整后,虽然rs2288349GA/AA基因型患者术后死亡风险是GG基因型患者的1.37倍(HR:1.37,95%CI:0.98~1.82),但差异无统计学的意义 (P=0.068)。
3 讨 论

图1 不同DNMT1基因型胃癌患者术后Kaplan-Meier生存曲线Fig.1 Kaplan-Meier survival curves of gastric cancer patients with different genotypes of DNMT1after operation
临床上影响胃癌预后的因素有很多,即使在相同病期和治疗条件下,患者的预后也不尽相同,提示患者自身的遗传因素在预后中发挥了重要作用。SNP是人类基因组中最常见的遗传变异,因此,本研究重点讨论DNMT1基因多态性对胃癌患者术后长期生存的影响。本研究结果显示:携带DNMT1rs2228611位点GA/AA基因型的胃癌患者,术后死亡风险较GG基因型携带者降低34%,在多因素分析调整了混杂因素可能对生存的影响后结果无变化,提示A等位基因在术后生存中可能扮演了一个保护性角色。
DNA甲基化是常见的表观遗传修饰,由DNMTs家族催化,包括DNMT1、DNMT3a和DNMT3b 等[9]。DNMT1基因位于染色体19p13.2,全长62000bp,由40个外显子组成,是DNA进行复制修复并维持其正常甲基化的关键酶。许多研究结果[10]显示:DNMT1与DNA甲基化异常有关,且二者与肿瘤的发生、发展关系密切。DNMT1蛋白表达水平上升,催化抑癌基因的启动子发生高甲基化,致使抑癌基因沉默,从而导致包括胃癌在内的肿瘤发生[11]。近年来研究[12]发现:多种抑制DNMT1活性的胞苷类似物,能降低和消除DNMT1表达,可有效地诱导并稳定p16等抑癌基因的表达,发挥治疗肿瘤的作用。除此之外也有研究[13]提示:胃癌组织中过度表达 miR 200b和miR 200c,可以直接靶向作用于SP1(DNMT1的反式激活因子)、DNMT3a和DNMT3b基因,使 DNMT1、DNMT3a 和DNMT3b的表达水平明显降低,引起抑癌基因p16、RASS1A1 和E-cadherin的再表达。因此DNMT1低表达可以使被沉默的抑癌基因表达恢复,有可能延缓肿瘤的发生和进展。rs2228611位点位于DNMT1基因第17外显子 (NCBI RNA序列号NM_001379.2)上,虽然G到A的变异为同义突变 (CCG→CCA,脯氨酸→脯氨酸),但是SNP 功能预测工具 SNPinfo[14]和 F-SNP[15]显示:G到A的变异可以降低外显子剪切增强子SF2/ASF和SRp55与靶序列的结合,降低DNMT1正常剪切本的水平从而降低DNMT1蛋白的表达。

表2 不同DNMT1SNPs基因型胃癌患者的预后Tab.2 Prognosis of gastric cancer patients with different DNMT1SNPs genotypes
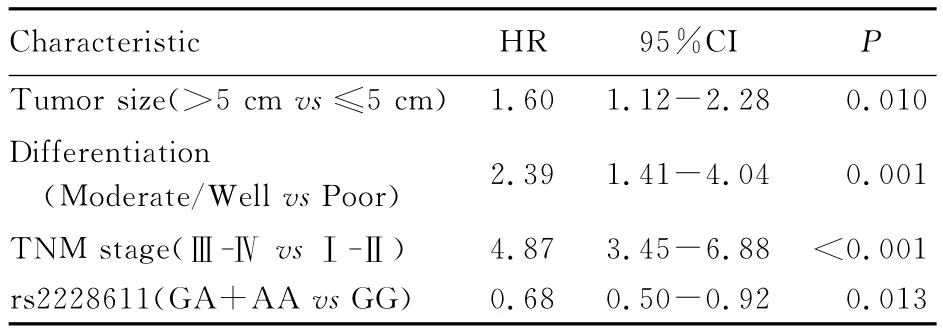
表3 与胃癌患者预后有关联的影响因素Tab.3 Influencing factors related to prognosis of patients with gastric cancer
Adrianna等[16]研究发现:在rs2228611位点携带AA/AG基因型的波兰女性中,卵巢癌发病风险下降;另外,Ye等[17]研究发现:rs8101866携带T等位基因的人群乳腺癌发病风险下降,由于rs8101866和rs2228611有完全的连锁不平衡(D’=1,r2=1),表明rs2228611携带 A等位基因的人群乳腺癌发病风险下降,证明A等位基因在肿瘤发生中起到了保护性作用。本研究前期易感性研究结果[18-19]虽未发现rs2228611位点基因多态性与胃癌易感性有关,但在预后研究中发现A等位基因具有保护意义,由此推测rs2228611位点G到A的变异可以通过降低DNMT1表达水平从而抑制胃癌的进展和转移,延长患者的生存时间。
综上所述,DNMT1基因多态性对胃癌患者术后长期生存有影响。在rs2228611位点,携带GA/AA突变型基因是胃癌预后的保护因素,提示在中国北方汉族人群中DNMT1基因多态性可以作为预测胃癌预后的分子标志物。但DNMT1 rs2228611位点多态性的存在是否导致DNA甲基化水平的改变,进而影响胃癌患者的预后,尚需扩大样本量并对不同基因型的功能开展研究进行验证。
[1]Ferlay J,Soerjomataram I, Dikshit R,et al. Cancer incidence and mortality worldwide:Sources,methods and major patterns in GLOBOCAN 2012 [J].Int J Cancer,2015,136 (5):E359-386.
[2]Snaith A,El-Omar EM.Helicobacter pylori:host genetics and disease outcomes [J].Expert Rev Gastroenterol Hepatol,2008,2 (4):577-585.
[3]Zhou J,Liu ZY,Li CB,et al.Genetic polymorphisms of DNA repair pathways influence the response to chemotherapy and overall survival of gastric cancer [J].Tumour Biol,2014,36 (4):3017-3023.
[4]Ksiaa F,Ziadi S,Dhiab MB,et al.Increased DNA methyltransferase 1protein expression correlates significantly with intestinal histological type and gender in gastric carcinomas[J].Adv Med Sci,2014,60 (1):50-57.
[5]Shi J F,Li XJ,Si XX,et al.ERalpha positively regulated DNMT1expression by binding to the gene promoter region in human breast cancer MCF-7cells [J].Biochem Biophys Res Commun,2012,427 (1):47-53.
[6]Sun MY,Yang XX,Xu WW,et al.Association of DNMT1 and DNMT3Bpolymorphisms with breast cancer risk in Han Chinese women from South China [J].Genet Mol Res,2012,11 (4):4330-4341.
[7]Mostowska A,Sajdak S,Pawlik P,et al. DNMT1,DNMT3Aand DNMT3Bgene variants in relation to ovarian cancer risk in the Polish population [J].Mol Biol Rep,2013,40 (8):4893-4899.
[8]De La Vega FM.Selecting single-nucleotide polymorphisms for association studies with SNP browser software [J].Methods Mol Biol,2007,376:177-193.
[9]Jeltsch A. Molecular enzymology of mammalian DNA methyltransferases [J].Curr Top Microbiol Immunol,2006,301:203-225.
[10]Subramaniam D,Thombre R, Dhar A,et al. DNA methyltransferases:a novel target for prevention and therapy [J].Front Oncol,2014,4:80.
[11]Dhe-Paganon S,Syeda F,Park L.DNA methyl transferase 1:regulatory mechanisms and implications in health and disease[J].Int J Biochem Mol Biol,2011,2 (1):58-66.
[12]Singh V,Sharma P,Capalash N.DNA methyltransferase-1 inhibitors as epigenetic therapy for cancer[J].Curr Cancer Drug Targets,2013,13 (4):379-399.
[13]Tang H,Deng M,Tang Y,et al.miR-200band miR-200c as prognostic factors and mediators of gastric cancer cell progression[J].Clini Cancer Res,2013,19 (20):5602-5612.
[14]Xu Z, Taylor JA. SNPinfo:integrating GWAS and candidate gene information intofunctional SNP selection for genetic association studies [J].Nucleic Acids Res,2009,37 (Web Server issue):W600-605.
[15]Lee PH,Shatkay H.F-SNP:computationally predicted functional SNPs for disease association studies [J].Nucleic Acids Res,2008,36 (suppl 1):D820-D824.
[16]Mostowska A,Sajdak S, Pawlik P,et al. DNMT1,DNMT3Aand DNMT3Bgene variants in relation to ovarian cancer risk in the Polish population[J].Mol Biol Rep,2013,40 (8):4893-4899.
[17]Ye C,Beeghly-Fadiel A,Lu W,et al.Two-stage casecontrol study of DNMT-1and DNMT-3Bgene variants and breast cancer risk [J].Breast Cancer Res Treat,2010,121 (3):765-769.
[18]Jiang J,Jia Z,Cao D,et al.Polymorphisms of the DNA methyltransferase 1associated with reduced risks of Helicobacter pylori infection and increased risks of gastric atrophy [J].PLoS One,2012,7 (9):e46058.
[19]孙 婷,李 平,张 梅.晚期胃癌维持治疗现状 [J].吉林中医药,2014,34 (10):1077-1080.
