GST-hZimp10融合蛋白的重组及抗体制备
2015-11-28汪小菀王冰瑜宋润敏
杨 柳,汪小菀,王冰瑜,宋润敏,李 江
(1.吉林大学口腔医院口腔修复科,吉林 长春 130021;2.东北师范大学生命科学学院肿瘤信号转导实验室,吉林 长春 130024)
hZimp10是一种新的激活STAT的蛋白抑制剂 (protein inhibitor of activated STAT,PIAS)类似蛋白[1]。hZimp10全长定位于人类第10号染色体上,hZimp10和其他PIAS蛋白一样具有 Miz结构域[2-3],且与其他PIAS蛋白的锌指结构相比,hZimp10具有高度的的相似性,因此研究者将这一蛋白定义成在人类10号染色体上包含锌指结构的Miz1的PIAS类似蛋白 (hZimp10)。有研究[4]表明:hZimp10选择性地表达在人类的卵巢、睾丸和前列腺组织中。作为一种新的PIAS类似蛋白,hZimp10已经被证明是雄激素受体 (androgen receptor,AR)的共激活因子,与AR协同作用于AR信号通路[4]。有研究[5-6]表明:hZimp10 可 增强Smad3/Smad4蛋白复合物和P53等的转录活性。
目前对于hZimp10是否参与肿瘤的抑制作用,是否能够促进癌细胞凋亡,及其与生殖系统功能的相关性尚需进一步研究。而研究一种新的蛋白质的作用机制,抗体是最有力的工具之一。本研究将人hZimp10-N128基因插入 pGEX-4T-1中构建pGEX-4T-1-hZimp10重组表达载体,获得了大量的GST-hZimp10融合蛋白,利用纯化GST-hZimp10融合蛋白免疫实验用兔,制备hZimp10蛋白高效价抗体。
1 材料与方法
1.1 细胞、动物、主要试剂和仪器 人前列腺癌细胞系LNCaP、DU145、大肠杆菌DH5α(克隆宿主)、BL21(表达宿主)和pGEX-4T-1由东北师范大学遗传与细胞研究所提供。新西兰大白兔购自吉林大学白求恩医学院医学动物实验中心。T4 DNA连接酶及各种限制性内切酶均为日本TaKaRa公司产品,琼脂糖凝胶回收DNA试剂盒为美国QIAGEN公司产品,低相对分子质量蛋白Marker购自上海生物工程有限公司,IPTG购自华美生物工程公司,HRP标记的羊抗兔IgG购自美国Proteintech公司,谷胱甘肽Sepharose 4B购自美国Pharmacia公司,弗氏佐剂购自北京鼎国生物工程有限公司。其他常规化学试剂均为分析纯产品。
PCR仪 (杭州博日科技有限公司),96孔板(美国Corning Costar公司),FLUOstar Optima型多功能酶标仪 (德国BMG Technology公司),离心机 (韩国DAIHAN公司),超声波细胞粉碎仪 (宁波新芝生物科技股份有限公司),细菌摇床(哈尔滨市东联电子技术开发有限公司)。
1.2 PCR-PMD18-T/hZimp10重组质粒的构建从GenBank获得hZimp10基因全长,基因序列号为 AY235683。以pcCDNA3.1-Flag-hZimp10为模板,上游引物P1:5′-GGATCCATGAATTCTATG GACAGG(下划线部分为BamHⅠ和EcoRⅠ酶 切位点);下游引物P2:5′-CTCGAGAGGGGG CTGCAT GGGGAG (下划线部分为XhoⅠ酶切位点)。应用PCR进行扩增。PCR琼脂凝胶电泳回收扩增的片段,与PMD18-T载体连接,将连接产物转入感受态大肠杆菌DH5α中,在含Amp+琼脂平板上挑选克隆,以碱裂解法小提重组质粒后,以BamHⅠ和XhoⅠ 双酶切鉴定。
1.3 原核表达载体pGEX-4T-1的构建 将含有hZimp10基 因 N-128片段的pMD18-T质粒经BamHⅠ和XhoⅠ 双酶切后 (片段长度约400bp),利用回收试剂盒获得hZimp10基因该区片段,同时利用相同的酶处理质粒pGEX-4T-1(约4900bp)。然后将回收的hZimp10基因N-128片段和经酶切的载体pGEX-4T-1在T4DNA连接酶作用下于16℃连接过夜。选择酶切鉴定确认重组成功的质粒送上海生工生物技术服务有限公司进行DNA测序。
1.4 GST-hZimp10融合蛋白的诱导表达和纯化重组质粒PGEX-4T-1/hZimp10 转化大肠杆菌BL21,挑取单菌落接入LB/Ampr培养基中,37℃振摇培养过夜。次日,将培养物按1∶50的比例转接于含Amp+的LB培养基中,继续在37℃摇床培养至对数生长中期。在培养液的A600为0.5~0.6时,加入IPTG至终浓度为0.08mmol·L-1,不加入IPTG者为阴性对照,置25℃继续培养4~5h。离心收集菌体,以SDS-PAGE进行鉴定GST-hZimp10融合蛋白的表达,并优化表达条件,进行大量扩增诱导。以5000r·min-1于4℃离心5min,收集菌体,用60mL冰预冷的NETN悬浮1L菌液的沉淀。用超声裂解细菌,再以9600r·min-1、于4℃离心15min,取上清,过Glutathione-Sepharose 4B柱,先以等体积洗脱缓冲液1(含 20mmol·L-1谷胱甘肽、50mmol·L-1Triscl,pH =8.0)洗脱,收集洗脱液,再以等体积洗脱缓冲液2(含100mmol·L-1谷胱甘肽)洗2次,收集洗脱液,SDS-PAGE鉴定纯化产物。结果对应相对分子质量大小,并以条带强弱显示。
1.5 兔抗hZimp10抗血清的制备 以纯化的GST-hZimp10融合蛋白免疫雄性新西兰大白兔,初次免疫用500μg融合蛋白,与等体积的完全弗氏佐剂充分混匀乳化后背部皮下多点注射。免疫前取耳静脉血分离血清作为免疫前的血清对照。2周后进行第1次加强免疫,500μg纯化的GST-hZimp10融合蛋白与不完全弗氏佐剂等体积混匀,前后四脚掌肌肉注射。之后每隔2周加强免疫1次。于末次免疫后1周取耳血,用ELISA法测定抗体的效价,当抗体效价达到1∶100000时,颈动脉放血,收集血清。
1.6 ProteinA/G纯化抗hZimp10血清 将ProteinA/G sepharose CL-4B填料缓慢装柱,平衡柱子后加入经过稀释的抗血清,控制流速保证抗血清与填料的结合,即亲和层析使抗体结合在柱子上,经TBS洗涤2次后,加pH 2.7洗脱缓冲溶液将抗体洗脱,收集洗脱液并测定各收集管的280nm处A值,将含抗体的收集管混合,纯化后的抗体与纯化前的抗血清用SDS-PAGE和考马斯亮蓝染色鉴定。结果以条带强弱表示。
1.7 GST-hZimp10抗体效价的测定 将GST-hZimp10融合蛋白免疫前的新西兰大白兔血清作为对照,将纯化后的GST-hZimp10抗体先稀释10倍再倍比稀释后,采用间接ELISA[7]测定抗体的效价。在酶标仪上分别测492和620nm波长处测定其A值。抗体效价= (A492-A空白孔)/A620。
1.8 GST-hZimp10抗体应用于细胞中hZimp10蛋白的检测 收集培养的前列腺癌细胞LNCaP和DU145,裂解超声后用BCA蛋白定量试剂盒对其进行蛋白定量,之后将样品等蛋白量进行SDSPAGE,再电转移至硝酸纤维素膜上。以5%脱脂奶粉封闭1h,依次滴加兔抗hZimp10抗体 (室温2h、PBS洗3次)及山羊抗兔IgG2HRP(室温反应1h、PBS洗涤3次),最后加底物DAB显色,并拍照,结果以蛋白表达强度表示。
2 结 果
2.1 hZimp10 基因 N-128 片段 PCR 扩增hZimp10基因N-128编码128个氨基酸,其编码区域共384bp。应用PCR技术,通过设计引物P1/P2,从模板 pcCDNA3.1-Flag-hZimp10 扩增出了长度为384bp的片段,与预期长度相符。回收片段,琼脂凝胶电泳分析,结果见图1。
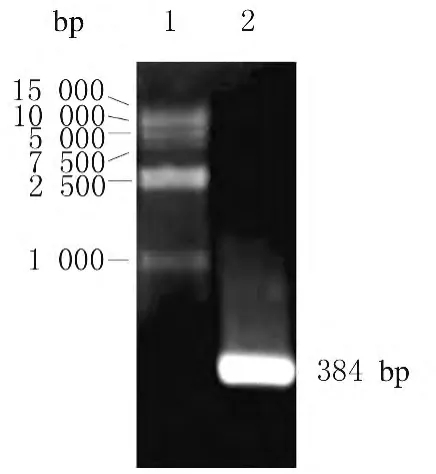
图1 PCR扩增出的hZimp10-N-128片段DNA琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoregram of hZimp10N-128 DNA amplified by PCR
2.2 重组质粒pGEX-4T-1/-hZimp10鉴定 重组质粒经BamHⅠ和XhoⅠ 双酶切后,酶切产物电泳结果分别得到约为4900和400bp的2个条带(图2和3),与测序结果 (图4)一致。验证重组质粒pGEX-4T-1-hZimp10构建正确。

图2 双酶切质粒pGEX-4T-1(BamHⅠ/XhoⅠ)琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoregram of plasmid pGEX-4T-1 digested by BamHⅠ/XhoⅠ
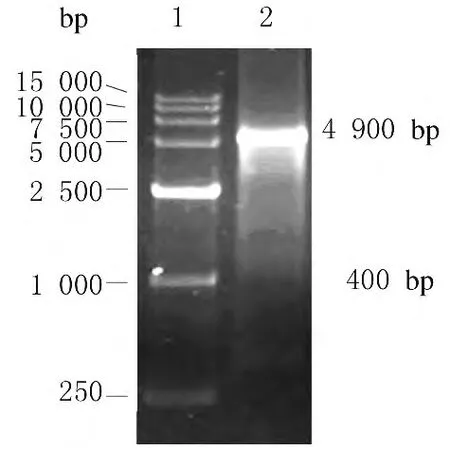
图3 重组质粒 pGEX-4T-1/hZimp10的双酶切(BamHⅠ/XhoⅠ)鉴定电泳图Fig.3 Electrophoregram of identification of recombinant plasmid pGEX-4T-1/hZimp10digested by BamHⅠ/XhoⅠ
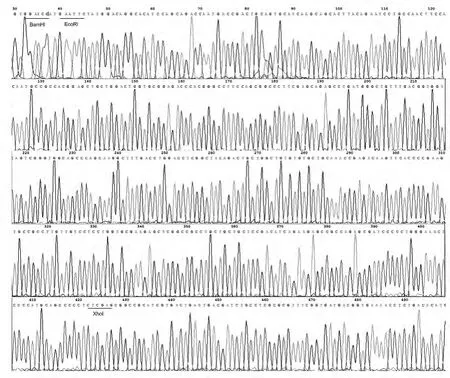
图4 重组质粒 pGEX-4T-1/hZimp10的测序结果Fig.4 Results of sequencing of recombinant plasmid pGEX-4T-1/hZimp10
2.3 GST-hZimp10融合蛋白的诱导表达 将重组质粒pGEX-4T-1/hZimp10转化大肠杆菌BL21,经LB培养后使用IPTG诱导,收集细菌裂解液,利用亲和层析技术,与谷胱甘肽-琼脂糖凝胶4B结合,通过多次洗脱纯化,获得GST-hZimp10融合蛋白和对照GST蛋白,经SDS-PAGE分析 (图5),经 Glutathione-Sepharose-4B 层 析 法 纯 化 后,获得相对分子质量约为40000的特异的GST-hZimp10融合蛋白,与预期相对分子质量相符。
2.4 GST-hZimp10抗体效价 将免疫前的新西兰大白兔血清作为对照,取末次加强免疫后第7天的血清,将GST-hZimp10抗体先稀释10倍再倍比稀释后,采用间接ELISA测定GST-hZimp10抗体效价。免疫前的兔血清未测出抗融合蛋白GST-hZimp10的抗体,GST-hZimp10抗体的滴度高达1∶100000以上。见图6。

图5 纯化的GST-hZimp10融合蛋白SDS-PAGE电泳图Fig.5 Electrophoregram of SDS-PAGE analysis of purified GST-hZimp10fusion protein

图6 间接ELISA法测定GST-hZimp10抗体的效价Fig.6 Titers of GST-hZimp10antibody detected by indirect ELISA assay
2.5 ProteinA/G纯化抗hZimp10血清 为了提高制备抗体的纯度,利用ProteinA/G纯化抗hZimp10血清。染色结果显示:与纯化前比较,本研究纯化后的样品有清晰的轻、重链带,并且无明显其他条带。见图7。
2.6 GST-hZimp10抗体血清特异性的 Western blotting鉴定 有研究[4]证明:hZimp10能够与AR协同作用于AR信号通路,使hZimp10在LNCaP细胞中转录水平增高,在DU145细胞中转录活性缺失。因此本文作者将GST-hZimp10抗体应用于LNCaP细胞株和DU145细胞株中进行Western blotting检测。制备的hZimp10抗体与LNCaP细胞株中所表达的hZimp10蛋白发生了抗原-抗体反应,在Marker指示的123000处出现了1条特异的蛋白带,在DU145细胞株中未见特异蛋白条带,证明LNCaP细胞高表达hZimp10,验证了GST-hZimp10抗体在LNCaP细胞中具有特异性。见图8。
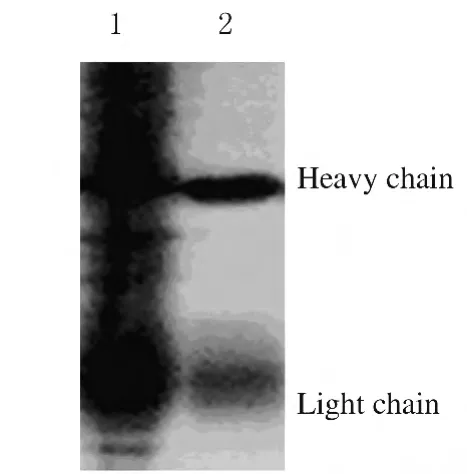
图7 ProteinA/G纯化后的hZimp10抗体SDS-PAGE分析电泳图Fig.7 Electrophoregram of SDS-PAGE analysis of purified hZimp10antibody by Protein A/G

图8 Western blotting法检测hZimp10在LNCaP和DU145细胞中表达电泳图Fig.8 Electrophoregram of expressions of hZimp10protein in LNCaP and DU145cells detected by Western blotting method
3 讨 论
近年来,人们对PIAS蛋白的研究取得了很大的进展,有研究[8-9]表明:PIAS蛋白对一些抑癌基因如P53、Smad的转录活性具有重要的调节作用。有学者[10]认为:PIAS蛋白在前列腺癌早期诊断中有潜在价值,PIAS在其他疾病中的潜在功能也相继被报道[11-13]。虽然hZimp10作为一种新的PIAS类似蛋白和其他PIAS蛋白一样可以与一些蛋白相结合,例如:P53和AR,但其很可能是通过不同的机制来调节这些蛋白的功能[14]。因此,探究hZimp10蛋白在癌细胞中的表达强度与肿瘤恶性程度的相关性可能成为生物领域的一个新的研究热点。
研究一种新的蛋白质的功能,高效价的特异性抗体是最有力的工具之一。广泛应用于蛋白质检测和功能研究中的免疫组织化学、免疫印迹和免疫沉淀等一系列技术均是基于抗原-抗体相互作用发展起来的。而在抗体制备过程中,抗体特异性最重要的影响因素之一是抗原的质量[15]。本研究利用特殊序列 (hZimp10蛋白N端128个氨基酸对应DNA片段)构建GST-hZimp10融合蛋白原核表达载体,所获蛋白用Glutathione-Sepharose 4B柱纯化,得到高效表达特异性的GST-hZimp10融合蛋白。以该融合蛋白为抗原免疫新西兰兔获得抗GST-hZimp10融合蛋白的高效价抗体,经ELISA检测抗体效价,结果表明抗体效价高达1∶100000以上。Western blotting检测结果表明:在LNCaP细胞中可检测到大小为123000的hZimp10特异性条带,而在DU145细胞中未检测到,此结果与文献[4]报道的结果一致。因此,该抗体可应用于细胞中hZimp10蛋白的检测并能有效检出hZimp10蛋白在不同细胞株中的差异表达,并可用于进一步探讨hZimp10蛋白与前列腺癌的相关性。
综上所述,本文作者成功地制备了高效价、高特异性的hZimp10多克隆抗体,为进一步探究hZimp10蛋白在癌细胞中的表达强度与肿瘤恶性程度的相关性奠定了基础,为系统研究hZimp10蛋白功能及其在肿瘤细胞增殖和凋亡中的作用机制提供了重要的工具。
[1]Shuai K,Liu B.Regulation of gene-activation pathways by PIAS proteins in the immune system [J].Nat Rev Immunol,2005,5 (8):593-605.
[2]Wu L,Wu H,Ma L,et al.A novel zinc finger transcription factor that interacts with Msx2and enhances its affinity for DNA [J].Mech Dev,1997,65 (1/2):3-17.
[3]Mohr SE,Boswell RE.Zimp encodes a homologue of mouse Miz1and PIAS3and is an essential gene in Drosophila melanogaster [J].Gene,1999,229 (1/2):109-116.
[4]Sharma M,Li X,Wang Y,et al.hZimp10is an androgen receptor co-activator and forms a complex with SUMO-1at replication foci[J].EMBOJ,2003,22(22):6101-6114.
[5]Li X,Thyssen G,Beliakoff J,et al.The novel PIAS-like protein hZimp10enhances Smad transcriotion activity [J].J Biol Chem,2006,281 (33):23748-23756.
[6]Lee J,Beliakoff J,Sun Z.The novel PIAS-like protein hZimp10is a transcriptional co-activator of the p53tumor suppressor[J].Nucleic Acids Res,2007,35 (13):4523-4534.
[7]姬希文,闫丽萍,颜丕熙,等.鸭坦布苏病毒抗体间接ELISA检测方法的建立 [J].中国预防兽医学报,2011,33 (8):630-634.
[8]Megidish T,Xu JH,Xu CW.Activation of p53by protein inhibitor of activated Stat1 (PIAS1) [J].J Biol Chem,2002,277 (10):8255-8259.
[9]Long J,Matsuura I,He D,et al.Repression of Smad transcriptional activity by PIASy,an inhibitor of activated STAT [J].Proc Natl Acad Sci USA,2003,100 (17):9791-9796.
[10]曹达龙,孙自捷,万方宁,等.尿液中Zimp7早期诊断前列腺癌的潜在价值 [J].中国癌症杂志,2013,23 (2):87-92.
[11]Soler G,Radford-Weiss I,Ben-Abdelali R,et al.Fusion of ZMIZ1to ABL1in a B-cell acute lymphoblastic leukaemia with a t(9;10) (q34;q22.3)translocation [J].Leukemia,2008,22 (6):1278-1280.
[12]Dupuy AJ,Roqers LM,Kim J,et al.A modified sleeping beauty transposon system that can be used to model a wide variety of human cancers in mice [J].Cancer Res,2009,69 (20):8150-8156.
[13]Hsiao HH,Liu YC,Yang MY,et al.Decreased expression of PIAS1and PIAS3in essential thrombocythemia patients [J].Grenet Mol Res,2013,12 (4):5617-5622.
[14]Dupuy AJ,Rogers LM,Kim J,et al.A modified sleeping beauty transposon system that can be used to model a wide variety of human cancers in mice [J].Cancer Res,2009,69 (20):8150-8156.
[15]Galfre G,Milstein C.Preparation of monoclonal antibodies:strategies and procedure [J]. Methods Enzymol,1981,73 (Pt B):3-46.
