c-Jun在鼻咽癌组织中的表达以及对鼻咽癌复发的影响
2015-11-28吴式琇吴树强贾勇士
方 敏 宋 涛 吴式琇 吴树强 贾勇士
1.浙江省人民医院放疗科,浙江杭州 310014;2.杭州市肿瘤医院放疗科,浙江杭州 310002
c-Jun在鼻咽癌组织中的表达以及对鼻咽癌复发的影响
方 敏1宋 涛1吴式琇2吴树强1贾勇士1
1.浙江省人民医院放疗科,浙江杭州 310014;2.杭州市肿瘤医院放疗科,浙江杭州 310002
目的分析c-Jun在鼻咽癌组织中的表达以及对鼻咽癌复发的影响。方法选择2003年1月~2005年9月在温州医学院附属第一医院耳鼻喉科行放疗的4例复发鼻咽癌(复发鼻咽癌组)和4例初发鼻咽癌患者(初发鼻咽癌组)的组织标本,应用磷酸化抗体蛋白质芯片筛选初发鼻咽癌组与复发鼻咽癌组患者鼻咽癌组织中的差异磷酸化蛋白,并进行聚类。并选取其中的差异磷酸化蛋白进行免疫组化试验验证,用于免疫组化验证的初发及复发鼻咽癌组织40例取自2003年8月~2010年5月温州医学院附属第一医院病理科,将其分为初发鼻咽癌组(n= 20)和复发鼻咽癌组(n=20)。结果在复发鼻咽癌组和初发鼻咽癌组中筛选出包括c-Jun(P=0.030)、Histone H2A(P=0.044)、SEK1(P=0.048)、KIT(P=0.042)、ATP1A1(P=0.007)和Synapsin(P=0.023)共6个差异蛋白,复发鼻咽癌组中Histone H2A(上调比率为1.08)、SEK1(上调比率为1.14)、KIT(上调比率为1.22)、ATP1A1(上调比率为1.22)和Synapsin(上调比率为1.22)磷酸化水平较初发鼻咽癌组患者上调,复发鼻咽癌组中c-Jun磷酸化水平较初发鼻咽癌组患者下调(下调比率为0.87)。其中c-Jun、Histone H2AX、SEK1及KIT蛋白质的磷酸化水平改变可能与鼻咽癌复发机制有关。通过免疫组化验证了c-Jun在复发鼻咽癌组低于初发鼻咽癌组,差异有统计学意义(P= 0.048)。结论 磷酸化c-Jun在复发鼻咽癌组织中低表达,c-Jun磷酸化涉及调控基因、抑制细胞凋亡、促细胞增殖等信号转导通路,可能与肿瘤复发有关,还可提示预后及提供治疗靶点。
鼻咽肿瘤;复发;c-Jun;磷酸化芯片
鼻咽癌(nasopharyngeal carcinoma,NPC)是中国南方地区及亚洲东南部最常见的肿瘤,其发病率和死亡率在头颈恶性肿瘤中居首位。发病率为30/100 000~80/100 000。低分化鳞癌是鼻咽癌最常见病理类型,鼻咽癌因其位于头颅中央,且与颅底密切相连,周围环绕重要器官,极易向周围组织结构侵犯,且淋巴结转移率高,从而使手术较难彻底切除,因此放射治疗是鼻咽癌最主要的治疗手段。鼻咽癌首程放疗后仍有8.2%~22.0%的复发率[1]。复发鼻咽癌预后较差,其再程放疗的5年生存率为18.7%~36%[2],有关鼻咽癌复发的特异性分子标志物的研究成为目前肿瘤研究的热点。
蛋白质相关研究在识别与肿瘤发生发展相关的蛋白质及发现肿瘤分子标志物方面具有独特的优势。筛选初发鼻咽癌和复发鼻咽癌组织的差异表达蛋白,将有助于探索鼻咽癌的复发机制。磷酸化是蛋白常见的翻译后修饰方式,磷酸化在调节控制生物过程包括细胞生长、分化、浸润、转移及凋亡的细胞信号通路中起着重要作用。蛋白激酶活性的改变引起蛋白磷酸化被认为是肿瘤形成及进展的起始。研究复发相关磷酸化蛋白能为肿瘤的发展提供新的见解。对初发鼻咽癌和复发鼻咽癌组织中磷酸化差异蛋白的研究,将有助于探索鼻咽癌的复发机制,并可为肿瘤的治疗提供靶向蛋白。
蛋白质印迹法等传统的技术不能敏感、快速地同时检测大量蛋白,而蛋白芯片因其具备高通量、小型化、高准确性及高敏感性的优点,目前应用越来越广。探索性蛋白芯片由磷酸化特异抗体组成,能在特定位点测量磷酸化蛋白状态的改变,因此能用来检测肿瘤进展和转移相关磷酸化蛋白。本研究首次采用包含656种蛋白质的Full Moon生物公司磷酸化抗体蛋白质芯片分析初发鼻咽癌(primary nasopharyngeal carcinoma,pNPC)和复发鼻咽癌(recurrent nasopharyngeal carcinoma,rNPC)患者的鼻咽癌组织中差异蛋白质的磷酸化水平,可能有助于探索鼻咽癌的复发机制,可能为鼻咽癌的治疗提供新的治疗策略。
1 材料与方法
1.1 蛋白芯片及免疫组化材料
选择2003年1月~2005年9月温州医学院附属第一医院耳鼻喉科手术切除的8例鼻咽癌组织标本用于蛋白芯片试验,本研究用于免疫组化的石蜡包埋的初发与复发鼻咽癌组织取自2003年8月~2010年5月温州医学院附属第一医院病理科,所有标本均经病理确断均为鳞状细胞癌,已签署知情同意书。蛋白芯片标本分两组:初发鼻咽癌组(pNPC组,n=4,C1~C4),男3例,女1例,年龄28~52岁;复发鼻咽癌组(rNPC组,n=4,F1~F4)男3例,女1例,年龄36~53岁。免疫组化标本(共40例)也分两组:初发鼻咽癌组(pNPC组,n=20)男15例,女5例,年龄29~60岁;复发鼻咽癌组(rNPC组,n=20),男15例,女5例,年龄32~62岁。初发鼻咽癌组均是首次诊断为鼻咽癌,影像学检查颈部淋巴结及远处器官未见转移(T1N0M0)。放疗后定期门诊随访5年仍未复发。复发鼻咽癌组均是初次放疗后局部复发,复发的时间为24~70个月(中位时间为56个月),复发时影像学查颈部淋巴结及远处器官未见转移。放疗应用同步加速调强放疗技术,肿瘤和肿大淋巴结(GTV)接受2.5 Gy/次,共28次,总量70 Gy。亚临床灶和预防照射区(PTV)接受常规照射2.0 Gy/次,共28次,总量56 Gy。均照射1次/d,5次/周,总治疗时间为38 d。
1.2 主要试剂和仪器
Full Moon蛋白磷酸化抗体芯片 (上海生物芯片有限公司);脱色摇床(ZHWY-304,中国上海智诚分析仪器制造有限公司);4℃离心机(Eppendorf 5415R,Eppendorf,德国);涡旋振荡器 (Votex-Genie 2,Scien tic Industries,美国);芯片扫描仪(GenePix 4000B,Axon Instruments,美国);芯片小型离心机(ChipMate PMC-082,Tomy,日本);NanoDrop 2000分光光度计(Thermo Fisher Scientific,美国);c-Jun(Ab-243)抗体及c-Jun(Phospho-Ser243)抗体(美国Assay Biotech公司);正常山羊封闭血清、生物素化标记二抗(羊抗兔IgG)及DAB显色试剂盒(北京中杉金桥生物技术有限公司);BX生物显微镜(OLYMPUS,日本)。
1.3 蛋白芯片及免疫组化步骤
1.3.1 蛋白磷酸化抗体芯片的具体步骤
1.3.1.1 蛋白质提取及标记 使用预冷的PBS洗涤蛋白质提取和标记的组织样本,彻底将杂质清洗干净,把一管裂解磁珠加到组织,加入缓冲液100 μL,涡旋振荡器中剧烈混合30 s,放置冰上10 min,共重复5次。后在4℃离心机中14 000 r/min离心15 min。上清移入试管中。取50 μL的蛋白质提取物加到离心柱顶部,1000 r/min离心2 min,收集管底纯化蛋白。用NanoDrop测蛋白浓度。取20 μL(80 μg)蛋白质样品,加到10 μg/μL的Biotin/DMF,室温下混合均匀,震荡反应2 h,加入35 μL中止液,室温下震荡反应30 min。
1.3.1.2 阻断 将蛋白质芯片浸没在30 mL封闭溶液中,摇床上室温55 r/min封闭30 min。芯片放入50 mL离心管,加入45 mL Milli-Q,盖紧后用手震摇10 s,倒掉Milli-Q。换入新的Milli-Q,震摇10 s,倒掉Milli-Q。重复5次。将芯片充分洗涤,从芯片表面移除封闭液。
1.3.1.3 芯片杂交 把6 mL生物素标记蛋白加入放置蛋白质芯片的培养皿中,芯片需完全浸没,以35 r/min在摇床上反应1~2 h,移到洗脱液中,以55 r/min在摇床上反应10 min,倒掉洗液,重复2次。按前述方法用Milli-Q水洗涤,甩掉多余Milli-Q水。
1.3.1.4 荧光孵育 将芯片浸没在Cy3-链亲和素,室温下避光,以35 r/min在摇床上反应1~2 h。移到洗脱液中,55 r/min在摇床上反应10 min,把洗液倒掉,重复2次。如前述方法用Milli-Q水洗涤,甩掉表面多余Milli-Q水,使用压缩N2将芯片表面吹干。
1.3.1.5 芯片扫描和分析 采用Axon GenePix芯片扫描仪进行芯片扫描。采用GenePix Pro 6.0软件分析芯片图像,将图像信号转化成数字信号,后将芯片数据进行归一。磷酸化比值=(复发鼻咽癌组磷酸化表达/复发鼻咽癌组非磷酸化表达)/(初发鼻咽癌组磷酸化表达/初发鼻咽癌组非磷酸化表达)。芯片结果用Cluster 3.0软件进行聚类分析,Treeview 1.6软件用来将分析结果转化为可视图。
1.3.2 免疫组化的具体步骤
1.3.2.1 免疫组化操作步骤 将石蜡包埋的复发鼻咽癌组与初发鼻咽癌组鼻咽癌组织3 μm连续切片并晾干,二甲苯浸泡脱蜡及水化,高压修复抗原,室温下5%山羊血清封闭30 min,滴加50 μL 1∶80的c-Jun(Ab-243)抗体及c-Jun(Phospho-Ser243)抗体,4℃冰箱过夜,室温复温30 min,滴加生物素标记二抗20 μL,室温湿盒孵育30 min,DAB显色,用苏木精复染5 min,用梯度酒精使脱水,用二甲苯使透明,用中性树脂封片,在室温下将其晾干,显微镜下观察。
1.3.2.2 免疫组化结果分析 c-Jun及p-c-Jun在复发鼻咽癌组与初发鼻咽癌组鼻咽癌组织中免疫组化染色阳性结果为黄色或棕黄色。采用DMR+Q550型病理图像分析系统对结果进行分析,在每张切片的鼻咽癌组织带中随机选取5个高倍视野(200×),用Image-Pro Plus图像分析软件对免疫组化的图片进行分析。蛋白磷酸化表达水平用p-c-Jun/c-Jun的值表示。
1.4 统计学方法
采用SPSS 16.0统计学软件进行数据分析,计量资料数据用均数±标准差()表示,两组间比较采用t检验;计数资料用率表示,以P<0.05为差异有统计学意义。
1.5 蛋白功能分析
筛选出的差异磷酸化蛋白质的磷酸化位点、相关功能及信号通路采用PhosphoSite Plu磷酸化蛋白数据库(http://www.phosphosite.org/homeAction.do)分析。
2 结果
2.1 蛋白磷酸化抗体芯片的结果
2.1.1 蛋白质磷酸化抗体的芯片反应图
所有蛋白芯片无异常信号,单张芯片重复点表达水平吻合良好。采用GenePix Pro 6.0软件分析芯片图像,其将荧光强弱转化成芯片反应图。
2.1.2 复发鼻咽癌组和初发鼻咽癌组中差异磷酸化蛋白质表达情况
初发鼻咽癌组与复发鼻咽癌组的蛋白质磷酸化水平不同。共筛选出6个差异磷酸化蛋白质,在复发鼻咽癌组中KIT、Histone H2A、SEK1、ATP1A1、Synapsin的磷酸化水平均上调,差异均有统计学意义(P<0.05或P<0.01)。6个磷酸化蛋白质的差异位点也被识别。见表1。

表1 两组患者中差异磷酸化蛋白质表达情况
2.1.3 差异磷酸化蛋白质的聚类结果
本研究还对筛选出的差异磷酸化蛋白质进行聚类分析,6个差异磷酸化蛋白质的聚类结果见图1(封三)。
2.1.4 差异磷酸化蛋白质的相关功能及通路分析
通过在线网络数据库 phosphosite(http://www. phosphosite.org/homeAction.do)分析6个差异蛋白的磷酸化位点、相关功能及在信号通路中的作用,发现c-Jun、Histone H2AX、SEK1、KIT的蛋白酪氨酸(Tyr)或丝氨酸(Ser)磷酸化,通过不同的信号通路参与抑制细胞凋亡、基因调控、促细胞增殖等过程,可能与鼻咽癌复发有关,还可提示预后、评价疗效及提供治疗靶点。但ATP1A1、Synapsin的磷酸化水平改变在肿瘤复发中的具体作用还不清楚。目前尚未发现ATP1A1、Histone H2AX及KIT蛋白参与的相关信号通路。6个差异蛋白的功能、磷酸化位点及在信号通路中的作用详见表2。
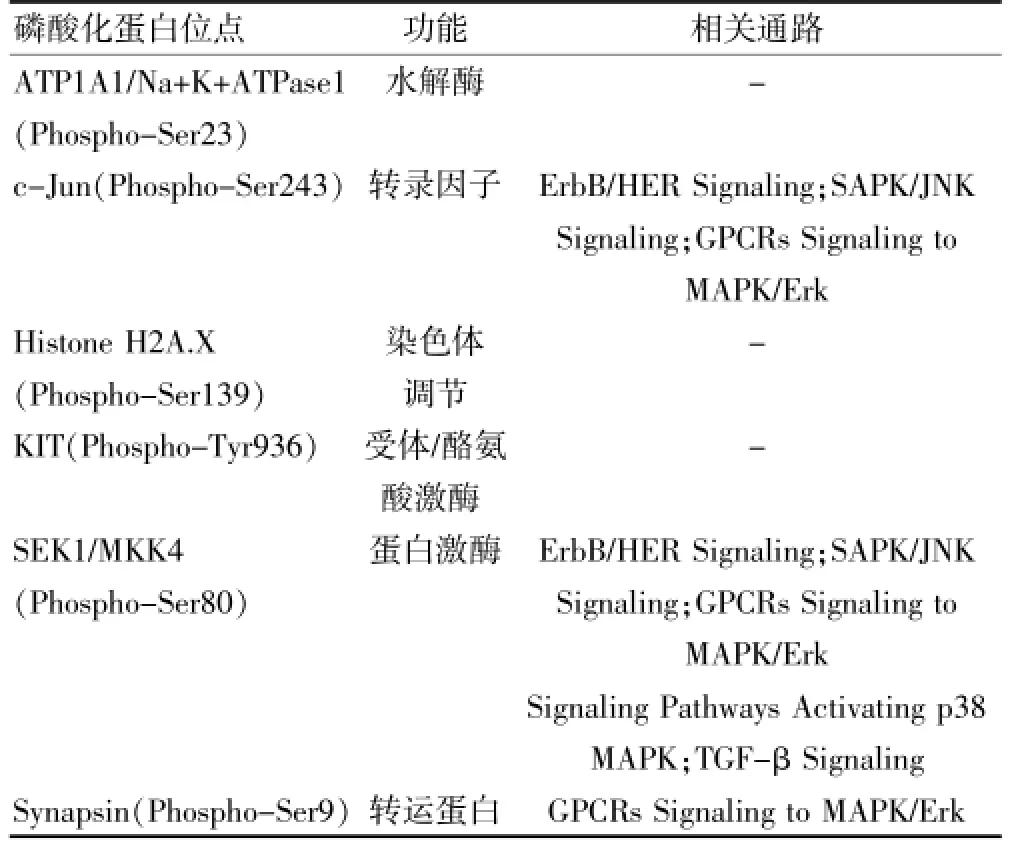
表2 差异磷酸化蛋白功能及相关信号通路
2.2 免疫组化结果
所有切片均显色,可见c-Jun、p-c-Jun均表达于细胞核,阳性表达结果为呈黄色或棕黄色颗粒,见图2。初发鼻咽癌组p-c-Jun/c-Jun的比值为(0.713± 0.096),复发鼻咽癌组p-c-Jun/c-Jun的比值为(0.621± 0.082),p-c-Jun/c-Jun的比值在两组间比较有明显差异(P=0.048)。采用免疫组化比较初发鼻咽癌和复发鼻咽癌组织中c-Jun的蛋白磷酸化水平,发现在复发鼻咽癌组中,c-jun磷酸化水平更低,与蛋白芯片的结果相符。
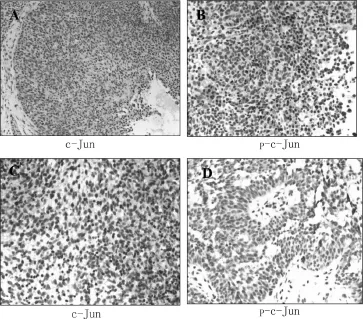
图2 初发鼻咽癌和复发鼻咽癌组织中c-Jun尧p-c-Jun的表达(DAB,200×)
3 讨论
鼻咽癌是头颈恶性肿瘤最常见的肿瘤,其发病率和死亡率均位居首位。鼻咽癌首选治疗方法是放射治疗。仍有约30%鼻咽癌常规放疗后局部复发。鼻咽癌放疗后复发的机制目前还不清楚,其可能与细胞周期调控、DNA损伤修复、增殖及细胞凋亡等信号转导通路改变有关。
磷酸化和去磷酸化是蛋白功能修饰调节的重要方式,在整个生命活动过程贯穿始终。当蛋白的磷酸化和去磷酸化调控异常时,会导致正常细胞凋亡、分化及激活信号传导通路,最终引发恶性肿瘤。研究鼻咽癌复发相关磷酸化蛋白质水平的改变可能有助于揭示鼻咽癌复发的分子机制。
传统研究磷酸化蛋白的技术因其非高效及高通量,不能同时满足多重蛋白磷酸化的研究。Full Moon磷酸化蛋白芯片技术(PEX100)作为一种新型的高通量蛋白质组学技术[3],共包含656种蛋白质,其能检测蛋白特定位点的磷酸化水平的改变。所选抗体位点均选自文献且经实验证实,每个所含磷酸化蛋白位点都设有磷酸化和非磷酸化的配对特异抗体,能定量检测蛋白的磷酸化水平。蛋白芯片内所含抗体位点均设置多个重复(2~6个重复),同时含有阳性参照和阴性参照,确保实验结果的准确。此外,蛋白芯片还具有集成化、微型化和高通量化的特点,它不但能鉴别出特定蛋白激酶的亚型,还可揭示信号通路之间的相互联系。故本研究采用磷酸化特异蛋白芯片来鉴别鼻咽癌复发相关的磷酸化蛋白,从而可为鼻咽癌复发提供分子机制和新的治疗策略。
本研究首次采用Full Moon蛋白磷酸化芯片来检测初发鼻咽癌组鼻咽癌和复发鼻咽癌组的差异蛋白磷酸化水平。结果共发现有6个差异磷酸化蛋白质,其中Histone H2A、SEK1、KIT、ATP1A1及Synapsin 5个蛋白质在复发鼻咽癌组鼻咽癌组织中的磷酸化水平显著升高,c-Jun蛋白在复发鼻咽癌组鼻咽癌组织中的磷酸化水平显著下降。本研究采用免疫组化对c-Jun蛋白进行验证,结果与芯片结果符合,说明芯片结果真实可信。
Phospho Site Plus(http://www.phosphosite.org/)是一个包含蛋白质磷酸化位点的数据库网站,里面含有大量蛋白质磷酸化位点信息,包括蛋白的相关信息如基本结构,功能及相关信号通路等。本研究采用此网站分析筛选出的6个蛋白磷酸化位点变化及在信号通路中的作用。
在复发鼻咽癌组中磷酸化水平上调的蛋白质中,KIT蛋白是Ⅲ型酪氨酸激酶家族的重要成员,KIT激活后,Grb2衔接其Tyr936及703,与SOS蛋白作用,激活Ras蛋白,后激活Mek1/2及ERK1/2,从而影响基因转录。KIT激活突变会引起肿瘤,超过90%的胃间质瘤由KIT激活突变所致,鼻咽癌细胞株中KIT也存在过表达。KIT是酪氨酸激酶抑制剂(如伊马替尼)的靶点之一,KIT的突变导致Tyr激活,致胃肠道间质瘤中甲磺酸伊马替尼耐药,引起肿瘤复发[4]。H2AX属于组蛋白的一种,其主要参与基因组稳定的维持、DNA损伤修复和抑制肿瘤。DNA双链断裂引起位于丝氨酸139位C末端的H2AX磷酸化形成“γ-H2AX”,引起下游分子磷酸化,引起生物级联反应,触发细胞凋亡。H2AX的翻译后修饰(如ser139磷酸化)可能与放射抵抗有一定相关性[5]。放疗前测量γH2AX含量,可预测患者的放疗敏感性[6],并对临床放疗剂量的选择具有一定指导意义。MKK4/SEK1可磷酸化和激活JNK和p38MAPK。Akt可磷酸化SEK1的Ser78,抑制SEK1介导的凋亡[7]。近来有研究发现,MKK4蛋白在肿瘤发生、发展及转移过程中发挥着重要的作用[8]。MKK4蛋白表达上调可能在口腔鳞状细胞癌与喉鳞癌的浸润转移过程中发挥了促进的作用[9]。
在复发鼻咽癌组中磷酸化水平下调的蛋白质中,c-Jun属于转录因子(activating protein-1,AP-1)家族。在外界信号如紫外线照射作用下,Jun激酶(JNK)与Jun的N段连接从而使Jun磷酸化。c-Jun的Ser-243磷酸化可促进其与SP1结合,从而增强c-Jun调控基因的能力[10]。研究发现宫颈癌中Ser-243磷酸化减少后,c-Jun蛋白的稳定性增加,致瘤能力增强[11]。c-Jun/AP-1是信号转导通路末端的转录因子,与多种细胞行为如肿瘤细胞的侵袭、细胞癌变和转移等有密切关系。Jun激酶的激活与细胞凋亡与细胞增殖有关。c-Jun通过抑制凋亡促进肿瘤细胞增殖。更多的证据表明JNK在头颈部肿瘤发生和进展中有非常重要的作用,JNK影响蛋白1(JIP-1)是JNK的较强抑制剂,在鼻咽癌细胞的增殖中起着重要的阴性调节作用,并代表鼻咽癌新的治疗靶点[12]。研究表明Jun通路在辐射诱发的凋亡中有着至关重要作用,其可为干扰SAPK通路提供新的策略,利于肿瘤的治疗[13]。Gee等[14]研究发现活化的c-Jun可与MAPK信号通路成员相互作用。c-Jun可能对预后有一定的提示作用,但目前尚存在争议[15-16]。c-Jun蛋白涉及多条相关通路如MAPK信号通路、SAPK/JNK信号通路及ErbB/HER信号通路等,提示鼻咽癌复发是多通路作用的结果。因此阻断单一通路靶点可能无法成功阻断肿瘤下游信号转导,提示多靶点药物合并治疗可能提高治疗效果,有利于克服鼻咽癌复发。
综上所述,本研究首次采用蛋白芯片筛选复发鼻咽癌组和初发鼻咽癌组的差异磷酸化水平蛋白,共选出6个差异蛋白,已通过免疫组化验证其中的c-Jun蛋白,其他的蛋白有待进一步验证。c-Jun蛋白磷酸化蛋白涉及抑制细胞凋亡、参与基因调控及促细胞增殖等信号转导通路等,可能与鼻咽癌复发有关,还可提示预后及提供治疗靶点。本研究筛选出的差异磷酸化蛋白不仅能揭示鼻咽癌复发的分子机制,也可为临床复发鼻咽癌治疗提供新的策略,还可为鼻咽癌放疗效果提供新的预测因子。
[1]卢泰祥,韩非,李嘉欣,等.复发鼻咽癌临床研究进展[J].中国癌症杂志,2008,18(9):661-666.
[2]韩非,卢泰祥.复发鼻咽癌的挽救治疗[J].肿瘤学杂志,2009,15(7):606-608.
[3]Kang S,Elf S,Lythgoe K,et al.p90 ribosomal S6 kinase 2 promotes invasion and metastasis of human head and neck squamous cell carcinoma cells[J].J Clin Invest,2010,120(4):1165-1677.
[4]Mahadevan D,Cooke L,Riley C,et al.A novel tyrosine kinase switch is a mechanism of imatinib resistance in gastrointestinal stromal tumors[J].Oncogene,2007,26(27):3909-3019.
[5]Xie A,Odate S,Chandramouly G,et al.H2AX post translational modifications in the ionizing radiation response and homologous recombination[J].Cell Cycle,2010,9(17):3602-3610.
[6]Macphail SH,Banth JP,Yu TY,et al.Expression of phos phorylated Histone H2AX in cultured cell lines following exposure to X2 rays[J].Int J Radiat Biol,2003,79(5):3512-3518.
[7]Park HS,Kim MS,Huh SH,et al.Akt(protein kinase B)negatively regulates SEK1 by means of protein phosphorylation[J].J Biol Chem,2002,277(4):2573-2578.
[8]Whitmarsh AJ,Davis RJ.Role of mitogen-activated protein kinase kinase 4 in cancer[J].Oncogene,2007,26(22):3172-3184.
[9]蒋宁宁,巫家晓,卿海云,等.MKK4蛋白在口腔鳞状细胞癌中的表达及其与转移的关系[J].广西医科大学学报,2011,28(1):79-82.
[10]Chen BK,Huang CC,Chang WC,et al.PP2B mediated dephosphorylation of c-Jun C terminus regulates phorbol ester induced c-Jun/Sp1 interaction in A431 cells[J]. Mol Biol Cell,2007,18(3):1118-1127.[11]Huang CC,Wang JM,Kikkawa U,et al.Calcineurin-mediated dephosphorylation of c-Jun Ser-243 is required for c-Jun protein stability and cell transformation[J]. Oncogene,2008,27(17):2422-2429.
[12]Gan LH,Liu MX,Chen LW,et al.Effect of JIP on The proliferation and apoptosis of nasopharyngeal carcinoma cells through interaction with JNK mediated pathway[J]. Prog Biochem Biophys,2003,30(4):579-585.
[13]He XC,Zhang JW,Tong WG,et al.BMP signalling inhibits intestinal stem cell self-renewal through suppression of Wnt-P-catenin signaling[J].Nature Genet,2004,36,1117-1121.
[14]Gee JM,Barroso AF,Ellis IO,et al.Biological and clinical associations of c-Jun activation in human breast caneer[J].Int J Cancer,2000,89(2):177-186.
[15]Marije M,Vleugel PhDa,Astrid E,et al.c-Jun activation is associated with proliferation and angiogenesis in invasive breast cancer [J].Human Pathology,2006,37(6):668-674.
[16]Manfred V,Peter D,Werner W,et al.Prognostic significance of the expression of c-fos,c-jun and c-erbB-1 oncogene products in human squamous cell lung carcinomas[J].J Cancer Res Clin Onco,1993,119(9):507-510.
ExPression of c-jun in nasoPharyngeal carcinoma and the effects on the recurrent nasoPharyngeal carcinoma
FANG Min1SONG Tao1WU Shixiu2WU Shuqiang1JIA Yongshi1
1.Department of Radiotherapy,Zhejiang Provincial People's Hospital,Zhejiang Province,Hangzhou 310014,China; 2.Department of Radiotherapy,Hangzhou Cancer Hospital,Zhejiang Province,Hangzhou 310002,China
Objective To analyze expression of c-jun in nasopharyngeal carcinoma and the effects on the recurrent nasopharyngeal carcinoma.Methods Four primary nasopharyngeal carcinoma tissues (pNPC group)and four relapsed nasopharyngeal carcinoma tissues(rNPC group)were obtained from the Department of Otolaryngology,the First Affiliated Hospital of Wenzhou Medical College.The differentially phosphorylation level of proteins in rNPC group and pNPC group were identified by Full Moon BioSystems'Phospho Explorer antibody array and this was followed by cluster analysis.Immunohistochemistry was performed on some of differentially phosphorylated protein 40 cases of primary and relapsed nasopharyngeal carcinoma tissues were selected for immunohistochemical validation,from August 2003 to May 2010 in Pathology Department of the First Affiliated Hospital of Wenzhou Medical College,and they were divided into primary nasopharyngeal carcinoma group (n=20)and relapsed nasopharyngeal carcinoma group (n=20).Results The phosphorylation levels of proteins in two groups were different and six significantly differentially phosphorylated proteins were identified including c-Jun(P=0.030),Histone H2A(P=0.044),SEK1(P=0.048),KIT(P=0.042),ATP1A1(P= 0.007),and Synapsin (P=0.023).Among them,compared to pNPC group the phosphorylation levels of five proteins (ATP1A1,Histone H2A,KIT,SEK1 and Synapsin)in tissues of the rNPC group were increased,the up-regulated ratio was 1.08,1.14,1.22,1.22,1.22 respectively,and one protein was decreased(c-Jun),the down-regulated ratio of c-Jun was 0.87.Some of the diferentially phosphorylated proteins including c-Jun,Histone H2AX,SEK1 and KIT maybe play crucial roles in the recurrence of NPC.The phosphorylation levels of c-Jun was also decreased in rNPC group(P=0.048) by immunohistochemistry.Conclusion The phosphorylation levels of c-Jun is decrease in tissues of rNPC,which maybe play crucial roles in the recurrence of NPC.The phosphorylated c-Jun participates in the processes of DNA damage repair,apoptosis,cell migration,invasion,signal transduction and so on,and may indicates prognosis and provides theraputic targets.
Nasopharyngeal neoplasmas;Recurrence;c-Jun;Phosphorylation chip
R730.5
A
1673-7210(2015)11(a)-0035-06
2015-07-10本文编辑:任 念)
