非阿片类药物KOR激动剂Salvinorin A减轻前脑缺血再灌注大鼠脑水肿的作用
2015-11-28王震虹何振洲忻纪华
张 燕 王震虹 何振洲 忻纪华
上海交通大学医学院附属仁济医院南院麻醉科,上海 201112
非阿片类药物KOR激动剂Salvinorin A减轻前脑缺血再灌注大鼠脑水肿的作用
张 燕 王震虹 何振洲 忻纪华▲
上海交通大学医学院附属仁济医院南院麻醉科,上海 201112
目的 探讨大鼠前脑缺血再灌注(I/R)损伤后,Kappa阿片受体(KOR)激动剂Salvinorin A(SA)减轻脑水肿的机制。方法 成年健康雄性Sprague-Dawley(SD)大鼠随机分为5组(n=10):假手术组、I/R组、DMSO(SA溶剂)组、SA组和Norbinaltorphimine(nor-BIN,KOR拮抗剂)+SA组。夹闭双侧颈动脉联合低血压诱发前脑缺血10 min,在缺血后即刻给予DMSO、SA和nor-BIN+SA。再灌注后24 h处死大鼠,取其海马组织做病理,采用末端转移酶dUTP缺口末端标记(TUNEL)及免疫组织化学检测AQP4蛋白水平,用干-湿重法评估脑含水量。结果 与假手术组比较,I/R组海马脑含水量增加(P<0.01);SA组和I/R组相比,海马脑含水量显著下降(P<0.01);nor-BIN+ SA组脑含水量显著高于SA组(P<0.05)。前脑缺血再灌注后24 h,与I/R和DMSO组比较,SA组显著减少海马神经细胞坏死和凋亡(P<0.01),而nor-BIN可抵消这一作用。与假手术组比较,海马的AQP4蛋白水平,在I/R组显著增加(P<0.01);与I/R组比较,SA组显著下降(P<0.01);nor-BIN+SA组AQP4的蛋白水平和SA组相比明显增加(P<0.05)。结论SA可以明显减轻前脑缺血后的脑水肿,减轻脑损伤,抑制AQP4的蛋白水平,其作用可能和KOR相关。
脑缺血再灌注;脑水肿;脑损伤;κ阿片受体激动剂;水通道蛋白4
脑卒中是继癌症和心脏疾病后导致患者残疾和死亡的主要原因[1]。脑缺血后脑水肿主要威胁脑卒中患者,但目前对降低人脑卒中后脑水肿的可行性研究很少[2]。许多研究都以降低脑梗死体积和神经元细胞死亡作为首要目标,而不是减轻脑水肿。现今,鉴于脑水肿与脑损伤密切相关,人们越来越多地关注脑水肿。
水通道蛋白(AQP)是一种选择性转运水分子的蛋白质家族,其中主要的亚型AQP4在中央系统里很丰富,在水分子运输过程中发挥重要作用[3-4]。许多证据表明,脑缺血再灌注中,AQP4的调控与脑水肿的发展相关[5]。有研究表明,在脑缺血损伤后,AQP4的表达上调,进而促使脑水肿及脑损伤加重[6]。一些专家已证实,抑制AQP4能显著减轻缺血性脑水肿[7]。研究观察到在脑水肿造成脑损伤后24~72 h,海马AQP4表达水平达峰值[6],7 d后恢复正常。因此,脑缺血后AQP4的调控是用于治疗脑水肿的靶点。
Kappa阿片受体(KOR)在细胞和动物模型中均证实具有脑神经保护作用[8]。一些研究人员发现,KOR激动剂还可以减轻前脑缺血后的脑水肿[1]。Salvinorin A(SA)是迄今为止最有效的唯一天然来源的高选择性的非阿片类药物KOR激动剂[9]。已有研究证实SA能保护缺血再灌注后脑自动调节[10],而此功能和脑水肿的形成相关。基于以上证据,笔者推测SA激动KOR,通过抑制AQP4的表达来减轻脑缺血再灌注后的脑水肿,现将实验报道如下:
1 材料与方法
1.1 动物与分组
成年健康雄性Sprague-Dawley(SD)大鼠,许可证号:SCXK(沪)2013-0016,体重250~300 g,将其分为5组,每组10只。假手术组:仅分离双侧颈总动脉和一侧股动脉,不进行缺血造模;前脑缺血(I/R)组:缺血造模;SA溶剂(DMSO)组:在缺血后立即给予0.1 mL/100 g DMSO;SA组:前脑缺血后静脉注射SA 10 μg/kg;KOR拮抗剂(nor-BIN)+SA组:缺血后即刻静注SA 10 μg/kg后联合给予nor-BIN 2 mg/kg。
1.2 主要试剂与仪器
SA(Sigma,USA)、DMSO(Amereso,USA)、nor-BIN(Sigma,USA)、TOPO型大鼠呼吸机 (Kent Scientific Co.,美国)、图像分析系统(ZEISS,德国)、原位细胞凋亡检测试剂盒(ROCHE,瑞士)、4%多聚甲醛溶液(上海华美生物技术有限公司)。
1.3 前脑I/R模型制作
采用经典BCCAO模型[11]。10%水合氯醛(40 mg/ 100 g)经腹腔注射给药麻醉大鼠后气管插管,经颈部解剖分离双侧颈总动脉并游离股动脉插管,从股动脉抽血6~10 mL,使大鼠平均动脉压维持在25~30 mmHg(1 mmHg=0.133 kPa)后夹闭双侧颈总动脉诱发前脑缺血维持10 min。
1.4 标本取材
缺血24 h,每组大鼠取5只采用4%多聚甲醛由心脏灌注后保存用以病理、末端转移酶dUTP缺口末端标记(TUNEL)检测以及免疫组化测定,另5只取脑组织后称重用以测定脑水含量。
1.5 脑水含量测定
前脑缺血后24 h取大脑,用中性滤纸吸收和除去大脑中的血渍。在90 s离析的化学平衡(CP-413,OHAUS USA)中测定每个大脑右半球的湿重,将大脑置于110℃恒温烘箱中烘烤24 h,得到干重。采用干湿法测脑组织中水含量,脑组织含水量=[(湿重-干重)/湿重]×100%。
1.6 TUNEL检测
按试剂盒说明操作。选取4个不同区域显微镜下观察并进行图像处理、分析,计算各组大鼠海马组织CA1区脑缺血后24 h凋亡细胞的阳性率。TUNEL阳性细胞率=(TUNEL阳性细胞/总细胞数)×100%。
1.7 病理学检查
脑缺血24 h后采用4%多聚甲醛灌注固定标本,包埋切片后苏木精-伊红(HE)染色,选取固定区域显微镜下观察脑神经细胞损伤情况,计数坏死细胞比例。
1.8 免疫组织化学检测
前脑缺血后24 h,由左心室灌注4%多聚甲醛溶液固定脑组织,观察海马CA1区AQP4蛋白相对表达量。采用免疫组化SP法,经过转膜、封闭,一抗和二抗孵育后,显色,脱水,封片,显微镜下观察。AQP4表达阳性细胞内显示棕黄色颗粒。每个切片选取不同的4个视野,观察并拍照,采用Image-pro plus 6.0图像分析系统读取视野积分光密度值(IOD)。
1.9 统计学方法
采用SPSS 10.0统计学软件进行数据分析,计量资料数据用均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠脑含水量比较
统计分析显示:假手术组、I/R组、DMSO组、SA组和nor-BIN+SA组脑含水量分别为(62.14±0.83)%、(65.14±0.40)%、(64.28±0.37)%、(61.42±0.23)%和(64.36±0.39)%。与假手术组比较,I/R组海马脑含水量显著增高(P<0.01);与I/R组比较,SA组的脑含水量显著降低(P<0.01);nor-BIN+SA组脑含水量显著高于SA组(P<0.05)。见图1。
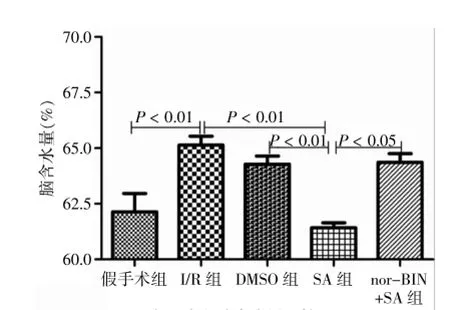
图1 各组大鼠脑含水量比较(n=5)
2.2 各组大鼠病理学检测结果比较
与假手术组比较,I/R组大鼠海马CA1区遭受破坏,DMSO组也出现神经元损伤。统计分析显示,假手术组、I/R组、DMSO组、SA组和nor-BIN+SA组坏死神经细胞百分比分别为:(9.72±0.96)%、(65.16± 3.07)%、(69.42±6.26)%、(30.35±3.19)%和(53.32± 5.76)%。与I/R组比较,SA组脑损伤显著减轻 (P<0.01);与SA组比较,nor-BIN+SA组脑损伤加重(P<0.05),与I/R组接近。见图2。
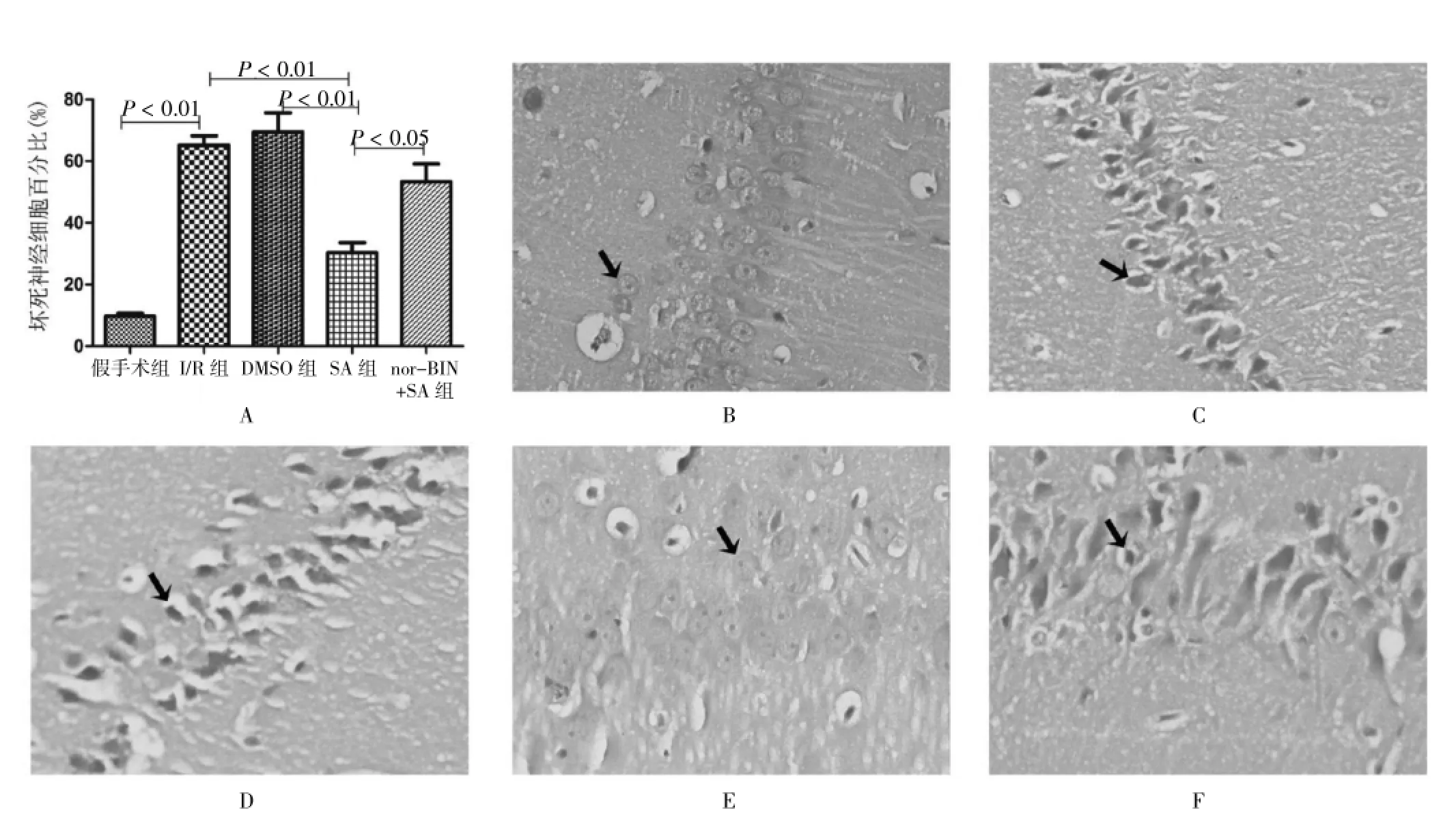
图2 各组大鼠病理学检测结果(HE,400×)
2.3 各组凋亡情况比较
统计分析显示,假手术组、I/R组、DMSO组、SA组和nor-BIN+SA组凋亡细胞指数分别为(8.75±1.13)%、(51.56±3.86)%、(51.98±3.83)%、(19.91±1.87)%和(31.19±1.95)%。假手术组大鼠脑组织中几乎无凋亡细胞,在I/R组和DMSO组中检测到的TUNEL阳性细胞显著增加,差异有统计学意义(P<0.01);与I/R组比较,SA组TUNEL阳性细胞显著减少(P<0.01);与SA组比较,nor-BIN+SA组TUNEL阳性细胞明显增多(P<0.01)。见图3(封三)。
2.4 各组大鼠AQP4蛋白表达情况比较
统计分析显示,假手术组、I/R组与DMSO组海马CA1区AQP4表达的IOD值分别为:(211.7±16.7)、(1799.0±179.2)和(1475.0±162.0);海马AQP4蛋白在假手术组脑组织切片中几乎没有观察到AQP4阳性细胞,而在I/R组AQP4表达增加(P<0.01)。与I/R组比较,SA组AQP4表达显著减少(P<0.01),SA组与SA+nor-BIN组海马CA1区AQP4表达的IOD值分别为(584.2±40.0)和(925.1±55.9),两组比较差异有统计学意义(P<0.05),SA抑制海马AQP4表达,而nor-BIN则可抵消这一作用。见图4(封三)。
3 讨论
3.1 大脑缺血再灌注问题和KOR激动剂的潜在作用
脑I/R较易出现在围术期,尤其是体外循环、器官移植等大手术后更易发生脑I/R。脑水肿通常发生在缺血后3 h,而在缺血后48 h达到高峰[12]。脑水肿可使颅内压增高,压迫周围组织,减少梗死或边缘区域的血流,加重脑损害[13]。截至目前,还是缺乏有效的方法来阻止脑水肿,但神经保护是一个良好的研究治疗方向。在缺血动物模型中,已证实KOR激动剂的神经保护效应[14]。在离体[1]和在体[2]实验研究中均证实,KOR激动剂可以减轻脑缺血后脑水肿及继发引起的脑损伤,并且其作用是通过KOR介导的。
3.2 SA——治疗脑水肿的新型药物
虽然KOR激动剂在临床上有巨大的治疗价值,但因其低选择性限制了现有的KOR激动剂在实践中更广泛的应用。SA具有多种优势:从一种盛产的植物中同步提取并分离纯化和制备;易合成,起效迅速,作用短暂;类脂溶性,容易通过血脑屏障;兼有镇静和镇痛双重作用;大剂量长期使用时,仍对重要脏器无明显损害作用;无呼吸抑制,没有直接致幻或躁动等不良反应[15]。本课题组通过前期的研究工作已经证实,在脑缺血前和缺血后 (即刻、30 min和1 h)静注SA均可保留软脑膜动脉的自动调节功能,在高碳酸血症和低血压时,保持脑动脉的血管扩张作用[16]。结果提示,在大鼠海马中给予SA能明显减轻脑水肿,挽救坏死凋亡的神经元,进而避免脑组织缺血再灌注损伤。
3.3 AQP4的作用
近年来,AQP4参与脑水肿的形成越来越受到关注,成为脑水肿的治疗靶点[17]。AQP4主要表达于毛细血管周围的星形胶质细胞足突和室管膜细胞,尤其在星形胶质细胞表达丰富。之前的研究已经表明,短暂性脑缺血再灌注增加AQP4的表达,导致脑水肿[17]。在本研究中,脑缺血后24 h脑水肿明显,海马中AQP4蛋白水平也同时明显增加。虽然已证明,KOR激动剂可以减轻脑水肿,但很少有研究者关注这一作用与AQP4的关系。本研究观察到缺血后给予SA,脑水肿程度明显减轻,海马CA1中AQP4蛋白水平减少。结果表明,SA抑制AQP4表达,同时减轻脑水肿和前脑缺血后的脑细胞凋亡和坏死。因此,SA减轻脑水肿的作用与抑制脑组织AQP4表达有关。此外nor-BIN能抵消SA的作用,这表明SA的保护作用可能是通过KOR介导的。
本研究有3个新的发现:首先,前脑缺血再灌注后即刻给予SA能减轻缺血后脑水肿和脑损伤;其次,SA能抑制海马CA1上的AQP4表达;第三,KOR拮抗剂nor-BIN可抵消SA的治疗作用,SA的部分作用是通过KOR实现的。
[1]Yang L,Wang H,Shah K,et al.Opioid receptor agonists reduce brain edema in stroke [J].Brain Research,2011,1383(6):307-316.
[2]Gueniau C,Oberlander C.The kappa opioid agonist niravoline decreases brain edema in the mouse middle cerebral artery occlusion model of stroke[J].J Pharmacol Exp Ther,1997,282(1):1-6.
[3]Nito C,Kamada H,Endo H,et al.Involvement of mitogen-activated protein kinase pathways in expression of the water channel protein aquaporin-4 after ischemia in rat cortical astrocytes[J].J Neurotrauma,2012,29(14):2404-2412.
[4]Zheng YY,Lan YP,Tang HF,et al.Propofol pretreatment attenuates aquaporin-4 over-expression and alleviates cerebraledema aftertransientfocalbrain ischemia reperfusion in rats[J].Anesth Analg,2008,107(6):2009-2016.
[5]Ribeiro Mde C,Hirt L,Bogousslavsky J,et al.Time course of aquaporin expression after transient focal cerebral ischemia in mice[J].J Neurosci Res,2006,83(7):1231-1240.
[6]Li PF,Zhan HQ,Li SY,et al.Lactuside B decreases aquaporin-4 and caspase-3 mRNA expression in the hippocampus and striatum following cerebral ischaemiareperfusion injury in rats[J].Exp Ther Med,2014,7(3):675-680.
[7]Bhattacharya P,Pandey AK,Paul S,et al.Aquaporin-4 inhibition mediates piroxicam-induced neuroprotection against focal cerebralischemia/reperfusioninjuryinrodents[J]. PLoS One,2013,8(9):e73481.
[8]Su DS,Wang ZH,Wang XR,et al.Dose-dependent neuroprotection of delta opioid peptide [D-Ala2,D-Leu5] enkephalin in neuronal death and retarded behavior induced by forebrain ischemia in rats[J].Neurosci Lett,2007,423(2):113-117.
[9]Vortherms TA,Roth BL.Salvinorin A:from natural product to human therapeutics[J].Mol Interv,2006,6(5):257-265.
[10]Su D,Riley J,Liu R,et al.Salvinorin A pretreatment preserves cerebrovascular autoregulation after brain hypoxic/ischemic injury via extracellular signal-regulated kinase/mitogen-activated protein kinase in piglets[J]. Anesth Analg,2012,114(1):200-204.
[11]Singh DP,Chopra K.Verapamil augments the neuroprotectant action of berberine in rat model of transient global cerebral ischemia[J].European Journal of Pharmacology,2013,720:98-106.[12]Gotoh O,Asano T,Koide T,et al.Ischemic brain edema following occlusion of the middle cerebral artery in the rat.The time courses of the brain water,sodium and potassium contents and blood-brain barrier permeability to125I-albumin[J].Stroke,1985,16(1):101-109.
[13]Raslan A,Bhardwaj A.Medical management of cerebral edema[J].Neurosurg Focus,2007,22(5):E12.
[14]Goyagi T,Toung TJ,Kirsch JR,et al.Neuroprotective kappa-opioid receptor agonist BRL 52537 attenuates ischemia-evoked nitric oxide production in vivo in rats[J]. Stroke,2003,34(6):1533-1538.
[15]Braida D,Capurro V,Zani A,et al.Potential anxiolyticand antidepressant-like effects of salvinorin A,the main active ingredient of Salvia divinorum,in rodents[J].Br J Pharmacol,2009,157(5):844-853.
[16]Wang Z,Ma N,Riley J,et al.Salvinorin A administration after global cerebral hypoxia/ischemia preserves cerebrovascular autoregulation via kappa opioid receptor in piglets[J].PLoS One,2012,(7):e41724.
[17]Papadopoulos MC,Verkman AS.Aquaporin-4 and brain edema[J].Pediatr Nephrol,2007,2(6):778-784.
The non-oPioid KOR agonist Salovinorin A reducing brain edema in rats with forebrain ischemia and rePerfusion
ZHANG Yan WANG Zhenhong HE Zhenzhou XIN Jihua▲
Department of Anesthesiology,South Hospital of Renji Hospital,Shanghai Jiao Tong University School of Medicine, Shanghai201112,China
Objective To discuss the mechanism of Kappa opioid receptor(KOR)agonist Salvinorin A(SA)on decreasing brain edema after forebrain ischemia-reperfusion (I/R)injury in rats.Methods Male Sprague-Dawley rats were divided into 5 groups(n=10):sham operation group,I/R group,DMSO(vehicle)group,SA group and Norbinaltorphimine (nor-BIN,KOR antagonist)+SA group.Forebrain ischemia was performed by low artery pressure with bilateral carotid artery occlusion for 10 minutes.Intervenes(DMSO,SA,nor-BIN+SA)were performed after forebrain ischemia instantly. The animals were sacrificed 24 hours after reperfusion.The hippocampus was taken for pathology,and TdT-mediated dUTP nick end labeling (TUNEL)and immunohistochemical test were used for AQP4 detection.The wet-dry weight method was used to assess brain water content.Results Compared with sham operation group,hippocampus water content increased in I/R group(P<0.01).Hippocampus water content was significantly lower in SA group than that in I/R group(P<0.01).Hippocampus water content was significantly higher in nor-BIN+SA group than that in SA group(P<0.05).Compared with I/R and DMSO groups,hippocampus neurosis and apoptosis were alleviated significantly with treatment of SA 24 h after forebrain I/R (P<0.01),which effect was blunted by nor-BIN.Compared with sham operation group,AQP4 expressed in hippocampus was promoted by I/R (P<0.01).Compared with I/R group,AQP4 expressed was depressed in SA group (P<0.01).The expression of AQP4 increased significantly with treatment of nor-BIN+SA compared with SA (P<0.05).Conclusion SA can reduce cerebral edema after forebrain ischemia and brain damage by inhibition of AQP4.Its mechanism may be correlated with KOR.
Cerebral ischemia reperfusion;Cerebral edema;Cerebrum damage;Kappa opioid agonist;AQP4
R743.3
A
1673-7210(2015)11(a)-0004-05
2015-07-27本文编辑:程 铭)
国家自然科学基金项目(81300996);上海交通大学医学院科学技术基金资助项目(12XJ10054)。
▲通讯作者
