戊四氮致癫痫大鼠大脑皮质区突触体素、缝隙连接蛋白43、神经胶质原纤维酸性蛋白表达水平的变化
2015-11-28伍丽娜夏培生
林 敏 伍丽娜 夏培生 罗 虹
成都医学院人体解剖与组织胚胎学教研室,四川成都 610500
戊四氮致癫痫大鼠大脑皮质区突触体素、缝隙连接蛋白43、神经胶质原纤维酸性蛋白表达水平的变化
林 敏 伍丽娜▲夏培生 罗 虹
成都医学院人体解剖与组织胚胎学教研室,四川成都 610500
目的探讨戊四氮致癫痫大鼠大脑皮质区突触体素(SYN)、缝隙连接蛋白43(Cx43)以及神经胶质原纤维酸性蛋白(GFAP)表达水平的变化。方法 将30只雄性健康SD大鼠随机分为两组:对照组(n=15)和实验组(n= 15)。对照组腹腔注射与戊四氮致癫痫剂量等容量的生理盐水,实验组采用戊四氮35 mg/kg连续腹腔注射28 d后取脑。采用免疫组化染色检测大鼠大脑皮质区SYN、Cx43和GFAP表达的变化,采用Western blot测定大鼠大脑皮质区SYN、Cx43含量的变化。结果免疫组化染色:实验组大鼠大脑皮质区SYN(0.66±0.06)、Cx43(0.19±0.05)、GFAP(0.61±0.08)的平均吸光度值均高于对照组(0.43±0.05、0.11±0.03、0.36±0.05),差异有统计学意义(P<0.05)。Western blot:实验组大鼠大脑皮质区SYN(0.26±0.07)、Cx43(0.93±0.07)的表达水平均高于对照组(0.13±0.04、0.61±0.06),差异有统计学意义(P<0.05)。结论SYN、Cx43和GFAP的表达水平与癫痫的发生及发展密切相关,为研究癫痫的病因及发病机制提供依据。
癫痫;突触体素;缝隙连接;星形胶质细胞;戊四氮
癫痫是一组由大脑神经元异常放电所引起的短暂性中枢神经系统功能失常为特征的脑部慢性综合征。癫痫与突触密切相关,后者可分为化学突触和电突触两类。突触体素(synaptophysin,SYN)是一种广泛分布于突触前囊泡膜上的钙结合酸性糖蛋白,参与了化学突触传递的过程。近年来研究发现,缝隙连接为细胞膜上的一种特殊结构,构成相邻细胞间的通讯通道,信息离子及小分子可经该通道进行细胞间转运,在神经元电活动的维持、神经元快速同步化、神经元的发育中起着非常重要的作用[1]。星形胶质细胞则通过缝隙连接成为功能合胞体,参与维持神经元细胞外环境的动态平衡[2]。星形胶质细胞大量增生为癫痫病理特点之一,神经胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)作为星形胶质细胞的标志物广泛应用于癫痫发病机制的研究中。目前,癫痫的发病机制尚未完全阐明,以上3种物质在癫痫的发生、发展过程中究竟起着何种作用及三者之间存在怎样的联系一直困扰着笔者。为此,本实验采用戊四氮(pentetrazole,PTZ)点燃制作慢性癫痫模型,应用免疫组化和Western blot的方法观察SYN、缝隙连接蛋白(connexin,Cx)43和GFAP在大脑皮质区表达的水平变化,并探讨SYN、Cx43和GFAP与癫痫的关系及其在癫痫形成中的作用。
1 材料与方法
1.1 实验动物
由四川省人民医院实验动物研究所提供的健康雄性SD大鼠30只[许可证号:SCXK(川)2013-15],每只体重控制在(180±20)g。分笼饲养,环境温度20~25℃为宜。将其随机分为对照组(n=15)和实验组(n= 15)。
1.2 动物模型制备及行为学观察
PTZ购于北京精华耀邦医药科技有限公司,用前以生理盐水新鲜配制成溶液(10 g/L)。实验组给予PTZ亚惊厥剂量(35 mg/kg)腹腔注射,1次/d,连续注射28 d,观察大鼠的行为学变化。致癫痫的确定采用Racine评分标准,0级:行为上无反应;Ⅰ级:节律性口角和/或面部抽动;Ⅱ级:点头甩尾或阵挛性咀嚼;Ⅲ级:头部颤搐伴随前肢阵挛性抽搐;Ⅳ级:站立并伴双侧前肢阵挛;Ⅴ级:持续站立和倾倒,失平衡,四肢抽动。每天对每只大鼠在PTZ注射后监测30~60 min,并记录癫痫发作的级别、潜伏期(即注射PTZ到首次癫痫发作所需要的时间)和持续时间,凡连续5 d出现Ⅱ级以上癫痫发作的大鼠均为达到点燃模型标准。对照组用等容生理盐水代替PTZ腹腔注射。
1.3 取材
实验组大鼠致癫痫成功后,腹腔注射过量的水合氯醛麻醉大鼠,待大鼠活动减少出现麻醉特征后,将其固定。自左心室插管后剪开右心耳,灌注加入磷酸盐缓冲液(PBS),直到有澄清液从右心耳流出为止,再灌注4%多聚甲醛1 h。剪开颅骨,取出大脑组织,固定24 h后放入自动脱水包埋机中处理。然后进行修片,连续切片,片厚5 μm,连续5张进行贴片、烤片,备用。
1.4 免疫组化染色检查
采用Envision二步法进行SYN、Cx43和GFAP免疫组化染色。将各组切片置于二甲苯中脱腊,梯度乙醇中水化,0.01 mol/L的PBS液中冲洗(pH=7.2) 3次,3 min/次。高压热抗原修复4 min后再次PBS冲洗。用3%H2O2封闭内源性过氧化物酶,正常山羊血清封闭非特异性抗原。分别滴加SYN抗体(1∶150,武汉博士德生物工程有限公司)或Cx43抗体(1∶150,武汉博士德生物工程有限公司)或GFAP抗体(1∶150,武汉博士德生物工程有限公司),4℃冰箱过夜。复温,PBS冲洗3次,滴加兔抗鼠二抗后,置于37℃恒温箱中孵育60 min。加入DAB-H2O2显色液,室温下反应,显微镜下显色充分,及时用0.01 mol/L的PBS漂洗;苏木素复染,梯度乙醇脱水,二甲苯透明,树胶封片。显微镜下观察SYN、Cx43、GFAP的表达,棕黄色反应即表示出现阳性结果。
1.5 Western blot检测
采用Western blot检测大脑皮质区SYN和Cx43的含量。实验组大鼠致癫痫成功后,用过量的戊巴比妥钠麻醉大鼠,在冰冷的PBS中取出全脑,将皮质取出,包于干净锡纸中,标记后投入液氮中浸透,各组标本收集齐后从液氮转到-70℃冰箱冻存,准备好冰盒将皮质组织从液氮中取出剪碎后放于预冷匀浆器中,匀浆的同时加入RIPA蛋白裂解液(含PMSF 100 μmol/L),然后12 000 r/min离心15 min后去除沉淀,BCA蛋白定量后分装冻存。各电泳道取60 μg样品上样后进行SDS-PAGE电泳,转膜转膜。5%BSA中4℃封闭后用一抗(兔抗SYN多克隆抗体1∶400,兔抗Cx43多克隆抗体1∶400,兔抗GAPDH单抗1∶400)孵育2.5 h。然后TBST清洗3次,10 min/次。然后用HRP标记的二抗(山羊抗兔IgG抗体1∶1000)稀释,37℃孵育1 h后TBST清洗5次,10 min/次。最后于暗室ECL发光,经过显影定影后检测目的条带。胶片扫描后分析灰度值。
1.6 图像分析
采用Olympus数码照像机采集图像,每组由外到内依次选取10个高倍 (40×10)视野,观察SYN、Cx43、GFAP阳性产物在大脑皮质区的分布。分别计数实验组和对照组在大脑皮质区SYN、Cx43、GFAP的阳性细胞数量,测量阳性产物的平均吸光度值。
1.7 统计学方法
采用SPSS 17.0统计软件对数据进行分析和处理,计量资料以均数±标准差()表示,采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化染色结果
实验组大鼠大脑皮质区SYN、Cx43、GFAP平均吸光度值均高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组大鼠大脑皮质区SYN、Cx43、GFAP平均吸光度值比较()

表1 两组大鼠大脑皮质区SYN、Cx43、GFAP平均吸光度值比较()
注:与对照组比较,*P<0.05;SYN:突触体素;Cx43:缝隙连接蛋白43;GFAP:神经胶质原纤维酸性蛋白
组别 SYN Cx43 GFAP对照组(n=15)实验组(n=15)0.43±0.05 0.66±0.06*0.11±0.03 0.19±0.05*0.36±0.05 0.61±0.08*
对照组大鼠大脑皮质区偶见浅棕色的SYN阳性细胞,细胞较小,染色浅;实验组大鼠大脑皮质区SYN阳性细胞的表达显著增多,且SYN阳性细胞肥大,染色变深。对照组大鼠大脑皮质区见染色程度较弱的Cx43阳性细胞零星出现,Cx43阳性细胞的细胞质和细胞膜显浅棕色;实验组大鼠大脑皮质区Cx43阳性细胞的表达明显增多,Cx43阳性细胞质和细胞膜染色变深,显深棕色。在光镜下观察,对照组大鼠大脑皮质区可见染色程度较弱的GFAP阳性细胞,且阳性表达胞体小,突起细,数量少;实验组大鼠大脑皮质区GFAP阳性细胞的表达明显增多,GFAP阳性细胞肥大,染色变深呈深棕黄色,突起变粗变大,突起之间相互缠绕,连接更为紧密。见图1。
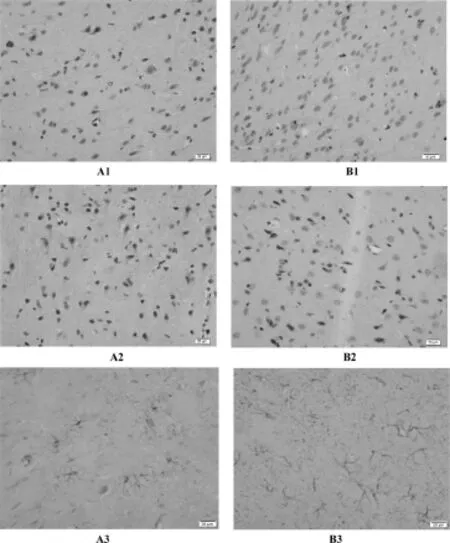
图1 两组大鼠大脑皮质区SYN、Cx43、GFAP表达情况(免疫组化染色,400×)
2.2 Western blot检测结果
实验组大鼠大脑皮质区SYN、Cx43表达水平高于对照组,差异有统计学意义(P<0.05)。见表2。两组大鼠大脑皮质区SYN、Cx43的Western blot检测结果见图2。
表2 两组大鼠大脑皮质中SYN、Cx43表达水平比较()

表2 两组大鼠大脑皮质中SYN、Cx43表达水平比较()
注:与对照组比较,*P<0.05;SYN:突触体素;Cx43:缝隙连接蛋白43
组别 SYN Cx43对照组(n=15)实验组(n=15)0.13±0.04 0.26±0.07*0.61±0.06 0.93±0.07*

图2 两组大鼠大脑皮质区SYN、Cx43表达情况(Western blot)
3 讨论
本实验研究显示,癫痫状态下皮质区SYN免疫反应产物密度普遍增加,与Pereno等[3]发现癫痫持续状态后在未丢失的神经元中SYN表达增强的结果一致。SYN是囊泡膜主要Ca2+结合位点,参与Ca2+依赖的神经递质的释放过程。癫痫发作时突触前终末囊泡数量增加,神经元的过度兴奋触发突触前膜上电压门控性Ca2+通道开放,Ca2+大量内流,激活Ca2+/CaM依赖性蛋白激酶系统,促进兴奋性氨基酸释放[4]。兴奋性氨基酸在癫痫的发生、发展过程中大量蓄积,随之结合大量的相应兴奋性氨基酸受体,使神经元异常放电,最终导致癫痫的发生。此外,通过与突触前膜Ca2+通道的功能性合作,SYN还促进了抑制性神经递质——γ-氨基丁酸(aminobutyric acid,GABA)的非同步释放[5]。同时检测到神经元细胞外Ca2+浓度持续增高可以改变神经元附近突触形态和兴奋性[6],神经递质的释放频率也被细胞内Ca2+的浓度所控制[7]。由此推测Ca2+从多方面参与SYN释放递质的过程,可能是癫痫发生的病理基础及突触可塑性的重要分子机制。
作为脑组织中数量最多的细胞,星形胶质细胞存在大量的Cx,其中以Cx43为主[8],它将星形胶质细胞连接成功能合胞体。正常情况下,星形胶质细胞间通过缝隙连接介导的细胞间通讯 (gap junctional intercellular communication,GJIC)起着传播细胞间钙波及保护神经元等重要作用,而在癫痫状态下,出现GFAP上调和Cx43表达及其功能的异常[9],Cx构象的改变可使缝隙连接通道处于开放或关闭状态[10-11]。本研究表明,戊四氮致癫痫大鼠大脑皮质区SYN、Cx43的表达水平明显高于对照组(P<0.05)。Cano-Abad等[12]发现钙通道异常使Ca2+过度内流,后者引起神经元持续去极化,形成同步性爆发性放电,导致癫痫的发生。细胞内钙超载致神经元凋亡,胶质细胞反应性增生,胶质细胞间Cx上调,引起神经元膜电位平衡性和稳定性紊乱[13]。因此,钙通道异常引起的神经元同步化放电和星形胶质细胞增生,Cx43上调等病理生理过程可能与癫痫密切相关。Xu等[14]在癫痫大鼠海马和患者皮质中检测到信号转导因子和转录激活因子3(signaltransducerandactivatoroftranscription-3,STAT3)与GFAP的共表达,发现癫痫参与STAT3的激活,后者上调了GFAP的表达。Geletu等[15]研究发现,STAT3是确保GJIC广泛性的基础。相反,STAT3的功能需要连接渗透性的维护[16]。因此,推测癫痫参与STAT3的激活,激活后的STAT3增加了缝隙连接间的广泛性和Cx43的表达,继而上调了GFAP的表达。同时,缝隙连接间渗透性的高低又影响STAT3的功能,继而影响癫痫激活STAT3的过程。神经元异常的同步性放电是癫痫发生的病生理基础,Beamer等[17]用免疫组化方法检测了SYN和GFAP,发现神经元的活动依靠突触传递与星形胶质细胞的增生。
综上所述,Ca2+既参与了化学突触中SYN释放神经递质的过程,又影响了电突触中缝隙连接管道的开放与关闭。STAT3则维护了细胞间缝隙连接通讯的广泛性。两者都能促进神经元的同步活动,加重神经元的异常放电,从而参与癫痫的发生、发展过程。因此,对SYN、Cx43和GFAP变化的动态观察有助于掌握癫痫的发展与预后。
[1]Carlen PI.The role of gap junctions in seizures[J].Brain Res Rev,2000,32:235-241.
[2]Chew SS,Johnson CS,Green CR,et al.Role of connexin43 in central nervous system injury[J].Exp Neurol,2010,225(2):250-261.
[3]Pereno GL,Beltramino CA.Timed changes of synaptic zinc,synaptophys in and MAP2 in medial extended amygdala of epileptic animals are suggestive of reactive neuroplasticity[J].Brain Res,2010,13(28):130-138.
[4]Ikegaya Y,Nishiyama N,Matsuki N.L-type Ca2+channel blocker inhibits mossy fibersprouting and cognitive deficits following pilocarpine seizures in immature mice[J]. Neuroscience,2000,98(4):647-659.
[5]Medrihan L,Cesca F,Raimondi A.SynapsinⅡ desynchronize sneurotransmitter release at inhibitory synapses by interacting with presynaptic calcium channels[J].Nat Commun,2013,4:1512.
[6]Ben Achour S,Pont-Lezica L,Béchade C,et al.Is astrocyte calcium signaling relevant for synaptic plasticity?[J]. Neuron Glia Biol,2010,6(3):147-155.
[7]Hirasawa H,Puopolo M,Raviola E.Extrasynaptic release of GABA by retinal dopaminergic neurons[J].J Neurophysiol,2009,102(1):146-158.
[8]Mathias RT,White TW,Gong X,et al.Lens gap junctions in growth differentiation and homeostasis[J].Physiol Rev,2010,90(1):179-206.
[9]Takahashi DK,Vargas JR.Increased coupling and altered glutamate transportcurrents in astrocytes following kainic-acid-induced status epilepticus[J].Neurobiol Dis,2010,40(3):573-585.
[10]Ham MI,Bettencourt LM,McDaniel FD,et al.Spontaneous Coordinated activity in cultured networks:analysis of multiple ignition sites,primary circuits,and burst phase delay distributions[J].J Comput Neurosci,2008,24(3):346-357.
[11]Su M,Tong XX.Astrocytic gap junction in the hippocampus of rats with lithium pilocarpine-induced epilepsy[J].Nan Fang Yi Ke Da Xue Xue Bao,2010,30(12):2738-2741.
[12]Cano-Abad MF,Herrera-Peco I,Sola RG,et al.New insights on culture and calcium signalling in neurons and astrocytes from epileptic patients[J].Int J Dev Neurosci,2011,29(2):121-129.
[13]Gasperini R,Choi-Lundberg D,Thompson MJ,et al. Homer regulates calcium signalling in growth cone turning[J].Neural Dev,2009,4(29):1-18.
[14]Xu Z,Xue T,Zhang Z,et al.Role of signal transducer and activator of transcription-3 in up-regulation of GFAP after epilepsy[J].Neurochem Res,2011,36(12):2208-2215.
[15]Geletu M,Arulanandam R,Greer S,et al.Stat3 is a positive regulator of gap junctional intercellular communication in cultured,human lung carcinoma cells [J].BMC Cancer,2012,12:605.
[16]Geletu M,Chaize C,Arulanandam R,et al.Stat3 activity is required for gap junctional permeability in normal rat liver epithelial cells [J].DNA Cell Biol,2009,28(7):319-327.
[17]Beamer E,Otahal J,Sills GJ,et al.N(w)-propyl-L-arginine(L-NPA)reduces status epilepticus and early epileptogenic events in a mouse model of epilepsy:behavioural,EEG and immunohistochemical analyses[J]. Eur J Neurosci,2012,36(9):3194-3203.
ExPression level change of SYN,Cx43 and GFAP in rat cerebral cortex after PTZ-induced ePilePsy
LIN Min WU Li'na▲XIA Peisheng LUO Hong
Department of Human Anatomy and Embryology,Chengdu Medical College,Sichuan Province,Chengdu 610500,China
Objective To explore expression level change of SYN,Cx43 and GFAP in rat cerebral cortex after PTZ-induced epilepsy.Methods 30 healthy male SD rats were randomly divided into two groups:control group(n=15)and experimental group (n=15).Control group was peritoneal injected with physiological saline,which had similar capacity with PZT.Brain tissues of experimental group were gained after 28 days intraperitoneal injection with PTZ 35 mg/kg every day.Immunohistochemisty was used to detect the expression of SYN,Cx43 and GFAP.Western blot was used to detect the expression of SYN and Cx43.Results Immunohistochemisty:average absorbance values of SYN (0.66±0.06), Cx43 (0.19±0.05),GFAP (0.61±0.08)of rat cerebral cortex in experimental group were higher than those in control group(0.43±0.05,0.11±0.03,0.36±0.05),with statistical differences(P<0.05).Western blot:expression level of SYN (0.26±0.07),Cx43(0.93±0.07)of rat cerebral cortex in experimental group were higher than those in control group(0.13± 0.04,0.61±0.06),with statistical differences(P<0.05).Conclusion The expression levels of SYN,Cx43 and GFAP are closely related with occurrence and development of epilepsy,which provides the basis for study of etiology and pathogenesis of epilepsy.
Epilepsy;Synaptophysin;Gap junction;Astrocyte;Pentetrazole
R971
A
1673-7210(2015)11(a)-0013-04
2015-06-08本文编辑:李亚聪)
四川省大学生创新性实验项目(201313705023)。▲
