栀子甙对碲化镉量子点的荧光淬灭作用
2015-11-27张浩,王芳,马静,卞伟
张 浩,王 芳,马 静,卞 伟
(山西医科大学,山西 太原 030001)
量子点(Quantum dots,QDs)又称为纳米晶,由于其粒径进入纳米量级,因而具有尺寸效应、表面效应、量子隧道效应和介电限域效应.量子点作为一种新型的纳米材料,与一些传统的有机染料和荧光蛋白相比具有很多优良的光学性质,例如具有宽的激发光谱,窄且对称的发射光谱,好的光化学稳定性等,使其在如生物分析、药物的检测、生物成像、重金属离子的检测等诸多研究领域受到广泛的关注[1-6].目前对CdTe量子点的应用主要有金属离子检测、生物分析、药物的检测等.如GAN等[7]利用Ag+对CdTe量子点的荧光淬灭作用,成功将CdTe量子点作为荧光探针用于测定Ag+的含量.SUN等[8]发现了CdTe量子点与过氧化氢酶的相互作用,通过改变酶的构象和功能达到对过氧化氢酶的抑制作用.LAI等[9]研究了不同配体的CdTe量子点与人血清白蛋白的相互作用,并对作用机制进行了探讨.TAN等[10]利用山奈酚对CdTe量子点的荧光淬灭效应建立了一种检测山奈酚含量的简单、高效的方法.赵雅琼等[11]利用CdTe量子点荧光探针测定氯霉素含量,并通过回收率实验验证了方法的可行性.
栀子甙是栀子的主要提取物,具有清热导泻,增强细胞对拟胆碱药物的敏感性,增加细胞膜的去极化[12]等作用.目前对栀子甙的检测方法有薄层扫描法[13]、紫外分光光度法[14]、高效液相色谱法[15]等.但是这些方法存在操作较为繁琐、准确度较低、分析时间长等缺点.与之相比,荧光光谱法具有操作简单,灵敏度高,选择性好等特点.本文作者采用水相合成法制备了3-巯基丙酸稳定的CdTe量子点.基于栀子甙对该量子点的荧光淬灭作用,建立了一种对栀子甙检测的新方法,并将该方法用于栀子甙的定量测定.通过加入栀子甙前后量子点紫外吸收光谱的变化以及温度变化对两者荧光淬灭常数的影响,对栀子甙与该量子点相互作用的机理进行了初步讨论.
1 实验部分
1.1 仪器与试剂
BS124S电子分析天平(德国Sartorius公司);FE20pH酸度计(瑞士Mettler Toledo公司);TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);DF-101S集热式恒温搅拌器(杭州瑞佳精密科学仪器有限公司);Cary Eclipse型荧光分光光度计(美国VARIAN公司);Paragon 1000型红外光谱仪(美国Perkin-Elmer公司);DZF-6020真空干燥箱(上海一恒科学仪器有限公司).
硼氢化钠(天津市福晨化学试剂厂);碲粉(天津市光复精细化工研究所);2.5水合氯化镉(西安化学试剂厂);3-巯基丙酸(MPA,阿拉丁试剂上海有限公司,98%);氢氧化钠(北京化工厂);磷酸(南京化学试剂有限公司);磷酸二氢钠、磷酸氢二钠、磷酸三钠(天津市博迪化工有限公司);异丙醇(南京化学试剂有限公司);栀子甙标准对照品(中国药品生物制品检定所).实验中所用碲粉为优级纯,其余化学试剂均为分析纯,实验用水为二次蒸馏水.
1.2 实验方法
1.2.1 水溶性量子点的制备
称取0.040 9g NaBH4和0.060 2g碲粉置于5 mL单口烧瓶中,通入N215min后加入2mL二次蒸馏水,剧烈搅拌并关闭N2,冰浴反应4h后即得粉红色NaHTe.取91.3mg氯化镉和60μL MPA溶于二次蒸馏水中,定容至100mL.用1.0mol/L的NaOH溶液调节pH至11.通N230min后加入上述NaHTe 0.4mL,100℃油浴反应6h后即制得MPA稳定的CdTe量子点[16].所得的溶液用等体积异丙醇沉降,离心分离,用二次蒸馏水清洗3次,所得固体置于真空干燥箱干燥,即得MPA稳定的CdTe量子点固体粉末.
1.2.2 栀子甙的测定方法
栀子甙标准溶液的配制:称取0.040 4g栀子甙并用二次蒸馏水稀释至10mL,得到c=1×10-2mol/L的栀子甙储备液.使用时用二次蒸馏水稀释至所需浓度即可.
于5mL的比色管中加入30μL CdTe量子点溶液和不同体积的栀子甙标准溶液,用浓度为10 mmol/L的磷酸缓冲溶液(pH=8.00)定容至刻度,使量子点的最终浓度为1.6×10-8mol/L,摇匀,放置25min后扫描其荧光光谱.设置激发波长为360 nm,在450~700nm范围内测定其荧光强度(下文分别以F0和F表示加入栀子甙前后该量子点的荧光强度),激发和发射狭缝宽度均为5nm.
1.2.3 尿样的制备
尿样来自于健康人群.检测前将样品离心分离,取上清液储存于瓶中,测定时用二次蒸馏水稀释1 000倍即可,不需要进一步的复杂预处理.
2 结果与讨论
2.1 CdTe量子点的表征
2.1.1 CdTe量子点的紫外-可见吸收光谱和荧光光谱
图1a是CdTe量子点的紫外-可见吸收光谱图.图中显示该量子点的最强紫外吸收峰在540 nm附近,根据以下公式可以计算出CdTe量子点的粒径为3.22nm[17].
D=9.812 7×10-7λ3-1.714 7×10-3λ2+1.006 4λ-194.84
式中:D为量子点的直径,λ为量子点的最大吸收波长.
图1b是CdTe量子点溶液在360nm激发波长下的荧光发射光谱图,从图中可以看出CdTe量子点发射峰较窄且对称,于576nm处有最大发射波长.
2.1.2 CdTe量子点的傅立叶变换红外光谱
图2a和2b分别为MPA以及MPA稳定的CdTe量子点的傅立叶变换红外光谱图.从图中可以看出MPA光谱中2 579cm-1处的S-H伸缩振动峰在所合成的MPA稳定的CdTe量子点的图谱中消失.而2 949cm-1处-OH及1 717cm-1处的-COOH特征吸收峰仍然存在,但MPA光谱中2 949cm-1处的-OH的特征吸收峰在所合成量子点的图谱中红移至3 402cm-1,在所合成量子点的图谱中1 560和1 402cm-1处的两个峰为羧酸盐的特征峰.因此,可以初步认为MPA通过巯基与CdTe连接,同时MPA中的羧基与Cd2+发生了配位作用,说明MPA成功地包覆在CdTe量子点的表面.
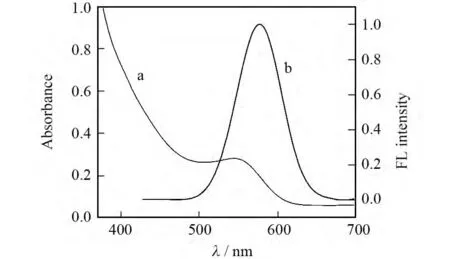
图1 MPA稳定的CdTe量子点的UV-Vis光谱(a)图和FL光谱(b)图Fig.1 UV-Vis spectrum(a)and FL spectrum(b)of MPA capped CdTe QDs
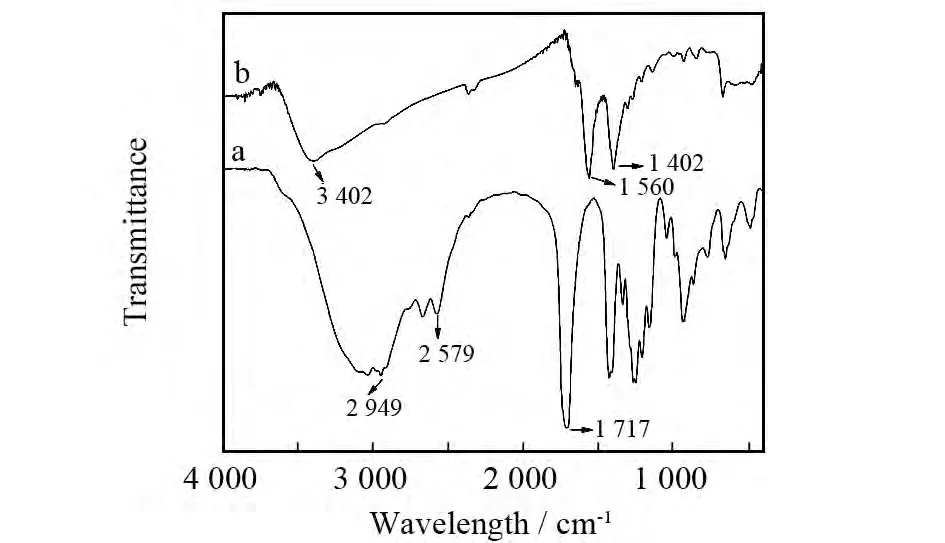
图2 MPA(a)以及MPA稳定的CdTe量子点(b)的FT-IR图Fig.2 FT-IR spectra of pure MPA(a)and MPA capped CdTe QDs(b)
2.2 最佳实验条件的选择
2.2.1 酸度的影响
不同pH的缓冲溶液可能会影响检测的灵敏度和选择性,因此实验考察了体系酸度对量子点以及量子点-栀子甙体系荧光强度的影响,结果如图3所示.可以看出,在酸性条件下,量子点自身的荧光强度的变化很小.而当pH在7.00~8.50的范围内,量子点自身的荧光强度随着溶液pH的增强而增大,当pH在9.00~10.00的范围内,荧光强度略有下降.在加入栀子甙后ΔF(ΔF=F-F0)在pH为6.00~10.00的范围内较大,并在pH=8.00时达到最大.因此,实验选择pH=8.00的Na2HPO4-NaH2PO4缓冲溶液.
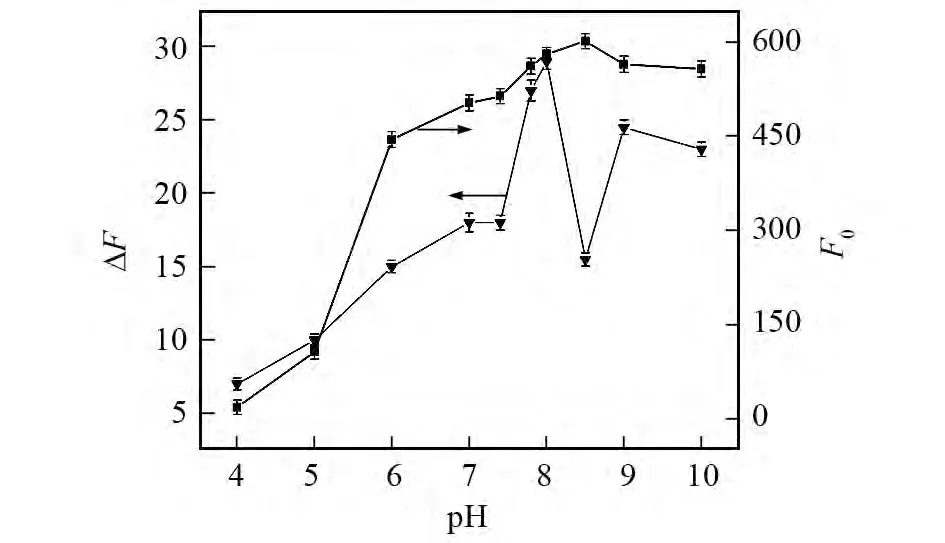
图3 pH对MPA稳定的CdTe量子点(—■—)以及量子点-栀子甙体系(—▼—)的影响Fig.3 Effect of pH on fluorescence intensity of MPA capped CdTe QDs(—■—)and the quenched fluorescence intensity of QDs upon addition of gardenoside(—▼—)
2.2.2 量子点浓度的影响
在pH=8.00的实验条件下,考察了量子点浓度对量子点-栀子甙体系荧光强度的影响,结果如图4所示.可以看出,该量子点-栀子甙的灵敏度随量子点浓度的升高呈先升后降的趋势,量子点浓度为1.6×10-8mol/L时对栀子甙测定的灵敏度最高.因此,本实验选择CdTe量子点浓度为1.6×10-8mol/L.
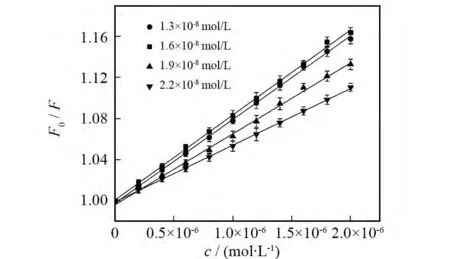
图4 MPA稳定的CdTe量子点浓度对量子点-栀子甙体系的影响Fig.4 Effect of varied concentrations of MPA capped QDs on QDs-gardenoside system
2.2.3 反应时间的确定
本实验研究了在pH=8.00,量子点浓度为1.6×10-8mol/L的条件下反应时间对荧光强度的影响.如图5所示,CdTe量子点的荧光强度在加入栀子甙后的10min内急剧下降,25min后CdTe量子点的荧光强度趋于稳定,说明反应基本完成,因此实验中反应时间选取为25min.
2.3 栀子甙对CdTe量子点的荧光光谱的影响
图6a为在pH=8.00,量子点浓度为1.6×10-8mol/L的实验条件下,不同浓度的栀子甙对CdTe量子点荧光强度的影响.随着栀子甙浓度的逐渐增大,量子点的荧光强度逐渐降低.栀子甙浓度在2×10-7~4×10-6mol/L的范围内与量子点的荧光强度变化之间呈良好的线性关系,且符合Stern-Volmer方程[18],如图6b所示的线性方程为F0/F=0.008 9 c+0.998 8,相关系数(r)为0.999 4.此方程中c表示栀子甙的浓度,单位为10-7mol/L.该方法检出限为1.4×10-7mol/L.加入2μmol/L的栀子甙重复测量11次的相对标准偏差为0.355%.
2.4 干扰实验
在最优条件下研究了一些常见金属阳离子以及氨基酸对栀子甙测定的干扰,结果列于表1.由表中数据可知,钠离子、钾离子、果糖以及大部分氨基酸对测定的干扰非常小,而其余金属离子和氨基酸等较上述物质影响略大,但由于离子浓度在药物中有严格的限制,且相对于栀子甙来说这些物质的浓度较大,因而在实际样品测定时并不会影响实验结果,由此我们认为该检测方法具有较好的选择性.
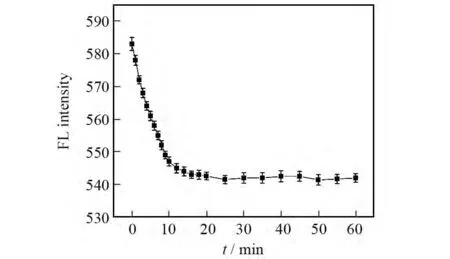
图5 反应时间对MPA稳定的CdTe量子点-栀子甙体系的影响Fig.5 Effect of time on fluorescence intensity of MPA capped CdTe QDs upon addition of gardenoside
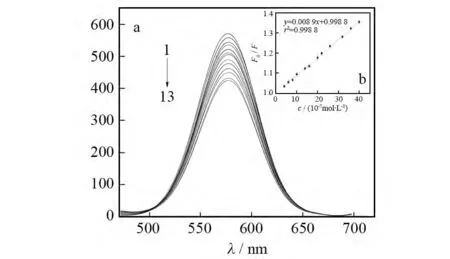
图6 不同浓度栀子甙存在时MPA稳定的CdTe量子点荧光强度的变化(a)和MPA稳定的CdTe量子点的荧光强度变化与栀子甙浓度间的线性关系(b)Fig.6 Fluorescence spectra of MPA capped CdTe QDs in presence of various concentration of gardenoside(a)and the linear relationship between fluorescence intensity of MPA capped CdTe QDs and concentrations of gardenoside(b)
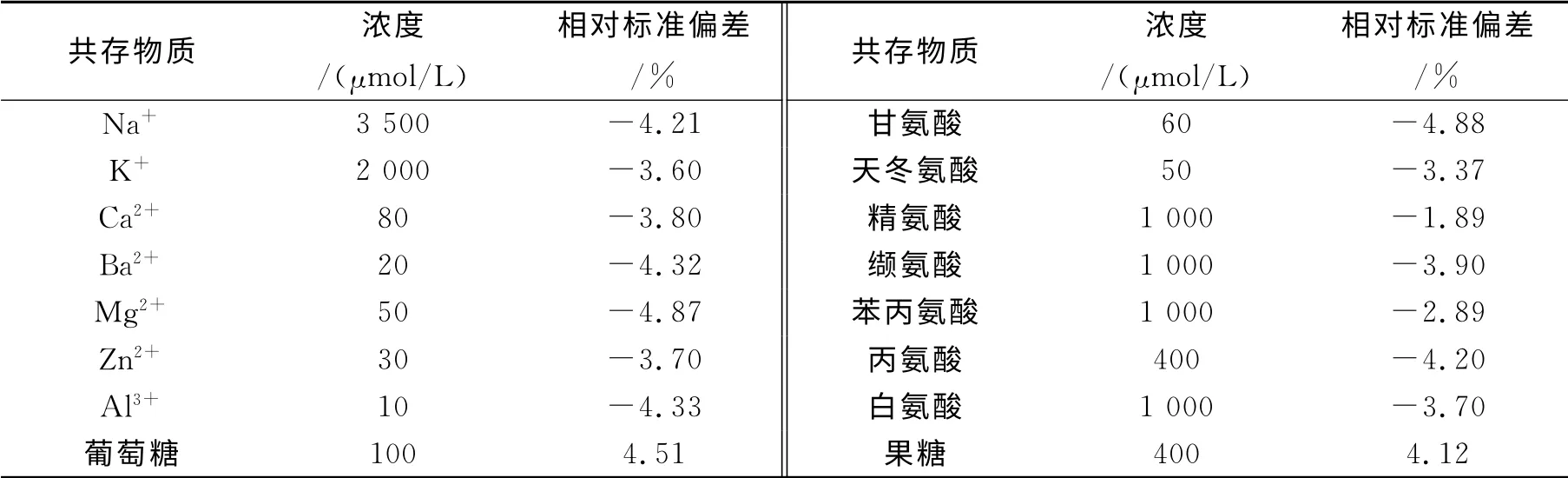
表1 共存物质对体系的影响Table1 Effect of co-existing substances on the quenched fluorescence intensity of MPA capped CdTe QDs
2.5 机理初步探讨
荧光淬灭过程通常分为静态淬灭和动态淬灭两种,分别用Stern-Volmer方程及Lineweaver-Burk方程表示.动态淬灭的效率受荧光物质激发态寿命和淬灭剂浓度的影响,不会改变荧光物质的吸收光谱,并且动态淬灭的过程是碰撞过程,与扩散有关,因此温度升高时分子运动加速,使分子的扩散系数增大,从而增大了双分子淬灭常数.静态淬灭是淬灭剂与荧光物质的基态分子发生配合反应,所以荧光物质的吸收光谱会发生变化.由于温度升高,使配合物的稳定度下降,从而降低了双分子淬灭常数,因此可以通过吸收光谱和温度对淬灭常数的影响来初步推断荧光淬灭的类型[18].
从图7可以看出,栀子甙加入到量子点溶液前后量子点的紫外吸收光谱基本没有变化,初步判断栀子甙与量子点的基态分子之间并没有形成配合物.图6b表明,栀子甙浓度与该量子点荧光强度的变化之间符合Stern-Volmer方程,并且图8及表2中数据显示量子点的荧光淬灭常数随着温度的升高而增大.综上所述,我们认为栀子甙对量子点的荧光淬灭主要为动态淬灭过程.这可能是因为价带的电子激发进入导带形成电子-空穴对,导带上的电子被栀子甙捕获,破坏了电子-空穴对的复合,导致量子点的荧光淬灭[19].

图7 栀子甙加入到MPA稳定的CdTe量子点溶液前后的紫外-可见吸收光谱Fig.7 Absorption spectra of MPA capped CdTe quantum dots with and without gardenoside
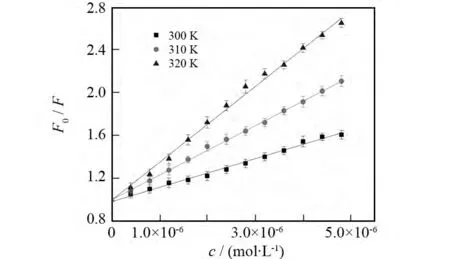
图8 温度对MPA稳定的CdTe量子点-栀子甙体系荧光强度的影响Fig.8 Effect of temperature on fluorescence intensity of MPA capped CdTe QDs-gardenosid

表2 不同温度下Stern-Volmer方程的参数Table 2 Parameters of Stern-Volmer plots of MPA capped CdTe QDs and gardenoside
2.6 实际样品的检测
将所建立的分析方法用于健康人尿液中栀子甙的加标回收实验,结果(表3)表明在人体体液中栀子甙的回收率位于97.5%~102.0%之间.该实验结果表明在人体体液中用该方法测定栀子甙含量是可行的.

表3 实际样品中栀子甙的测定结果Table 3 Recovery(mean±SD;n=3)for determination of gardenoside in samples by using MPA capped CdTe QDs
3 结论
合成了水溶性的MPA稳定的CdTe量子点,基于栀子甙对该量子点的荧光淬灭现象建立了一种测定栀子甙含量的荧光测定方法.在最优实验条件下,栀子甙浓度在2×10-7~4×10-6mol/L范围内与该量子点的荧光强度变化呈良好的线性关系,检出限为1.4×10-7mol/L.本方法操作简单、选择性好,一些常见金属阳离子以及氨基酸对栀子甙含量测定的干扰很小.回收率实验表明本方法可用于人体体液中栀子甙含量的测定.同时,通过加入栀子甙前后量子点紫外吸收光谱的变化以及栀子甙对量子点的荧光淬灭常数随温度变化情况,本文作者初步推断栀子甙对量子点荧光淬灭类型是动态淬灭.
[1]BRUCHEZ M Jr,MORONNE M,GIN P,et al.Semiconductor nanocrystals as fluorescent biological labels[J].Science,1998,281(5385):2013-2016.
[2]MEDINTZ I L,UYEDA H T,GOLDMAN E R,et al.Quantum dot bioconjugates for imaging,labelling and sensing[J].Nat Mater,2005,4(6):435-446.
[3]LI Y,HU Y,ZHAO Y,et al.An electrochemical avenue to green-luminescent graphene quantum dots as potential electron-acceptors for photovoltaics[J].Adv Mater,2011,23(6):776-780.
[4]PETRYAYEVA E,ALGAR W R,MEDINTZ I L.Quantum dots in bioanalysis:a review of applications across various platforms for fluorescence spectroscopy and imaging[J].Appl Spectrosc,2013,67(3):215-252.
[5]DUBERTRET B,SKOURIDES P,NORRIS D J,et al.In vivo imaging of quantum dots encapsulated in phospholipids micelles[J].Science,2002,298(5599):1759-1762.
[6]LIU B Y,ZENG F,WU G F,et al.Nanoparticles as scaffolds for FRET-based ratiometric detection of mercury ions in water with QDs as donors[J].Analyst,2012,137(16):3717-3724.
[7]GAN T T,ZHANG Y J,ZHAO N J,et al.Hydrothermal synthetic mercaptopropionic acid stabled CdTe quantum dots as fluorescent probes for detection of Ag+[J].Spectrochim Acta A,2012,99:62-68.
[8]SUN H Y,YANG B J,CUI E Q,et al.Spectroscopic investigations on the effect of n-acetyl-L-cysteine-capped cdte quantum dots on catalase[J].Spectrochim Acta A,2014,132:692-699.
[9]LAI L,LIN C,XU Z Q,et al.Spectroscopic studies on the interactions between CdTe quantum dots coated with different ligands and human serum albumin[J].Spectrochim Acta A,2012,97:366-376.
[10]TAN X P,LIU S P,SHEN Y Z,et al.Quantum dots(QDs)based fluorescnce probe for the sensitive determination of kaempferol[J].Spectrochim Acta A,2014,133:66-72.
[11]赵雅琼,赵芳,倪刚.CdTe量子点荧光探针测定氯霉素含量的研究[J].化学研究与应用,2013,25(9):1267-1269.
[12]李利娟,李宏霞,吴欣桐,等.栀子甙对血管性痴呆大鼠行为学和脑组织病理改变的影响[J].四川大学学报:医学版,2009,40(4):604-607.
[13]李桂兰,巴雅尔,荀雅书.薄层扫描法测定沙日-毛都-8中栀子甙的含量[J].中国民族医药杂志,2002,8(4):39-40.
[14]袁翠美,马自超.紫外分光光度法测定栀子黄色素中栀子酚和栀子甙的含量[J].中国野生植物资源,1993(4):9-11.
[15]李丽.HPLC测定黄连上清丸中栀子甙的含量[J].中成药,2000,22(2):133.
[16]GAPONIK N,TALAPIN D V,ROGACH A L,et al.Thiol-capping of CdTe nanocrystals:an alternative to organometallic synthetic routes[J].J Phys Chem B,2002,106(29):7177-7185.
[17]YU W W,Qu L H,Guo W Z,et al.Experimental determination of the extinction coefficient of CdTe,CdSe,and CdS nanocrystals[J].Chem Mater,2003,15(14):2854-2860.
[18]许金钩,王尊本.荧光分析法[M].北京:科学出版社,2006.
[19]LIU Z Q,YIN P F,GONG H P,et al.Determination of rifampicin based on fluorescence quenching of GSH capped CdTe/ZnS QDs[J].J Lumin,2012,132(9):2484-2488.
