TPD52基因与原发性肝细胞癌患者预后相关性分析
2015-11-27王颖陈昶泷黄绪琼夏建川张建华
王颖,陈昶泷,黄绪琼,夏建川,张建华
·论著·
TPD52基因与原发性肝细胞癌患者预后相关性分析
王颖*,陈昶泷*,黄绪琼,夏建川,张建华
目的 探索 TPD52 基因在原发性肝细胞癌中的表达及与患者预后的关系。
癌,肝细胞;预后;肿瘤蛋白质类;TPD52
原发性肝癌,是我国最常见的恶性肿瘤之一,有着起病隐匿、恶性程度高、易复发、病死率高等特点[1]。原发性肝癌中大约 75% 属于肝细胞型肝癌(HCC)[2],其发生受环境和遗传因素共同影响,遗传因素决定了个体的肝癌易感性,相关基因的研究对肝癌的诊断和预后评估起到重要作用。
肿瘤蛋白 D52(tumor protein D52,TPD52),是癌蛋白 D52 家族的成员之一,参与调节细胞存活、增殖、迁移、侵袭[3-4]、DNA 修复[5-6]等,且与肿瘤发生、发展有着密切关系,但其与肝癌发生发展的关系尚不明确。本研究通过对 TPD52 基因在HCC 中的表达及与临床参数、患者预后之间关系的分析,为肝癌的诊疗和预后评估提供新方向。
1 材料与方法
1.1 材料
1.1.1 标本 收集从 2001-2004年在中山大学附属肿瘤医院被确诊为 HCC 患者的肿瘤组织石蜡切片标本 173 例,所有标本经常规病理检查后确诊为肝细胞癌,并进行病理分级。所选取的病例术前均未接受放疗及化疗,其中男 138 例,女35 例。同时收集 2012-2015年手术切除的33 份新鲜肿瘤组织标本及其相对应的癌旁组织标本,标本病例均确诊为 HCC。两组病例一般资料无统计学差异。所有患者的临床分期是根据美国癌症联合委员会(AJCC)及国际抗癌联盟(UICC)推荐的tumor-nodes-metastasis(TNM)分期标准[7]进行确定。本研究获得中山大学附属肿瘤医院伦理委员会批准,所有患者均签署了知情同意书。
1.1.2 试剂与仪器 Bio-Rad CFX96 型荧光定量PCR 仪为新加坡 Bio-Rad 公司产品;Eclipse80i型高级研究型显微镜为日本尼康公司产品;RPMI 1640 培养基购自美国 Gibco 公司;RNAlater 溶液购自美国 Thermo Fisher Scientific 公司;GoScript™逆转录试剂盒和荧光定量 PCR 试剂 SYBR Green master mix 均购自美国 Promega 公司;抗 TPD52抗体购自北京博奥森公司;生物素标记二抗GK500705 购自上海 Gene Tech 公司。
1.2 方法
1.2.1 荧光实时定量 RT-PCR 新鲜组织切下后置于无血清 RPMI 1640 培养基中洗去血渍,剪成约 0.5 cm × 0.5 cm × 0.5 cm 小块置于 RNAlater溶液中 4 ℃ 过夜,于 -80 ℃ 冰箱保存以备用。取适量组织标本充分剪碎并研磨,加氯仿,冰上静置5 min 后离心取上清,加异丙醇,冰上静置 10 min后弃上清,加 75% 乙醇重悬沉淀后弃上清,加入无 RNase 水溶解得到 RNA。应用逆转录试剂盒将所得 RNA 合成逆转录产物 cDNA。已合成的cDNA、荧光定量 PCR 试剂及去离子水分别与TPD52 引物、GAPDH 引物(序列来源于参考文献[4,8])形成混合物,并根据试剂盒说明书设定扩增程序后对混合物进行荧光实时定量 RT-PCR 扩增,由此检测肝癌组织和对于癌旁组织中 TPD52和 GAPDH 的 mRNA 水平。以 GAPDH 的mRNA 水平为内参,采用比较循环阈值(2-ΔΔCt)方法分别计算肝癌组织和癌旁组织中 TPD52 基因mRNA 的相对表达水平。
1.2.2 免疫组织化学染色法 石蜡切片利用免疫组织化学染色法,检测 TPD52 蛋白在肝癌组织中的表达水平。3 μm 连续切片后采用二甲苯 30 min脱蜡,经 100%、95%、90%、80%、75% 梯度酒精水化,以 pH 8.0 的 EDTA 抗原修复液微波高火修复 10 min 后转中低火 15 min,自然冷却后用3% 双氧水孵育 10 min,以消除内源性过氧化物的活性,正常山羊血清室温封闭 30 min 后,滴加抗TPD52 抗体(稀释比例 1∶400)于 4 ℃ 冷库孵育过夜,次日晾至室温后 PBS 缓冲液冲洗,滴加相应的生物素标记二抗孵育 30 min,DAB 显色,苏木素浅染细胞核,1% 盐酸酒精复染数秒,经 70%、80%、90%、95%、100% 梯度酒精脱水透明后,中性树胶封片。
1.2.3 免疫组织化学染色结果评定 所有染色结果由两位病理医生独立以盲法观察确定,以细胞呈清晰棕色或棕褐色为阳性。高倍镜(× 400)下随机选取 4 个不同视野,计算细胞总数及阳性细胞数,按阳性细胞所占的百分比计分:阳性细胞率 ≤ 5%为 0 分,阳性细胞率 > 5% 且 ≤ 25% 为 1 分,阳性细胞率 > 25% 且 ≤ 50% 为 2 分,阳性细胞率 > 50% 为 3 分;同时,根据染色的强弱程度计分:阴性染色为 0 分,弱染色为 1 分,中等强度染色为 2 分,强染色为 3 分。最终根据两者的乘积确定该组织标本的免疫组化评分值:0~1分为阴性,2~3分为弱阳性,4~6分为中度阳性,> 6 分为强阳性。按照评分结果将 TPD52 表达定义为低表达组(阴性及弱阳性)及高表达组(中度阳性及强阳性)。
1.2.4 随访 对所选择病例进行随访,术后前2年每 3 个月随访一次,第 3~5年每 6 个月随访一次,以后每年随访一次直至患者死亡或因其他原因失访。随访主要了解患者当前是否生存,若患者已死亡,明确其死亡时间和死亡原因是否与肝癌有关。
1.3 统计学处理
采用 SPSS 20.0 统计软件进行数据分析,肿瘤组织与癌旁组织的 TPD52 mRNA 表达水平差异采用秩和检验,TPD52 蛋白表达水平和临床指标间的关系采用卡方检验及 Pearson's 等级相关分析,TPD52 蛋白表达水平与患者生存关系分析采用Kaplan-Meier方法及 log-rank 检验,双侧检验P <0.05 为差异有统计学意义。
2 结果
2.1 TPD52 mRNA 在肝癌组织及配对癌旁组织中的表达
通过荧光实时定量 RT-PCR 检测,发现肝癌组织中 TPD52 基因 mRNA 表达水平明显低于癌旁组织,且 P < 0.001,两者比较差异有统计学意义(图1)。
2.2 TPD52 蛋白在肝癌组织中的表达
免疫组化染色结果发现,在 173 例肝癌病例中,98 例(56.6%)肝癌组织中的 TPD52 蛋白表达下调,75 例(43.4%)肝癌组织中的 TPD52 蛋白表达上调。TPD52 阳性染色主要位于细胞胞浆,呈棕色或棕褐色,主要分布在癌旁、正常组织及TNM 分期较低的肝癌组织中。肝癌组织中 TPD52表达通常较低,而癌旁的正常组织通常为高表达(图2),TNM 分期越高,TPD52 表达越低(图3)。

图2 肝癌组织(A)及癌旁组织(B)TPD52 蛋白的表达(× 200)Figure 2 TPD52 protein expression levels in tumor (A) and non-tumor (B) tissue (× 200)

图3 TPD52 在不同 TNM 分期的肝癌组织中的表达(A:I 期,× 200;B:II 期,× 200;C:III 期,× 200)Figure 3 TPD52 protein expression in tumor tissues according to TNM stages (A: I TNM stage, × 200; B: II TNM stage, × 200; C:III TNM stage, × 200)
2.3 临床病理特征与 TPD52 蛋白表达及患者预后的关系
根据免疫组化染色强度评分结果分为 TPD52高表达组和低表达组。卡方检验表明,TPD52 在肝癌组织中的表达在患者年龄、性别、HBV 感染与否、肿瘤大小、肿瘤是否多发、是否肝硬化、AFP 高低、病理分级等中的差异均无统计学意义,但TPD52 高表达与低的 TNM 分期相关(P = 0.023)。生存分析表明,肿瘤大小、肿瘤是否多发、TNM分期与患者 5年生存率相关(P = 0.002,<0.001,< 0.001),见表1。
2.4 TPD52 表达与患者预后相关性分析
2.4.1 总生存分析 如图4 所示,173 例患者的1、3、5年总生存率分别为 86.1%、71.4% 和51.9%。TPD52 高表达组和低表达组的患者 5年总生存率分别为 64.3% 和 42.2%。TPD52 低表达组患者的总生存率及无病进展生存率均显著低于TPD52 高表达组患者(P = 0.003,P = 0.013)。
2.4.2 亚群分析
2.4.2.1 TPD52 的表达对不同肿瘤大小患者生存预后的影响 如图5 所示,肿瘤直径小于 5 cm患者中,TPD52 高表达组患者总生存率及无病进展生存率均较低表达组的高,且 P 值均有统计学意义(P = 0.015,P = 0.023)。但 TPD52 的表达对肿瘤大于 5 cm 患者的生存预后的影响无明显统计学意义。
2.4.2.2 TPD52 的表达对肿瘤单发或多发患者生存预后的影响 如图6 所示,肿瘤单发的患者中,TPD52 高表达组总生存率及无病进展生存率均较低表达组的高,且差异具有统计学意义(P = 0.025,P = 0.047)。而肿瘤多发的患者中,TPD52 高表达组与低表达组间总生存率及无病进展生存率均无明显统计学差异。
2.4.2.3 TPD52 的表达对不同 TNM 分期患者生存预后的影响 如图7 所示,TNM 分期为 I~II 期的患者中,TPD52 高表达组与低表达组间的患者总生存率及无病进展生存率无明显差异。但TNM 分期为 III 期的患者中,TPD52 高表达组的患者总生存率及无病进展生存率均高于低表达组,且差异具有统计学意义(P = 0.018,P = 0.034)。

表1 TPD52 基因表达水平与肝癌各临床病理特征的关系Table 1 Relationship between TPD52 expression and clinicopathological features of HCC patients
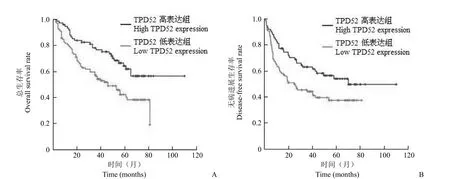
图4 根据 TPD52 表达水平对 173 例患者进行的生存分析(A:总生存率,P = 0.003;B:无病进展生存率,P = 0.013)Figure 4 Kaplan-Meier survival curves of the 173 HCC patients according to TPD52 expression (A: Overall survival rate, P = 0.003; B: Disease-free survival rate, P = 0.013)
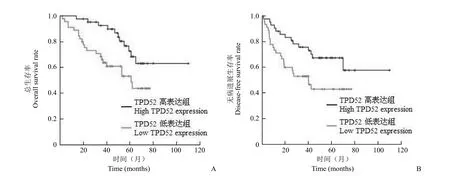
图5 TPD52 的表达对肿瘤 < 5 cm 患者生存预后的影响(A:总生存率,P = 0.015;B:无病进展生存率,P = 0.023)Figure 5 The effect of TPD52 expression on the survival of HCC patients with tumor size < 5 cm (A: Overall survival rate, P = 0.015; B: Disease-free survival rate, P = 0.023)
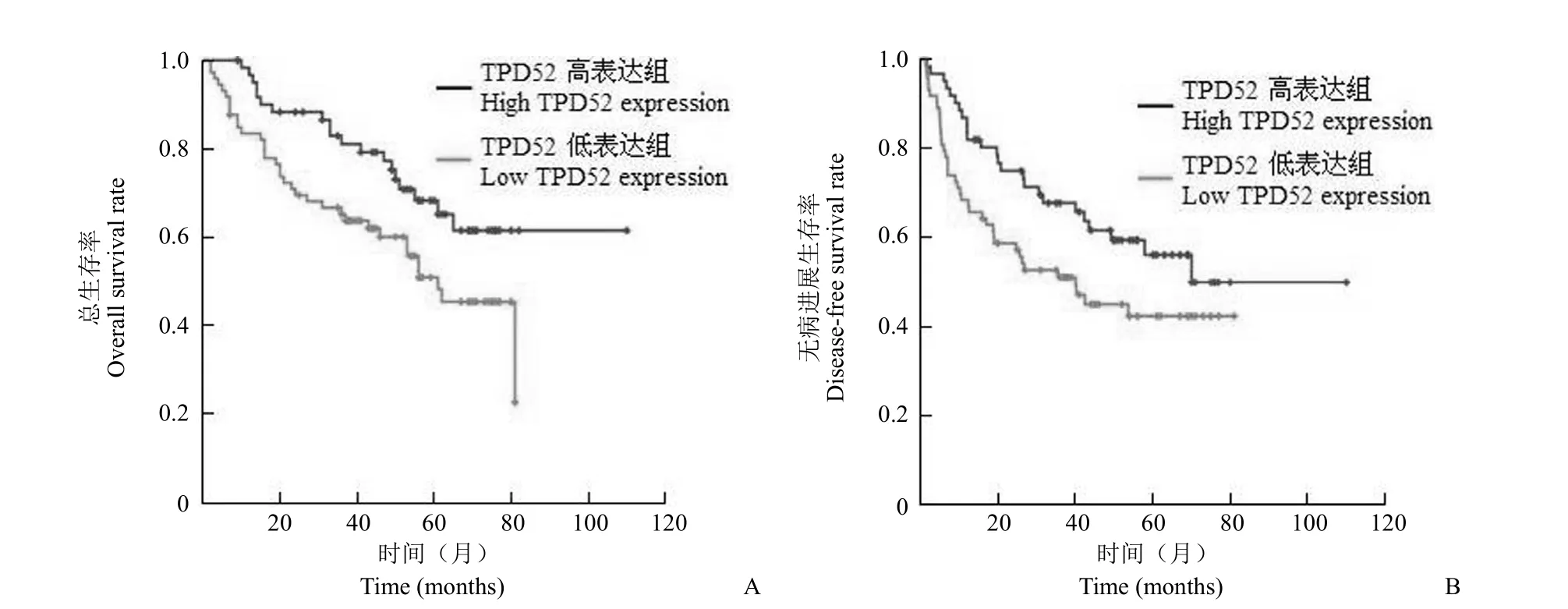
图6 TPD52 的表达对肿瘤单发患者生存预后的影响(A:总生存率,P = 0.025;B:无病进展生存率,P = 0.047)Figure 6 The effect of TPD52 expression on the survival of HCC patients with single tumor (A: Overall survival rate, P = 0.025; B:Disease-free survival rate, P = 0.047)
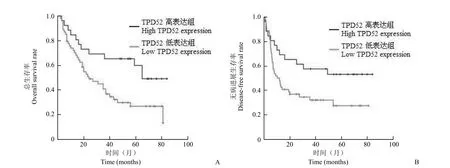
图7 TPD52 的表达对 TNM 分期 III 期患者生存预后的影响(A:总生存率,P = 0.018;B:无病进展生存率,P = 0.034)Figure 7 The effect of TPD52 expression on the survival of HCC patients with III tumor stage (A: Overall survival rate, P = 0.018;B: Disease-free survival rate, P = 0.034)
3 讨论
TPD52 基因位于染色体 8q21 位点,编码一个长约 200 氨基酸残基的小亲水多肽序列,包含一个大约 50 个氨基酸残基的典型 Coil-coil 基序结构,N 端和 C 端各有一个可能参与调节蛋白稳定性的 PEST 序列[9-10]。TPD52 基因除了有着 D52家族蛋白最重要的生理功能,即调节膜泡运输和胞外分泌,还与多种肿瘤的发生发展有着特殊关系。有研究发现,在小细胞肺癌[11-12]、卵巢癌[13]、乳腺癌[14]、前列腺癌[15]、胰腺癌[16]、多发性骨髓瘤[17]、伯基特淋巴瘤[18]以及黑色素瘤[19]中 TPD52 的表达是上调的,而在肾细胞癌、平滑肌肉瘤、脂肪肉瘤以及肺癌中的表达是下调的[20]。
本初步研究结果表明,在转录和翻译水平,TPD52 在肝癌组织中的表达下调,且 TNM 分期越高的组织中 TPD52 表达量越低,由此提示TPD52 具有抑癌基因的生物学特性,与肝癌的发生发展密切有关。相关临床参数分析表明,TPD52 的表达、肿瘤大小、肿瘤数目以及 TNM 分期和患者5年生存率有关。根据生存分析,TPD52 高表达的肝癌患者其总生存期及无病进展生存期更长。为了进一步证实肿瘤大小、肿瘤多发性和 TNM 分期对患者预后的影响是否与 TPD52 的表达有关,我们将 173 例病例分亚群作生存分析,发现肿瘤直径小于 5 cm、肿瘤单发或 TNM 分期 III 期的患者的 TPD52 高表达能明显延长总生存期及无病进展生存期。结果表明,TPD52 基因的表达,与肝癌患者的生存密切相关,提示 TPD52 基因可作为肝癌患者诊断和预后评估的指标。
目前,TPD52 的相关研究表明,TPD52 是通过激活蛋白激酶 B/Akt 通路来参与前列腺癌细胞的侵袭和迁移[21-22];在肝癌的研究中发现,TPD52 mRNA 的表达是下调的[20];TPD52 的高表达能提高子宫内膜瘤患者的总生存期和无病进展生存期[23],同时也是卵巢癌患者的一个良性预后指标[24],这与本研究结果一致。
综上所述,TPD52 在肝癌中的表达水平是下调的,且 TPD52 高表达的患者比低表达的患者有更长的总生存期和无病进展生存期,可作为原发性肝癌的独立预后因素。提示 TPD52 基因可作为肝癌患者诊断和预后评估的指标。但关于 TPD52 在肝癌发生发展过程中的分子作用机制,仍需更深入的研究去探索,这将为肝癌的靶向治疗和预后评估提供新的方法。
[1] Soliman H, Ringash J, Jiang H, et al. Phase II trial of palliative radiotherapy for hepatocellular carcinoma and liver metastases. J Clin Oncol, 2013, 31(31):3980-3986.
[2] Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma. Lancet, 2012,379(9822):1245-1255.
[3] Shehata M, Bieche I, Boutros R, et al. Nonredundant functions for tumor protein D52-like proteins support specific targeting of TPD52. Clin Cancer Res, 2008, 14(16):5050-5060.
[4] Roslan N, Bièche I, Bright RK, et al. TPD52 represents a survival factor in ERBB2-amplified breast cancer cells. Mol Carcinog, 2014,53(10):807-819.
[5] Chen Y, Kamili A, Hardy JR, et al. Tumor protein D52 represents a negative regulator of ATM protein levels. Cell Cycle, 2013, 12(18):3083-3097.
[6] Adamson B, Smogorzewska A, Sigoillot FD, et al. A genome-wide homologous recombination screen identifies the RNA-binding protein RBMX as a component of the DNA-damage response. Nat Cell Biol,2012, 14(3):318-328.
[7] Edge SB, Compton CC. The American Joint Committee on Cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surq Oncol, 2010, 17(6):1471-1474.
[8] Zhao JJ, Pan K, Li JJ, et al. Identification of LZAP as a new candidate tumor suppressor in hepatocellular carcinoma. PLoS One, 2011, 6(10):e26608.
[9] Boutros R, Fanayan S, Shehata M, et al. The tumor protein D52 family: many pieces, many puzzles. Biochem Biophys Res Commun,2004, 325(4):1115-1121.
[10] Byrne JA, Frost S, Chen Y, et al. Tumor protein D52 (TPD52) and cancer-oncogene understudy or understudied oncogene? Tumour Biol,2014, 35(8):7369-7382.
[11] Ziv T, Barnea E, Segal H, et al. Comparative proteomics of small cell lung carcinoma. Cancer Biomark, 2006, 2(6):219-234.
[12] Rohrbeck A, Judith N, Rosskopf M, et al. Gene expression profiling for molecular distinction and characterization of laser captured primary lung cancers. J Transl Med, 2008, 6:69.
[13] Byrne JA, Balleine RL, Schoenberg Fejzo M, et al. Tumor protein D52 (TPD52) is overexpressed and a gene amplification target in ovarian cancer. Int J Cancer, 2005, 117(6):1049-1054.
[14] Balleine RL, Fejzo MS, Sathasivam P, et al. The hD52 (TPD52) gene is a candidate target gene for events resulting in increased 8q21 copy number in human breast carcinoma. Genes Chromosomes Cance,2000, 29(1):48-57.
[15] Kim JH, Dhanasekaran SM, Mehra R, et al. Integrative analysis of genomic aberrations associated with prostate cancer progression. Cancer Res, 2007, 67(17):8229-8239.
[16] Loukopoulos P, Shibata T, Katoh H, et al. Genome-wide array-based comparative genomic hybridization analysis of pancreatic adenocarcinoma: identification of genetic indicators that predict patient outcome. Cancer Sci, 2007, 98(3):392-400.
[17] Largo C, Alvarez S, Saez B, et al. Identification of overexpressed genes in frequently gained/amplified chromosome regions in multiple myeloma. Haematologica, 2006, 91(2):184-191.
[18] Dave SS, Fu K, Wright GW, et al. Molecular diagnosis of Burkitt's lymphoma. N Engl J Med, 2006, 354(23):2431-2442.
[19] Roesch A, Becker B, Bentink S, et al. Ataxia telangiectasia-mutated gene is a possible biomarker for discrimination of infiltrative deeppenetrating nevi and metastatic vertical growth phase melanoma. Cancer Epidemiol Biomarkers Prev, 2007, 16(11):2486-2490.
[20] Tennstedt P, Bölch C, Strobel G, et al. Patterns of TPD52 overexpression in multiple human solid tumor types analyzed by quantitative PCR. Int J Oncol, 2014, 44(2):609-615.
[21] Goto Y, Nishikawa R, Kojima S, et al. Tumour-suppressive microRNA-224 inhibits cancer cell migration and invasion via targeting oncogenic TPD52 in prostate cancer. FEBS Lett, 2014,588(10):1973-1982.
[22] Ummanni R, Teller S, Junker H, et al. Altered expression of tumor protein D52 regulates apoptosis and migration of prostate cancer cells. FEBS J, 2008, 275(22):5703-5713.
[23] Tothill RW, Tinker AV, George J, et al. Novel molecular subtypes of serous and endometrioid ovarian cancer linked to clinical outcome. Clin Cancer Res, 2008, 14(16):5198-5208.
[24] Byrne JA, Maleki S, Hardy JR, et al. MAL2 and tumor protein D52(TPD52) are frequently overexpressed in ovarian carcinoma, but differentially associated with histological subtype and patient outcome. BMC Cancer, 2010, 10:497.
Methods Real-time quantitative PCR was performed in 33 paired clinical samples (tumor tissues and matched adjacent non-tumor liver tissues) from patients with HCC to determine their TPD52 mRNA levels. The TPD52 expression levels in 173 HCC surgical specimens were examined by immunohistochemistry.
Results TPD52 mRNA expression was significantly lower in the tumor tissues than that in the matched adjacent non-tumor liver tissues (P < 0.001). In the surgical specimens, TPD52 protein expression was lower in tumor tissue than that in the paraneoplastic tissue, and its protein expression shows significantly negative correlation with the TNM stage of the tumor (P = 0.023). The overall survival and disease-free survival rates were significantly better in patients with high TPD52 expression when compared with those having low TPD52 expression (P = 0.003 and P = 0.013, respectively). In subgroup analysis, higher TPD52 expression indicated significantly better overall survival and disease-free survival in patients with tumor < 5cm, single tumor or III TNM stage (P = 0.015,P = 0.025, P = 0.018 and P = 0.023, P = 0.047, P = 0.034, respectively).
Conclusion Lower TPD52 expression is highly correlated with the development and progression of HCC, and represents an independent prognostic factor for the survival of the patients. TPD52 could be a novel prognostic biomarker and molecular therapy target for HCC.
Analysis of the correlation between TPD52 expression and prognosis of patients with primary hepatocellular carcinoma
WANG Ying, CHEN Chang-long, HUANG Xu-qiong, XIA Jian-chuan, ZHANG Jian-hua
Objective To explore the gene of tumor protein D52 (TPD52) expression and its relationship with prognosis in patients with primary hepatocellular carcinoma (HCC).
Carcinoma, hepatocellular;Prognosis;Neoplasm proteins;TPD52
s: ZHANG Jian-hua, Email: zhangjh1962@hotmail.com; XIA Jian-chuan, Email: xiajch@sysucc.org.cn
10.3969/j.issn.1673-713X.2015.06.009
510310 广州,广东药学院公共卫生学院(王颖、黄绪琼);510080 广州,中山大学肿瘤防治中心华南肿瘤学国家重点实验室(陈昶泷、夏建川);510006 广州中医药大学公共卫生事业管理教研室(张建华)
张建华,Email:zhangjh1962@hot.mail;夏建川,Email:xiajch@sysucc.org.cn
2015-10-19
*同为第一作者
方法 荧光定量 RT-PCR 检测 33 对肝癌组织及其对应的癌旁组织中 TPD52 mRNA 表达水平;免疫组化检测 173 例肝癌石蜡标本中 TPD52 蛋白表达情况。
结果 肝癌组织中 TPD52 mRNA 表达水平较癌旁组织低(P < 0.001);肝癌组织 TPD52 蛋白表达水平低于癌旁组织,且其表达水平与 TNM 分期存在负相关(P = 0.023);TPD52 高表达的患者较低表达的患者预后好(P = 0.003,P = 0.013),且能明显延长肿瘤小于 5 cm、肿瘤单发或 TNM分期为 III 期的患者的总生存期(P = 0.015,P = 0.025,P = 0.018)和无病进展生存期(P = 0.023,P = 0.047,P = 0.034)。结论 TPD52 低表达与原发性肝癌的发生发展有高度相关性,是肝癌的独立预后因素。
www.cmbp.net.cn 中国医药生物技术, 2015, 10(6):507-513
Author Affiliations: College of Public Health, Guangdong Pharmaceutical University, Guangzhou 510310, China (WANG Ying,HUANG Xu-qiong); State Key Laboratory of Oncology in South China, Sun Yat-Sen University Cancer Center, Guangzhou 510080,China (CHEN Chang-long, XIA Jian-chuan); Department of Health Service Management, Guangzhou University of Chinese Medicine, Guangzhou 510006, China (ZHANG Jian-hua)
www.cmbp.net.cn Chin Med Biotechnol, 2015, 10(6):507-513
