土层置换对马铃薯叶片酶活性及晚疫病的影响
2015-11-26张丁苍真名白雪静王秋菊刘峰高中超焦峰翟瑞常
张丁 苍真名 白雪静 王秋菊 刘峰 高中超 焦峰 翟瑞常
摘要:研究了土层置换及土壤灭菌措施对马铃薯叶片酶活性的影响。结果表明,土层置换或土壤灭菌处理提高了马铃薯叶片中保护酶(超氧化物歧化酶、过氧化物酶和过氧化氢酶)的活性,降低了叶片中纤维素酶和蛋白酶的活性,提高了马铃薯对晚疫病的抵抗能力。土层置换和土壤灭菌处理可以消除马铃薯由于连作障碍而产生的晚疫病的发病率,其中增施磷肥15%且置换土壤(T2)与施杀菌灵且不置换土壤(H)处理在消除马铃薯由于连作而产生的晚疫病方面效果最佳。而土壤经过土壤置换并加有机肥处理后(T3处理),马铃薯的晚疫病的病情指数在整个马铃薯的生长期内都显著高于其他4个处理,在77 d时分别比CK、T1(置换土壤)、T2和H 4个处理高出17.5%、47.1%、60.8%和66.6%,表明在土壤置换后使用有机肥不利于降低马铃薯的晚疫病。
关键词:马铃薯(Solarium tuberosum L.);土层置换;酶活性;晚疫病
中图分类号:S432.4+4 文献标识码:A 文章编号:0439-8114(2015)21-5281-04
DOI:10.14088/j.cnki.issn0439-8114.2015.21.019
Effects of Soil Replacement of Potato Leaf Enzyme Activity and Late Blight Disease Index
ZHANG Ding1,CANG Zhen-ming1,BAI Xue-jing1,WANG Qiu-ju2,LIU Feng2,
GAO Zhong-chao2,JIAO Feng1,ZHAI Rui-chang1
(1.Heilongjiang Bayi Agricultural University,Daqing 163319,Heilongjiang,China;2. Heilongjiang Agricultural Sciences,Harbin 150086,China)
Abstract: The analysis of the effects of soil displacement and soil sterilization measures on enzyme activity in leaves of potato, and provide the technical support of sciencefor the elimination of potato continuous cropping obstacle was reaseached. The results showed that soil replacement or soil sterilization treatment increased the activity of protective enzyme in potato leaves (superoxide dismutase, peroxidase and catalase), and reduced the activity of cellulase and protease, which improved the resistance of potato to late blight. Soil replacement and soil sterilization treatment eliminates the potato late blight caused by continuous cropping obstacles incidence,and Phasphate 15% and the replacement of soil(T2) and Application of soil fungicide antiseptic spirit and no replacement of soil(H) treatment in eliminating due to continuous cropping potato late blightbest effect. But the soil through?soil replacement and add organic fertilizer after treatment (T3 treatment), the disease index of potato late blight of potato during the growing period of the whole inner were significantly higher than the other four treatments,and the replacement of soil(T1),T2 and H treatment was 17.5%,47.1%,60.8% and 66.6% higher than the CK in 77 days respectively,which showed that the use of organic manure was not conducive to the reduction of potato late blight in soil after replacement.
Key words: potato(Solarium tuberosum L); soil displacement; enzyme activity; late blight
马铃薯(Solarium tuberosum L.)又名土豆、地豆、地蛋、番薯、洋芋及荷兰薯,起源于南美秘鲁和智利的安第斯山一带[1],是茄科(Solanaceae)茄属(Solarium)一年生的草本植物,被联合国誉为“未来的粮食”[2],随着种植面积的不断增加,已经跃居成为全球第四大粮食作物,产量仅次于小麦、水稻和玉米[3],在保证全球粮食安全方面发挥着至关重要的作用。在中国,马铃薯的主要种植地区包括东北、华北、西北和西南四大产区。其鲜薯产量和种植面积占全球的25%,居世界第一位[4-7]。近年来,马铃薯的种植和加工产业带来了稳步提升的经济效益,保障了国家的粮食安全生产,增加了农民的收入[8-11]。马铃薯具有适应性广、产量高、营养物质种类丰富、经济效益好等特点[12-15],属于忌连作的作物,对连作十分敏感。马铃薯作为重要的蔬菜和粮食兼用作物,其连作越来越广泛,长期的连作会造成马铃薯种植过程中的连作障碍,导致作物生长发育不良,品质及产量下降,抗病能力降低。同时使得种植地土壤生态平衡遭到破坏,土壤养分失调,有害菌群增加,马铃薯长势减弱,产量和品质持续下降。马铃薯的连作障碍问题日益突出,制约着马铃薯种植业的健康、持续发展[10,16]。
多年来,关于设施作物连作障碍的现象、发生的机理及缓解措施研究报道较多,对于马铃薯连作障碍的研究主要集中在连作障碍的表现和发生机理等方面[17,18-23],但是对于克服或减少大面积的马铃薯连作障碍并没有提出合理的措施,主要的抗连作措施不适于大面积的马铃薯种植且比较费时,花费较大[24,25]。而土层置换技术在降低大面积连作障碍方面已经有突出的效果。
由于叶片中的酶参与马铃薯生长过程中各种生物化学反应过程,与土壤供应养分能力密切相关,因此本试验研究通过分析土层置换改良土壤后对马铃薯晚疫病病情指数及叶片中不同酶活性的影响,从而为克服大面积马铃薯连作障碍提供科学的技术支撑。
1 材料与方法
1.1 供试材料
试验地位于黑龙江八一农垦大学农学院教学科研基地内,属松辽盆地中央坳陷区北部、松嫩平原西部,中温带大陆性季风气候区。年平均降雨440 mm。年均蒸发量1 597 mm,年均气温3.4 ℃,无霜期130 d,≥10 ℃的积温2 842 ℃,土壤类型为石灰性黑钙土。
供试马铃薯品种为尤金,株型直立,株高60 cm左右,叶深绿色,薯块椭圆形,黄皮黄肉,芽眼平浅,两端丰满,为感病品种,生育期65~70 d,属粮菜和淀粉加工兼用型品种。
1.2 试验设计
小区试验设5个处理,分别为不置换土壤(CK)、置换土壤(T1)、增施磷肥15%且置换土壤(T2)、增施有机肥且置换土壤(T3)、施杀菌灵且不置换土壤(H)。置换土层是施肥之后将表层0~20 cm土层与20~40 cm土层进行位置互换,总作业深度40 cm。田间试验采用随机区组设计,小区内第4年马铃薯连作,4次重复。除T2处理外氮磷钾肥料均采用当地常规用量,分别为N 90 kg/hm2、P2O5 90 kg/hm2、K2O 45 kg/hm2,T2处理增加P2O5施用量15%,即为P2O5 103.5 kg/hm2。肥料类型为尿素(46%)、磷酸二铵(N18%、P2O546%)和硫酸钾(50%)。T2处理增施的磷肥为过磷酸钙(P2O518%),T3处理增施的有机肥为市售有机肥料(玉林丰田生态有机肥厂生产,总有机质≥34%),施用量为120 kg/hm2。所有肥料做基肥一次施入,施肥深度15 cm。
试验地6月5日播种,每小区5行、行长5 m,株距0.25 m、行距0.66 m,小区面积16.50 m2,每行20株、共计100株,田间管理同大田。分别于马铃薯播种后35、49、63、77、91 d,即7月10日、7月24日、8月7日、8月21日取植株和土壤样品,9月6日收获马铃薯。
1.3 马铃薯叶片中酶活性的测定
水解酶类:蛋白酶测定采用茚三酮比色法;纤维素酶和果聚糖蔗糖酶测定均采用3,5—二硝基水杨酸法。
氧化酶类:过氧化氢酶的测定采用高锰酸钾滴定法;过氧化物酶测定用1%邻苯三酚溶液比色法;超氧化物歧化酶(SOD)测定用氮蓝四唑(NBT)光还原法。
2 结果与分析
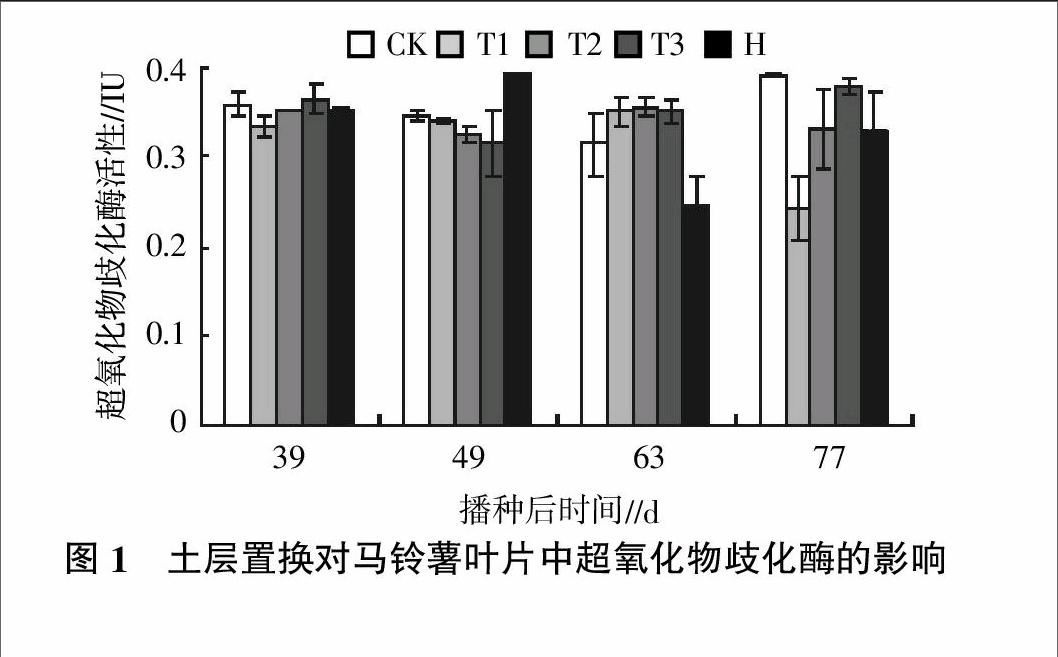
2.1 土层置换对马铃薯叶片中超氧化物歧化酶的影响
图1为不同处理下,马铃薯叶片中超氧化物歧化酶随着生长期延长的变化情况。在播种后39 d时,各处理间酶活性差异不显著。随着生长期的延长,与CK相比,T1、T2和T3处理的超氧化物歧化酶活性有了进一步的提高。在种植63 d时,T1、T2和T3处理的超氧化物歧化酶活性分别比CK处理高11.8%、13.3%和11.8%。表明在马铃薯生长的早期阶段,土层置换技术可以提高马铃薯叶片中的超氧化物歧化酶的活性。在马铃薯生长期的后期,与CK相比,各处理的超氧化物歧化酶活性有所下降,但是T2和T3处理的超氧化物歧化酶活性在马铃薯整个生长期能够维持在较为稳定的水平之内。
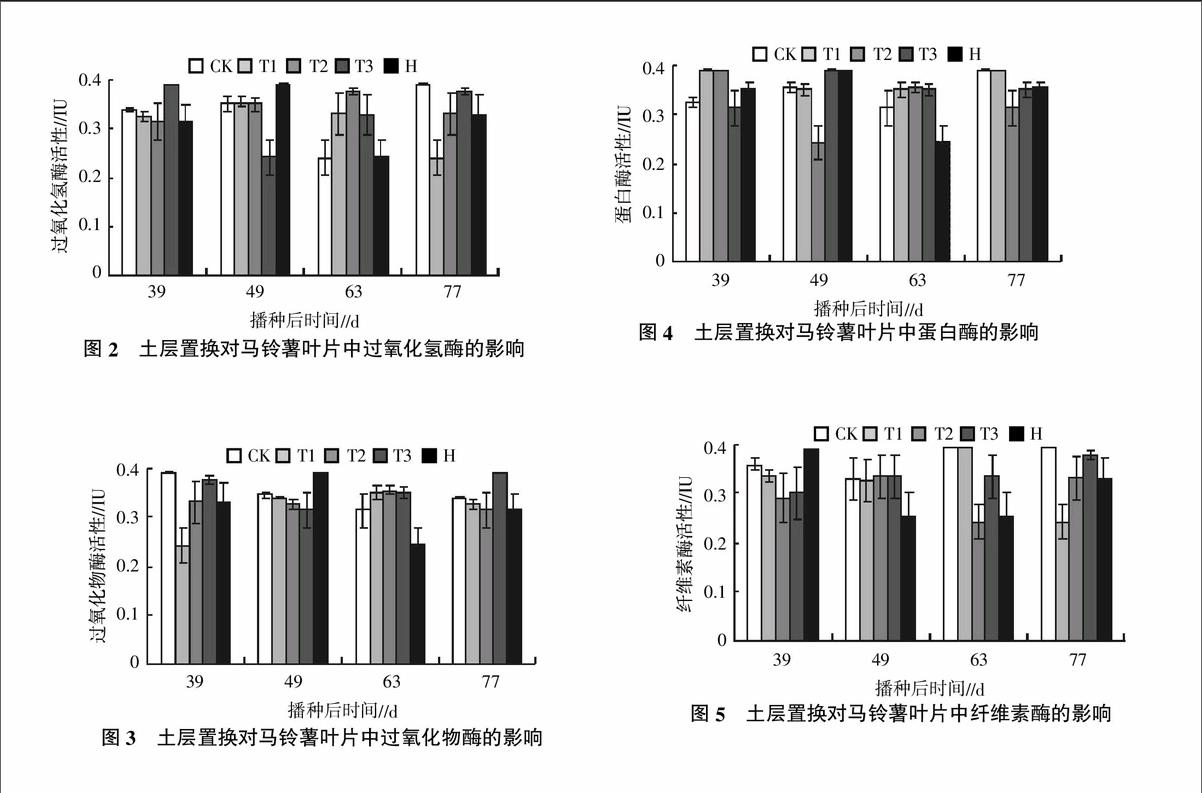
2.2 土层置换对马铃薯叶片中过氧化氢酶活性的影响
不同处理对马铃薯叶片中过氧化氢酶活性的影响见图2。由图2可知,随着生长期的延长,不同处理间过氧化氢酶活性在整个生长时期内的变化规律不明显。但是整体趋势与超氧化物歧化酶活性的变化类似,T1和T2处理的酶活性水平较其他几个处理稳定。在马铃薯的种植初期,除了在49 d时,T3处理的过氧化氢酶活性显著低于CK处理外,T1、T2和H处理的过氧化氢酶活性与CK处理相当。尤其是在马铃薯种植63 d时,T1、T2和T3处理的过氧化氢酶活性提高最为明显,分别比CK处理提高了36.7%、56.0%和36.4%。
2.3 土层置换对马铃薯叶片中过氧化物酶活性的影响
图3为不同处理下马铃薯叶片中过氧化物酶活性随着生长期延长的变化情况。在马铃薯播种后39 d时,CK处理的过氧化物酶活性最高。随着马铃薯生长期的延长,T1、T2、T3和H处理的过氧化物酶活性均出现了不同程度的增长。在播种后49 d时,T1、T2和T3处理的过氧化物酶活性与CK处理相当,且H处理高于CK处理。在播种后63 d时,T1、T2和T3处理的过氧化物酶活性均高于CK处理。在马铃薯生长的最后阶段,T3处理的过氧化物酶活性最高。试验结果表明,土层置换并施用部分有机肥之后对改善马铃薯叶片中的过氧化物酶活性效果最好。
2.4 土层置换对马铃薯叶片中蛋白酶活性的影响
不同处理马铃薯叶片中蛋白酶活性的变化如图4所示。由图4可知,各个处理在整个生长期内蛋白酶活性的变化较大。但在马铃薯播种后77 d时,T1、T2、T3和H处理的蛋白酶活性与CK相比均有所下降,分别下降了0.4%、20.0%、10.6%和9.4%。表明T2、T3和H处理对马铃薯生长后期叶片中蛋白酶活性影响更显著,其影响由大到小依次为T2、T3、H。
2.5 土层置换对马铃薯叶片中纤维素酶活性的影响
不同处理下马铃薯叶片中纤维素酶活性的变化如图5所示。由图5可知,T1、T2、T3和H处理马铃薯叶片中的纤维素酶活性均不同程度的降低。在马铃薯播种后63 d,T2、T3和H处理马铃薯叶片中纤维素酶活性分别比CK处理降低了38.5%、15.2%和35.5%。在播种后77 d,T1、T2、T3和H处理的马铃薯叶片中纤维素酶活性分别下降了38.5%、15.9%、4.1%和16.1%。试验结果表明,土层置换和土壤灭菌等处理技术可以在一定程度上降低马铃薯叶片中纤维素酶的活性。
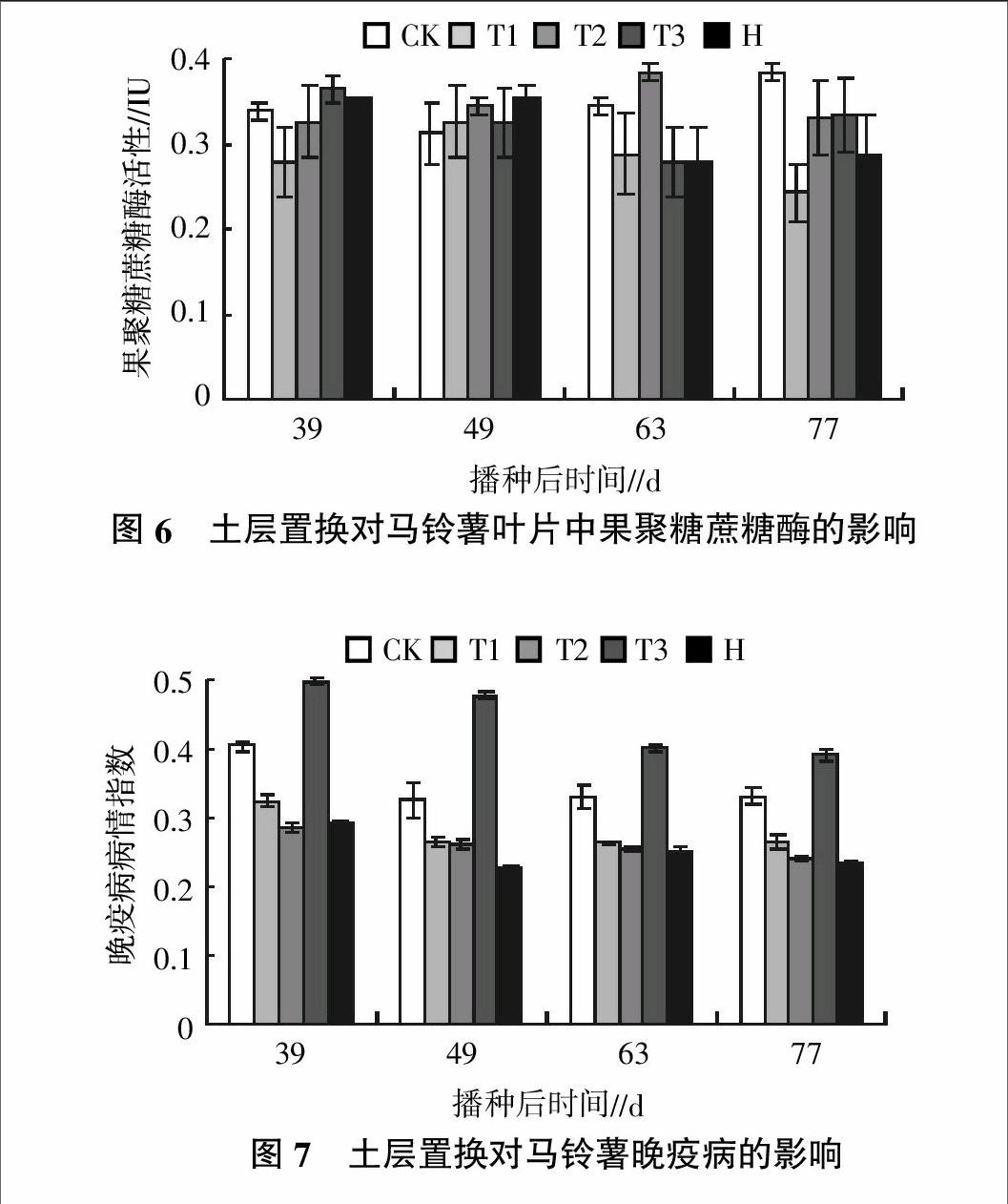
2.6 土层置换对马铃薯叶片中果聚糖蔗糖酶活性的影响
不同处理下马铃薯叶片中果聚糖蔗糖酶活性的变化如图6所示。由图6可知,在马铃薯播种后的初期39 d和49 d,除T1处理在播种后39 d果聚糖蔗糖酶活性明显低于CK处理外,T2、T3和H处理的果聚糖蔗糖酶均等于或略大于CK处理。而在马铃薯生长的后期,除了T2在播种后63 d马铃薯叶片中的果聚糖蔗糖酶活性高于CK处理外,其他处理均低于CK处理。播种后77 d,T1、T2、T3和H处理马铃薯叶片中果聚糖蔗糖酶活性比CK处理分别下降了36.8%、13.6%、12.9%和25.1%。结果表明,土层置换和灭菌技术最终降低了马铃薯叶片中果聚糖蔗糖酶的活性。
2.7 土层置换对马铃薯晚疫病的影响
不同处理下对马铃薯晚疫病的影响如图7所示。由图7可知,与CK相比,T1、T2和H处理马铃薯晚疫病的病情指数均下降,其中播种后77 d,T1、T2和H处理的晚疫病病情指数分别下降了25.2%、36.8%和41.8%,表明土层置换和土壤灭菌处理可以减轻马铃薯晚疫病的发生,其中以T2和H处理效果最佳。而T3处理马铃薯晚疫病的病情指数在整个马铃薯生长期都显著高于其他4个处理,播种后77 d分别比CK、T1、T2和H处理高17.5%、47.1%、60.8%和66.6%,表明在土壤置换后不宜施用有机肥。
3 结论与讨论
本试验结果表明,土层置换或土壤灭菌处理后,马铃薯叶片中的相关保护酶(超氧化物歧化酶、过氧化氢酶和过氧化物酶)活性出现了不同程度的提高,并且纤维素酶和蛋白酶活性出现了下降。超氧化物歧化酶、过氧化物酶、过氧化氢酶是植物体内重要的防御性酶,参与体内活性氧的清除及酚类、木质素和植保素等与抗病相关物质的合成,能抵御体内活性氧及氧自由基对细胞膜系统的伤害,延长叶片的功能期,增强植物对病害的抵抗能力[26]。植物细胞壁的主要构架物质是纤维素和果胶质等,可分别被纤维素酶和果胶酶分解,导致抗性降低[27,28]。本试验结果还表明,土层置换或土壤灭菌可以提高马铃薯对晚疫病的抵抗能力,T2和H处理的效果最佳。T3处理马铃薯晚疫病的病情指数在整个马铃薯生长期都显著高于其他4个处理,在播种后77 d分别比CK、T1、T2和H处理高17.5%、47.1%、60.8%和66.6%,表明在土壤置换后施用有机肥不利于降低马铃薯晚疫病。
参考文献:
[1] 金黎平,屈冬玉,谢开云,等.我国马铃薯种质资源和育种技术研究进展[J].种子,2003(5):98-100.
[2] 吴承金,程 群,李大春,等.CIP马铃薯资源的引进与初步评价[A].马铃薯产业与粮食安全[C].北京:中国作物学会,2009. 247-252.
[3] 宋国安.马铃薯的营养价值及开发利用前景[J].河北工业科技,2004,21(4):55-58.
[4] 屈冬玉,谢开云,金黎平,等.中国马铃薯产业与现代农业[J].农业技术与装备,2007(7):4-7.
[5] HERMANSEN A,LU D,FORBES G,et al. Potato production in China and Norway: Similarities, differences and future challenges[J].Potato Research,2012,55(3):197-203.
[6] JANSKY S H,JIN L P,XIE K Y,et al. Potato production and breeding in China[J].Potato Research,2009,52(1):57-65.
[7] WANG Q B,ZHANG W. Chinas potato industry and potential impacts on the global market[J]. American Journal of Potato Research,2004,81(2):101-109.
[8] 柳 俊.我国马铃薯产业技术研究现状及展望[J].中国农业科技导报,2011,13(6):13-8.
[9] 孟品品,刘 星,邱慧珍,等.连作马铃薯根际土壤真菌种群结构及其生物效应[J].应用生态学报,2012,23(11):3079-3086.
[10] 卢建武,邱慧珍,张文明,等.半干旱雨养农业区马铃薯干物质和钾素积累与分配特性[J].应用生态学报,2013,24(2):423-430.
[11] WANG X C,LI J,TAO S S,et al. Using EPIC model to determine a sustainable potato/cereal cropping system in the Arid Region of the Loess Plateau of China[J]. Computer and Computing Technologies in Agriculture VI,2013,393,60-68.
[12] 树 安.作物栽培学各论(北方本)[M].北京:中国农业出版社,1995.
[13] 田晓薇,屈冬玉.马铃薯优良品种及丰产栽培技术[M].北京:中国劳动社会保障出版社,2002.
[14] 连 勇.马铃薯脫毒种薯生产技术[M].北京:中国农业科学技术出版社,2001.
[15] 裴国平,王 蒂,张俊莲,等.连作马铃薯对抗性酶及生物学特性变化的研究[J].湖南农业科学,2010(11):34-37.
[16] 张福锁, 申建波,冯 固.根际生态学—过程与调控[M].北京:中国农业大学出版社,2009.
[17] 马 琨,张 丽,杜 茜,等.马铃薯连作栽培对土壤微生物群落的影响[J].水土保持学报,2010(4):229-233.
[18] 柳永强,马廷蕊,杨 谋,等.马铃薯浸提液对其SAGs积累、酚类代谢及自毒效应研究[J].农业科学与科技,2011,12(5):647-650.
[19] 谢奎忠,陆立银,罗爱花,等.不同栽培措施对连作马铃薯土壤真菌、真菌性病害和产量的影响[J].中国蔬菜,2013(2):70-75.
[20] 牛秀群,李金花,张俊莲,等.甘肃省干旱灌区连作马铃薯根际土壤中镰刀菌的变化[J].草业学报,2011,20(4):236-243.
[21] 杜 茜,卢 迪,马 琨.马铃薯连作对土壤微生物群落结构和功能的影响[J].生态环境学报,2012,21(7):1252-1256.
[22] 孙 权,陈 茹,宋乃平,等.宁南黄土丘陵区马铃薯连作土壤养分、酶活性和微生物区系的演变[J].水土保持学报,2010(6):208-212.
[23] 蔺琰东,秦舒浩,王 丽,等.外源邻苯二甲酸二甲酯和苯甲酸对马铃薯组培苗生长的化感效应[J].广东农业科学,2011, 38(9):17-20.
[24] 杨桂丽,童 娟,张 丽,等.熏蒸灭菌对连作马铃薯生长发育及土壤微生物的影响[J].农业科学研究,2012,33(1):36-40.
[25] 彭绍峰,赵爱菊,张春强,等.应用抗重茬药剂克服马铃薯连作障碍试验初报[J].农业科技通讯,2010(1):44-45.
[26] 康小晓,刘孟君,张 艳,等.外源激素对脱毒马铃薯扦插苗生长及生理效应研究[J].西北植物学报,2012,32(7):1412-1419.
[27] 黄华康.马铃薯脱毒对一些生理指标的影响[J].中国马铃薯,2002,16(3):137-140.
[28] 张树生,胡 蕾,刘忠良,等.植物体内抗病相关酶与植物抗病性的关系[J].安徽农学通报,2006,12(13):48-49.
