T—2毒素的毒性及其作用机制与代谢研究进展
2015-11-26李丽霞尚书凤
李丽霞++尚书凤
摘要:T-2毒素是A类单端孢霉烯族真菌毒素。T-2毒素自然发生,严重污染粮食作物及其加工产品,造成巨大的经济损失。T-2毒素污染饲料,威胁畜禽健康,严重影响畜禽养殖业。T-2毒素及其在动物体内的代谢产物在可食组织器官残留,通过食物链传递到人类,威胁到人类的健康。因此,T-2毒素受到广泛关注。综述了有关T-2毒素的毒性及其毒理机制与代谢等的研究进展。
关键词:T-2毒素;毒性;作用机制;代谢
中图分类号:Q935 文献标识码:A 文章编号:0439-8114(2015)21-5207-04
DOI:10.14088/j.cnki.issn0439-8114.2015.21.002
单端孢霉烯族毒素是一大类结构相关的真菌毒素,主要是由镰刀菌属(Fusarium genus)产生的,如拟枝孢镰刀菌(Fusarium sporotrichioides)、三线镰刀菌(Fusarium tricinctum)和木贼镰刀菌(Fusarium equiseti)[1]。根据单端孢霉烯族毒素的功能团,将其分为A、B、C、D 4类。T-2毒素属于A类单端孢霉烯族毒素,是单端孢霉烯族毒素中毒性最强的毒素之一。T-2毒素损害肝、皮肤、消化系统、免疫系统、神经系统等,能够使农场动物亚中毒甚至致死。由于T-2毒素的毒性及其稳定性,T-2毒素被用作生化武器[2]。T-2毒素抑制蛋白质合成,从而抑制DNA、RNA合成。T-2毒素诱导哺乳动物细胞凋亡。T-2在体内通过异戊基侧链3′碳的羟化、酰基水解、环氧键打开的脱环氧产生20多种产物。最典型的代谢产物是HT-2、T-2 triol、T-2 tetraol、Neosolaniol、3′OH-T-2、3′-OH-HT-2、3′-OH-T-2 triol、Dihydroxy HT-2、 Deepoxy-3′-OH-HT-2、 Deepoxy-3′-OH-T-2。参与T-2毒素羟化作用的酶主要有细胞色素P450 1A5、3A4、3A22、3A29、3A37、3A46,参与酯键水解的酶有羧酸酯酶[3,4], T-2毒素环氧键打开的脱环氧反应是由肠道微生物催化的[5]。Fuchs等[6]报道了一种细菌BBSH 797可以将T-2 三醇环氧键打开生成T-2 四醇。
1 T-2毒素的发现及理化性质
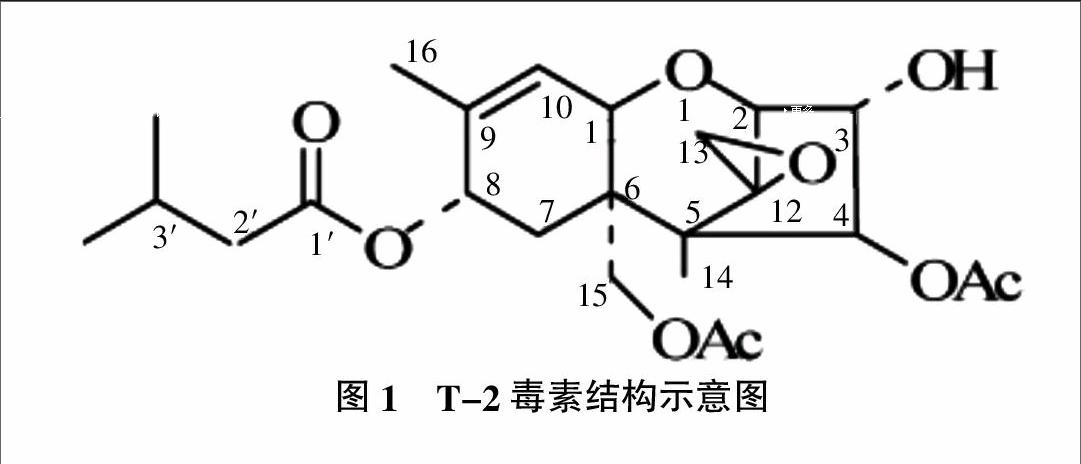
20世纪中期,在美国用发霉的玉米喂养动物,一些动物表现出中毒症状。在威斯康星州,从发霉的有毒玉米中分离到许多真菌,三线镰刀菌是发霉玉米中最常见真菌之一,其提取物毒性是最大的。1968年Bamburg等[7]利用Gregory培养基培养三线镰刀菌菌株T-2,从乙酸乙酯提取物中获得毒素并结晶,将其命名为T-2毒素,首次确定了T-2毒素的分子式为C24H3O9,化学名为4β-15-二乙酰氧基-3α-羟基-8α-(3-甲基丁酰氧)-12,13-环氧单端孢霉-9-烯,四环的倍半萜烯,C-9与C-10之间形成一个双键,C-12与C-13之间形成环氧键(图1)。环氧键是T-2毒素毒性和生物活性的重要活性基团[8]。此外,R2、R3和R5也是T-2毒素重要的活性基团,Chanh等[9]利用T-2毒素单克隆抗体HDⅡ研究其结构与功能的关系,发现这些功能基团是毒素结合到靶细胞所必需的。
2 T-2毒素的毒性
在体内,T-2毒素主要毒害的组织是肝,致使肝脏生物膜形态和功能改变。T-2毒素抑制蛋白质合成,减弱代谢药物所必需的酶活性,诱发脂质过氧化,产生类似于自由基所致的溶血。T-2毒素对皮肤损害的典型特征是皮炎,一些动物暴露于T-2毒素,诱发腿部色素沉淀、胳膊黄萎病,还诱发皮下水肿、出血和皮肤坏死[10]。2012年Agrawal等[11]研究T-2毒素对小鼠的皮肤损伤,T-2毒素应用于局部导致氧化应激,活性氧、脂质过氧化、髓过氧化物酶活性增加,导致皮肤炎症因子(TNF-α、IL-6、IL-1β)的mRNA显著增加,抗炎症因子IL-10表达也显著上调。免疫印迹分析显示磷酸化p38丝裂原活化蛋白激酶(MAPK)水平显著增加。所以推测T-2毒素诱导的皮肤炎与以下因素相关:氧化应激、髓过氧化物酶的激活、炎症性细胞因子活性增加、p38 MAPK的激活和表皮细胞凋亡导致的皮肤退行性病理变化等[11]。
对免疫系统的损害是T-2毒素对动物和人所造成的主要毒害之一。用亚临床剂量的T-2毒素喂养猪29 d,用卵清蛋白免疫猪,检测激素和细胞免疫应答,猪产生的抗体大大减少[12],验证了T-2毒素对免疫系统的毒性,尤其是对激素免疫应答的毒性。动物体暴露于T-2毒素,致使白细胞减少和淋巴器官细胞坏死,抑制骨髓和脾脏促细胞生成,减少淋巴细胞增殖。无论是体液免疫还是细胞免疫,无论是T-依赖免疫应答还是T-非依赖免疫应答,都受T-2毒素影响[10]。T-2毒素几乎对整个消化系统的所有细胞都有毒性。T-2毒素导致的坏死性病变,其典型特征是消化道出现黄白色干酪样的坏死性隆起,出现在口腔、肠黏膜、肫和肝等[13]。T-2毒素的刺激增加胃肠推进率,从而影响到胃肠消化运输和营养物质的吸收,T-2毒素导致胃肠功能紊乱,部分原因是由于T-2毒素改变肠系膜血流量,T-2毒素急性作用导致胃肠上皮细胞出血及坏死[14]。T-2毒素致使大鼠大脑单胺类神经递质水平发生改变、运动能力下降、小鼠脑组织氧化损伤。T-2毒素对血脑屏障具有强的细胞毒性,干扰血脑屏障功能[15]。
3 T-2毒素细胞毒性的分子机制
T-2毒素对60 S核糖体亚基亲和力很强,与肽基转移酶高亲和力,抑制肽基转移酶活性,从而抑制蛋白质合成的起始阶段。T-2毒素抑制DNA、RNA合成,T-2毒素诱导淋巴细胞单链DNA断裂[16,17]。Chaudhari等[18]报道T-2毒素引起活性氧生成和氧化应激发生,紧接着观察到P53蛋白表达量上调,也发现Bax/Bcl2比率增加,更利于细胞凋亡的发生。线粒体细胞凋亡因子Bax、Bcl-2、Cytochrome-c水平增加后,激活Caspases-9,-3,-7,导致细胞凋亡。关于T-2毒素诱导神经细胞凋亡的报道较少,Agrawal等[19] 报道T-2毒素诱导神经细胞胞外信号调节激酶(ERK)、c-Jun氨基末端激酶(JNK)和p38-丝裂原活化蛋白激酶(MAPKs)磷酸化,ERK途径上游的Grb2、Ras和Raf以及下游的转录因子c-fos和c-jun表达均显著上调。所以,T-2毒素通过多种途径诱导神经细胞凋亡。endprint
4 T-2毒素的代谢
T-2毒素在体内半衰期很短,在啮齿动物、鸡、牛、猪体内,T-2毒素被吸收后很快被代谢为多种产物。T-2毒素发现以来的几十年,科学家鉴定了许多种T-2毒素的代谢产物。Ⅰ相代谢产物可以分为3类:异戊基侧链3碳的羟化产物、酰基水解产物、环氧键打开的脱环氧产物。进入体内的T-2毒素及其Ⅰ相代谢产物很快与葡萄糖醛酸结合生成糖苷类化合物。在不同生物体,T-2毒素代谢产物有所不同。已经研究了多种动物体内(鼠、鸡、牛、猪)T-2毒素的代谢、组织分布、排泄。下面主要探讨T-2毒素在禽类代表动物鸡、畜类代表动物猪、啮齿类动物代表鼠体内体外代谢。
除了肠道和肝这两个主要代谢T-2毒素的场所以外,皮肤、血液和胃也在T-2毒素代谢过程中起到重要作用。用溶于DMSO的T-2毒素经注射渗透到皮肤,发现T-2毒素经皮肤渗透在生物体广泛存在,兔与人皮肤渗透性最相似,猴皮肤渗透性比人快2~3倍,HT-2是其主要代谢产物,也检测到T-2 triol和T-2 tetraol[20]。血细胞也能代谢T-2毒素,人和鼠血细胞经两个不同途径代谢T-2毒素分别生成HT-2和Neosolaniol,鼠红细胞代谢T-2毒素生成Neosolaniol作为主要代谢产物,而白细胞则生成HT-2;人红细胞代谢T-2毒素生成Neosolaniol和HT-2,而白细胞则仅仅产生HT-2。用特异抑制剂研究发现白细胞和红细胞中负责T-2毒素水解的酶是羧酸酯酶,血液代谢T-2毒素生成Neosolaniol的途径不同于肝代谢[21]。胃肠道在T-2毒素解毒过程中起到重要作用,鼠和牛胃肠代谢T-2毒素的研究为肝外组织代谢提供大量信息,牛瘤胃微生物在厌氧条件下与T-2毒素孵育,代谢生成HT-2和T-2 triol两种水解产物以及Deepoxy HT-2、Deepoxy T-2 triol、 Deepoxy T-2 tetraol 3种脱环氧产物[22,23]。研究发现鼠胃在不同pH条件下生成的产物有所不同,pH 2.2,孵育60 min后,HT-2是惟一代谢产物;pH 7.5,孵育3 h后,检测到HT-2 (18%)、Neosolaniol(4.4%)、4-deacetylneosolaniol(3.5%)。所以推测在不同组织代谢途径可能不同,因为不同亚型酶的底物特异性受孵育体系pH影响[24]。
T-2毒素在鸡体内的代谢。绝大多数代谢产物残留于排泄物,在鸡肝中也探测到大量T-2毒素代谢产物,肺中仅少量,在其他组织心和肾没有检测到T-2代谢产物。3′-OH-HT-2是组织和排泄物的主要代谢物,也探测到其他代谢物:HT-2、T-2 tetraol、15 acetoxy T-2 tetraol、3′-OH- T-2、4-acetoxy T-2 tetraol,以及微量的8-acetoxy T-2 tetraol、T-2 triol、 3-acetoxy-3'-OH-HT-2[25]。鸡体外,一般以肝微粒体做研究材料,苯巴比妥(Phenobarbital)诱导的鸡肝微粒体与T-2毒素孵育,HT-2是主要代谢产物,3′-OH-T-2是的主要氧化产物[26]。可能是由于体积庞大的异戊基侧链不容易去除,鸡肠道微生物与T-2孵育,仅检测C4位单个脱酰基产物HT-2和T2T及其脱环氧产物HT2-dE和T2T-dE[5]。已报道鸡的CYP1A5和CYP3A37羟化T-2生成3′-OH- T-2,是鸡代谢T-2毒素的关键酶[27,28]。
T-2毒素在猪体内的代谢。猪体内,0.1 mg氚标记T-2/kg体重的剂量给药后18 h,探测到标记物在体内的分布如下:0.7%(肌肉)、 0.43%(肝)、 0.08%(肾)、 0.06%(胆汁)、 21.6%(尿)、25.0% (大便),猪体内的代谢物分布情况与鸡体内的相似,绝大多数代谢产物残留于排泄物,所不同的是肾中检测到标记物[29]。在组织和胃肠道中,共检测到21种代谢产物,HT-2、T-2 triol、T-2 tetraol、 3′-OH T-2、3′-OH HT-2、Deepoxy T-2 tetraol、Deepoxy HT-2、Deepoxy T-2 triol等达到55%。其中HT-2、3′-hydroxy-T-2、 3′-hydroxy-HT-2 是主要代谢产物[30]。葡萄糖醛酸化在T-2毒素代谢过程中起到很重要的作用,胆汁和尿中,葡萄糖醛酸化的T-2毒素及其代谢产物量分别达到77%和63%,主要包括HT-2、3′-OH T-2、3′-OH-HT-2和T-2的葡萄糖醛酸化产物[31]。已报道CYP3A22、CYP3A29、CYP3A46是猪体内羟化T-2毒素的关键酶[32,33]。
T-2毒素在鼠体内外的代谢。用氚标记的T-2毒素灌流鼠肝,除了检测到3′-hydroxy-HT-2、3′-hydroxy-T-2 triol、4-deacetylneosolaniol、T-2 tetraol,还检测到HT-2、3′-hydroxy-HT-2、 T-2 tetraol的葡萄糖醛酸化产物。给鼠口服3′-Hydroxy HT-2 toxin和 T-2 tetraol,检测到了3′-hydroxy-deepoxy HT-2、3′-hydroxy-deepoxy T-2 triol、15-acetyl-deepoxy T-2 tetraol、Deepoxy T-2 tetraol,由此表明环氧键打开也在鼠体内代谢起重要作用[34]。用空肠原位灌流的方法研究T-2毒素在鼠肠道代谢,主要代谢产物是HT-2,也检测到3′-hydroxy-HT-2、3′-hydroxy-T-2、T-2 tetraol、 4-deacetylneosolaniol,没有检测到葡萄糖醛酸化产物,表明葡萄糖醛酸化不是发生在肠道,而是在鼠肝[35]。在体外,用大鼠、小鼠的肝微粒体来研究T-2毒素的代谢,不管来自苯巴比妥诱导还是不诱导的肝微粒体,HT-2是其主要代谢物,苯巴比妥诱导处理的大鼠和小鼠肝微粒体孵育T-2毒素,向孵育体系补充NADPH生成体系,也检测到3′-OH-T-2和3′-OH-HT-2,不过3′-OH-HT-2是小鼠肝微粒体的主要氧化产物,3′-OH-T-2是大鼠肝微粒体的主要氧化产物[36]。endprint
参考文献:
[1] KONIGS M, MULAC D, SCHWERDT G, et al. Metabolism and cytotoxic effects of T-2 toxin and its metabolites on human cells in primary culture[J]. Toxicology, 2009, 258(2-3):106-115.
[2] KUCA K, POHANKA M. Chemical warfare agents[J]. EXS, 2010, 100: 543-558.
[3] JOHNSEN H, ODDEN E, LIE O, et al. Metabolism of T-2 toxin by rat liver carboxylesterase[J]. Biochem Pharmacol, 1986, 35(9): 1469-1473.
[4] WU Q H, WANG X, YANG W, et al. Oxidative stress-mediated cytotoxicity and metabolism of T-2 toxin and deoxynivalenol in animals and humans: An update[J]. Arch Toxicol, 2014, 88(7): 1309-1326.
[5] YOUNG J C, ZHOU T, YU H, et al. Degradation of trichothecene mycotoxins by chicken intestinal microbes[J]. Food Chem Toxicol, 2007, 45(1): 136-143.
[6] FUCHS E, BINDER E M, HEIDLER D, et al. Structural characterization of metabolites after the microbial degradation of type A trichothecenes by the bacterial strain BBSH 797[J]. Food Addit Contam, 2002, 19(4): 379-386.
[7] BAMBURG J R, RIGGS N V, STRONG F M, et al. The structures of toxins from two strains of Fusarium tricinctum[J]. Tetrahedron, 1968, 24(8): 3329-3336.
[8] UENO Y. Toxicology of microbial toxins[J]. Pure Appl Chem, 1986, 58(2):339-350.
[9] CHANH T C, HEWETSON J F. Structure/function studies of T-2 mycotoxin with a monoclonal antibody[J]. Immunopharmacology, 1991, 21(2): 83-89.
[10] KALANTARI H, MOOSAVI M. Review on T-2 Toxin[J]. J Natural Pharmfcentical Prodacts, 2010, 5(1):26-38.
[11] AGRAWAL M, YADAV P, LOMASH V, et al. T-2 toxin induced skin inflammation and cutaneous injury in mice[J]. Toxicology, 2012, 302(2-3): 255-265.
[12] MEISSONNIER G M, LAFFITTE J, RAYMOND I, et al. Subclinical doses of T-2 toxin impair acquired immune response and liver cytochrome P450 in pigs[J]. Toxicology, 2008, 247(1): 46-54.
[13] SOKOLOVIC M, GARAJ-VRHOVAC V, SIMPRAGA B. T-2 toxin: Incidence and toxicity in poultry[J]. Arh Hig Rada Toksikol, 2008, 59(1): 43-52.
[14] SIREN A L, FEUERSTEIN G. Effect of T-2 toxin on regional blood flow and vascular resistance in the conscious rat[J]. Toxicol Appl Pharmacol, 1986, 83(3): 438-444.
[15] WEIDNER M, HUWEL S, EBERT F, et al. Influence of T-2 and HT-2 toxin on the blood-brain barrier in vitro: New experimental hints for neurotoxic effects[J]. PLoS One, 2005, 8(3):1-10
[16] DOI K, UETSUKA K. Mechanisms of mycotoxin-induced dermal toxicity and tumorigenesis through oxidative stress-related pathways[J]. J Toxicol Pathol, 2014, 27(1): 1-10.endprint
[17] VENKATESH P, VAIRAMUTHU S, BALACHANDRAN C, et al. Induction of apoptosis by fungal culture materials containing cyclopiazonic acid and T-2 toxin in primary lymphoid organs of broiler chickens[J]. Mycopathologia,2005,159(3):393-400.
[18] CHAUDHARI M, JAYARAJ R, BHASKAR A S, et al. Oxidative stress induction by T-2 toxin causes DNA damage and triggers apoptosis via caspase pathway in human cervical cancer cells[J]. Toxicology, 2009, 262(2): 153-161.
[19] AGRAWAL M, BHASKAR A S, RAO P V. Involvement of mitogen-activated protein kinase pathway in T-2 toxin-induced cell cycle alteration and apoptosis in human neuroblastoma cells[J]. Mol Neurobiol, 2015, 51(3):1379-1394.
[20] KEMPPAINEN B W, RILEY R T, JOYAVE J L, et al. In vitro percutaneous penetration and metabolism of[3H]T-2 toxin: Comparison of human, rabbit, guinea pig and rat[J]. Toxicon, 1987, 25(2): 185-194.
[21] JOHNSEN H, ODDEN E, JOHNSEN B A, et al. Metabolism of T-2 toxin by blood cell carboxylesterases[J]. Biochem Pharmacol, 1988, 37(16): 3193-3197.
[22] SWANSON S P, NICOLETTI J, ROOD H D, et al. Metabolism of three trichothecene mycotoxins, T-2 toxin, diacetoxyscirpenol and deoxynivalenol, by bovine rumen microorganisms[J]. J Chromatogr, 1987, 414(2): 335-342.
[23] SWANSON S P, ROOD H D, BEHRENS J C, et al. Preparation and characterization of the deepoxy trichothecenes: deepoxy HT-2, deepoxy T-2 triol, deepoxy T-2 tetraol, deepoxy 15-monoacetoxyscirpenol, and deepoxy scirpentriol[J]. Appl Environ Microbiol, 1987, 53(12): 2821-2826.
[24] LI Y, WANG Z, BEIER R C, et al. T-2 toxin, a trichothecene mycotoxin: Review of toxicity, metabolism, and analytical methods[J]. J Agric Food Chem,2011,59(8): 3441-3453.
[25] VISCONTI A, MIROCHA C J. Identification of various T-2 toxin metabolites in chicken excreta and tissues[J].Appl Environ Microbiol, 1985, 49(5):1246-1250.
[26] KNUPP C A, SWANSON S P, BUCK W B. Comparative in vitro metabolism of T-2 toxin by hepatic microsomes prepared from phenobarbital-induced or control rats, mice, rabbits and chickens[J]. Food Chem Toxicol, 1987, 25(11): 859-865.
[27] SHANG S, JIANG J, DENG Y. Chicken cytochrome P450 1A5 is the key enzyme for metabolizing T-2 toxin to 3'OH-T-2[J]. Int J Mol Sci, 2013, 14(6): 10809-10818.
[28] YUAN Y. ZhOU X, YANG J, et al. T-2 toxin is hydroxylated by chicken CYP3A37[J]. Food Chem Toxicol, 2013, 62: 622-627.
[29] ROBISON T S, MIROCHA C J, KURTZ H J, et al. Distribution of tritium-labeled T-2 toxin in swine[J]. J Agric Food Chem, 1979, 27(6): 1411-1413.endprint
[30] CORLEY R A, SWANSON S P, GULLO G J, et al. Disposition of T-2 toxin, a trichothecene mycotoxin, in intravascularly dosed swine[J]. J Agric Food Chem,1986, 34(5):868-875.
[31] CORLEY R A, SWANSON S P, BUCK W B. Glucuronide conjugates of T-2 toxin and metabolites in swine bile and urine[J]. J Agric Food Chem, 1985, 33(6):1085-1089.
[32] CHENG G, LIU C, WANG X, et al. Structure-function analysis of porcine cytochrome P450 3A29 in the hydroxylation of T-2 toxin as revealed by docking and mutagenesis studies[J]. PLoS One, 2014,9(9):1067-1069.
[33] WANG J, JIANG J, ZHANG H, et al. Integrated transcriptional and proteomic analysis with in vitro biochemical assay reveal the important role of CYP3A46 in T-2 toxin hydroxylation in porcine primary hepatocytes[J]. Mol Cell Proteomics, 2011, 10(9): 1-18.
[34] YOSHIZAWA T, SAKAMOTO T, KUWAMURA K. Structures of deepoxytrichothecene metabolites from 3'-hydroxy HT-2 toxin and T-2 tetraol in rats[J]. Appl Environ Microbiol, 1985, 50(3): 676-679.
[35] CONRADY-LORCK S, GAREIS M, FENG X C, et al. Metabolism of T-2 toxin in vascularly autoperfused jejunal loops of rats[J]. Toxicol Appl Pharmacol, 1988, 94(1): 23-33.
[36] KNUPP C A, SWANSON S P, BUCK W B. In vitro metabolism of T-2 toxin by rat liver microsomes[J]. J Agric Food Chem, 1986, 34(5):865-868.endprint
