利用SUMO技术表达可溶性的拟南芥AtRD22蛋白
2015-11-26唐玉林米子岚钟活权江年琼
唐玉林,米子岚,钟活权,江年琼,
1)深圳大学生命与海洋科学学院,深圳518060;2)深圳市海洋生物资源与生态环境重点实验室,深圳518060;3)深圳市微生物基因工程重点实验室,深圳518060
来自拟南芥的一个脱水应答基因(the Arabidopisis thaliana dehydration-responsive gene RD22,AtRD22)的cDNA中有1 179碱基对(base pair,bp)的核苷酸,编码一个含392个氨基酸残基的蛋白,该蛋白属于BURP蛋白家族.BURP蛋白最初是由Hattori等定义的一类在C-端具有保守的BURP结构域的蛋白,其命名取自于4个具有代表性成员:①油菜花粉粒胚胎发生时表达的一种蛋白(microscope-drived embryo from Brassica napus,BNM2);②蚕豆种子中丰度非贮存蛋白(abundant non-storage seed proteins from Vicia faba,USPs);③拟南芥中的一种受干旱诱导的蛋白(dehydration-responsive protein from Arabidopsis thaliana,RD22)[1];④番茄果实成熟时表达的多聚半乳糖醛酸酶Ⅰ的β亚基(β-subunit of polygalacturonase isozyme I from Lycopersicon esculentum,PG1β)[2].BURP 蛋白家族是植物所特有的一类蛋白,已有研究表明,它们在植物的生殖发育、果实成熟以及植物抵抗生物和非生物胁迫中发挥重要功能[3-6].AtRD22蛋白是BURP蛋白家族的典型成员之一,其基本结构如图1.在AtRD22蛋白的BURP结构域中存在较高比例的半胱氨酸、组氨酸和4个保守的半胱氨酸-组氨酸基序,这些氨基酸可能与二硫键的形成有关,也可能具有与过渡金属离子结合的潜力,推测其对蛋白结构的维持和功能的发挥有重要作用,但目前尚未得到验证,因此,通过体外表达获得具有活性的AtRD22蛋白对于研究该蛋白的功能具有重要意义.然而,外源蛋白在大肠杆菌(Escherichia coli,E.coli)中高水平表达时,新生肽链的聚集速率一旦超过蛋白正确折叠的速率就会导致包涵体的形成[7].如果重组蛋白含有二硫键,而在E.coli体内,由于还原性的环境不利于正确的二硫键的形成,导致重组蛋白链间的错配,也容易导致包涵体的形成.AtRD22蛋白的氨基酸序列中较高比例的半胱氨酸、组氨酸是与二硫键形成有关的氨基酸残基,这可能是该蛋白在E.coli中表达时容易形成包涵体的原因之一,而通过蛋白可溶性分析软件(http://biotech.ou.edu/)预测该蛋白的可溶性为 0.因此,如何在体外获得可溶性的AtRD22蛋白是进一步研究该蛋白结构和功能急需解决的技术瓶颈.

图1 AtRD22蛋白的基本结构示意图Fig.1 Protein structure diagram of AtRD22
融合标签能够在蛋白质的折叠过程中起作用,从而增加重组蛋白质的可溶性表达[8].pET32a载体是一种原核表达载体,利用该载体在E.coli中表达的融合蛋白含有硫氧原还蛋白A(thioredoxin A,TrxA)标签,有研究认为,TrxA具有提高重组蛋白溶解性的能力[9].pSUMO载体是由pET28a改造而来的原核表达载体,它是将一段小泛素相关修饰物(small ubiquitin-related modifier,SUMO)基因插入在pET28a载体的多克隆位点中,编码一个约100个氨基酸残基的小分子泛素样修饰蛋白.利用pSUMO载体在E.coli中表达的融合蛋白含有SUMO融合标签,该标签作为重组蛋白质表达的融合标签和分子伴侣,具有抗蛋白酶水解、提高重组蛋白质可溶性表达等功能[10-11].
为了获得AtRD22蛋白以研究其结构与功能,本研究利用反转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)的方法先从拟南芥总核糖核酸(ribonucleic acid,RNA)中克隆到了AtRD22全长互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA),再分别克隆到原核重组表达载体pET32a-RD22及pSUMO-RD22中,转化E.coli进行蛋白表达.通过一系列条件的优化,找出获得可溶性AtRD22蛋白质的最佳条件并鉴定了融合蛋白的表达.
1 材料与方法
1.1 实验材料
1.1.1 菌株与载体
质粒pET32a由本实验室保存;pSUMO由美国加州大学陈雪梅院士惠赠;E.coli Top10用于基因克隆;BL21(DE3)为融合蛋白表达宿主.
1.1.2 植物材料
哥伦比亚型(Columbia,Col.)拟南芥.
1.1.3 主要试剂
Trizol试剂(Invitrogen公司);逆转录试剂盒、EcoRⅠ、NotⅠ、PremeSTAR、T4 DNA连接酶和DNA分子质量标记(Takara公司);聚合酶链式反应(polymerase chain reaction,PCR)纯化试剂盒、琼脂糖凝胶DNA回收试剂盒和质粒小量提取试剂盒(Omega公司);卡那霉素(北京鼎国公司);蛋白分子质量标记(Fermentas公司);His-tag小鼠单克隆抗体、兔抗小鼠二抗(Abcam公司);WTAB显色试剂盒(上海生工).
1.2 实验方法
1.2.1 拟南芥总RNA提取与cDNA制备
取生长周期为1个月左右的拟南芥叶片2~3片(约100 mg),采用经典 Trizol法[12]提取 RNA,并利用PrimeScriptTMRT-PCR试剂盒反转录合成cDNA.
1.2.2 引物设计与合成
根据美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)登录的AtRD22基因序列,由软件Primer Premier 5.0分析并设计聚合酶链式反应(polymerase chain reaction,PCR)引物(表1).
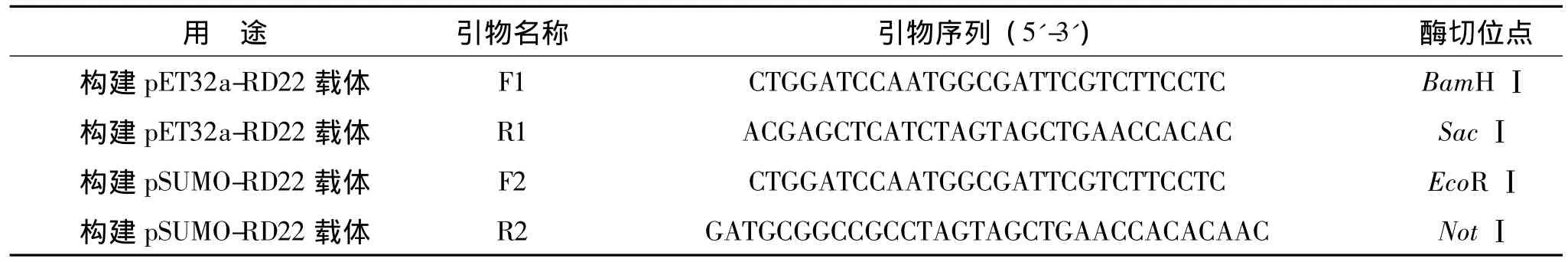
表1 实验引物汇总表Table1 List of primers
1.2.3 载体构建及鉴定
1)pET32a-RD22重组载体的构建和鉴定.以拟南芥(Col.)cDNA为模版,以 F1和R1为引物,PCR扩增出AtRD22基因的开放阅读框,将PCR产物和pET32a空载体用BamHⅠ和SacⅠ双酶切后用T4连接酶连接,再转化E.coli Top10,之后在含氨苄青霉素(10 mg/L)的LB平板过夜培养后对阳性单克隆依次进行菌落PCR和双酶切鉴定,最后进行测序验证.
2)pSUMO-RD22重组载体的构建和鉴定.以pET32a-RD22重组载体为模版,F2和R2为引物,扩增AtRD22基因的开放阅读框,将PCR扩增产物和pSUMO空载体分别用EcoRⅠ和NotⅠ双酶切后,再用T4连接酶连接,转化E.coli Top 10,之后在含硫酸卡那霉素(10 mg/L)的LB平板培养过夜,对阳性单克隆进行菌液PCR和双酶切鉴定,最后进行测序验证.
1.2.4 重组质粒的原核可溶性表达条件筛选
将测序成功的重组质粒pET32a-RD22和pSUMO-RD22分别转入E.coli BL21(DE3)感受态细胞中,挑取单克隆,在37℃ 的LB液体培养基中经2次扩大培养,至光密度(optical density,OD)D(600)值约为 0.8时,加入终浓度为 0.3 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropyl-β-Dithiogalactopyranoside,IPTG),分别在以下条件下继续诱导培养,在不同时间点分别测定菌液的D(600)值,并取样检测蛋白的表达.pET32a-RD22的诱导条件:37 ℃ 分别诱导 0、0.5、1.0、1.5 和2.0 h;28 ℃ 分别诱导 2.0、4.0 和8.0 h;16 ℃ 分别诱导 6.0、8.0 和12.0 h.pSUMO-RD22的诱导条件:37℃分别诱导1.0、2.0和3.0 h;28℃分别诱导 2.0、4.0 和8.0 h;16 ℃ 分别诱导6.0、8.0和12.0 h.检测方法:将菌液离心后,根据菌液的D(600)值加入相应体积的平衡缓冲液(50 mmol/L Tris-HCl,200 mmol/L NaCl, pH=8.0)重悬菌体,使样品的菌体浓度一致,各样品留取20 μL用于总蛋白检测,其余样品进行超声破碎后离心取上清,获得各诱导条件下的可溶性蛋白,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(dodecyl sulfate,sodium salt-polyacrylamide gel electrophoresis,SDS-PAGE).
1.2.5 利用蛋白质免疫印迹鉴定表达的融合蛋白
SDS-PAGE电泳后,采用湿法转移法将蛋白质转移至硝酸纤维素膜上,5%脱脂奶粉室温封闭2.0 h后,用鼠抗6×组氨酸抗体4℃ 孵育过夜,然后用洗膜缓冲液(20 mmol/L Tris-HCl,150 mmol/L NaCl,体积分数为0.05%的Tween20)洗膜3次,每次5 min,加入2 000倍稀释的兔抗鼠免疫球蛋白G(immunoglobulin G,IgG),室温孵育2.0 h,洗膜缓冲液洗涤3次,每次5 min,最后用W-TAB试剂盒显色.
1.2.6 质谱鉴定表达的目的蛋白
将诱导后的蛋白进行SDS-PAGE电泳,考马斯亮蓝染色脱色后,挖取特异性条带部分经胶内酶解[13]后,采用高分辨质谱仪 AB SCIEX Triple TOFTM 5600检测鉴定.
2 结果与分析
2.1 拟南芥RNA的提取及AtRD22基因的克隆
利用Trizol法提取拟南芥叶RNA后取5 μL进行非甲醛变性核酸电泳,见图2(a).RNA条带完整,无拖尾现象,表明该方法获得的RNA比较完整.提取的RNA利用核酸分析仪测定得到RNA质量浓度为 450 ng/μL,D(260)/D(280)=1.85,说明RNA的质量浓度可满足反转录的要求.将RNA反转录成cDNA后,以cDNA为模版,F1和R1为引物,PCR扩增,经琼脂糖凝胶电泳后可见一条与目的基因片段大小(1 179 bp)相符的特异性条带,见图2(b).将该PCR片段与pET32a载体连接后转化E.coli Top10,在LB平板上培养过夜.对阳性单克隆进行菌液PCR和双酶切鉴定,见图2(c)和图2(d),并经测序验证正确.
以pET32a-RD22为模版,F2和R2为引物扩增出AtRD22基因的开放阅读框,将扩增产物与pSUMO空载体连接后转入E.coli Top10感受态细胞中,在LB平板上过夜培养后对阳性单克隆进行菌液PCR和双酶切鉴定,见图2(e)和图2(f),并经测序验证正确.

图2 重组表达载体的构建及鉴定Fig.2 Construction and identification of recombinant expression vector
2.2 融合蛋白的诱导表达
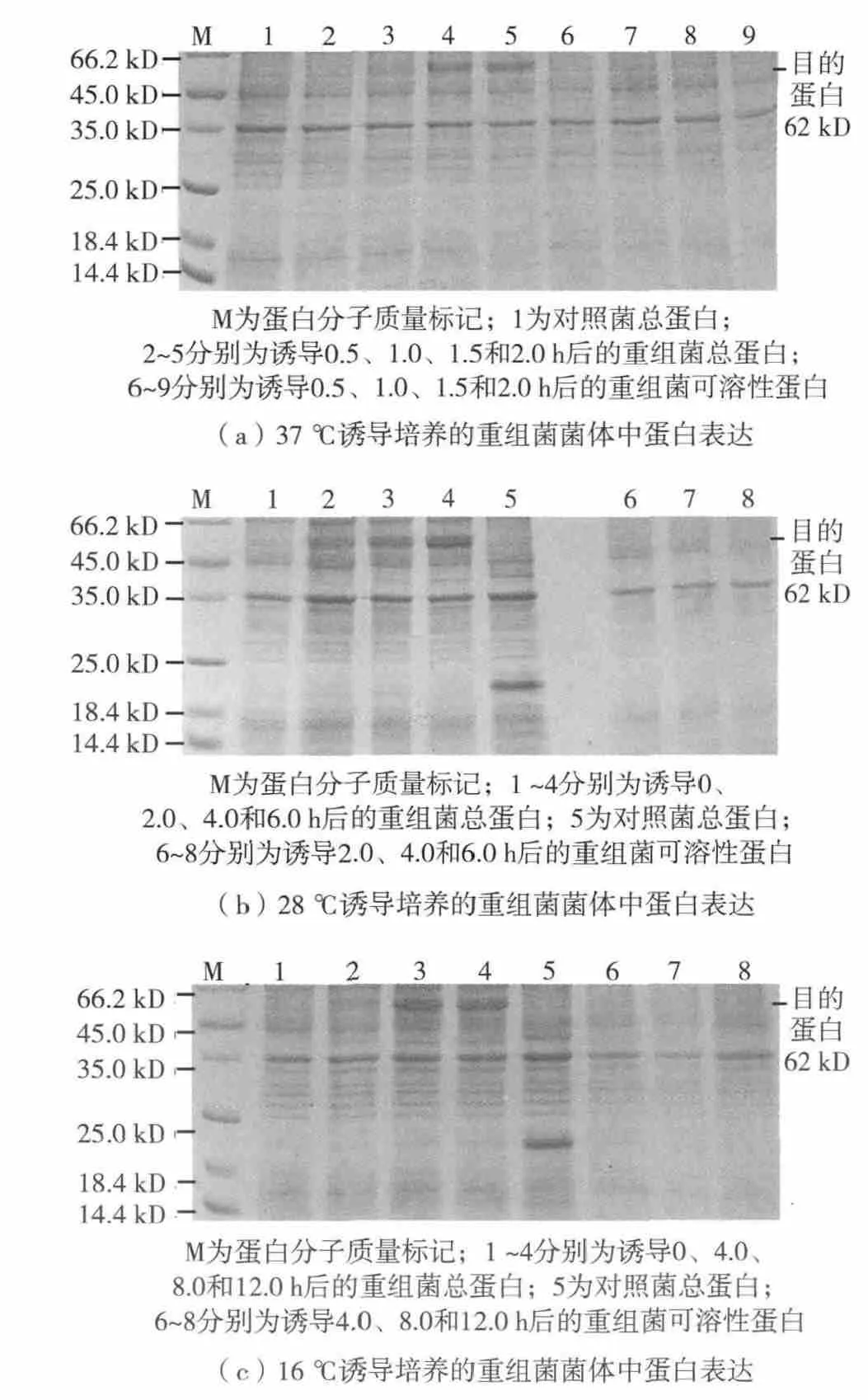
图3 转化pET32a-RD22的菌中融合蛋白的诱导表达情况Fig.3 (Color online)The expression of fusion protein using pET32-RD22
为建立适宜的AtRD22蛋白的原核表达条件,研究了诱导温度、诱导时间和诱导剂浓度对目标蛋白可溶性表达的影响.结果表明诱导温度和诱导时间对目标蛋白可溶性表达影响较大,见图3和图4(蛋白质相对分子质量单位:u,1 D=1 u),而当诱导剂浓度分别为0.3、0.5和1.0 mmol/L时,可溶性目标蛋白的量几乎无变化(结果未显示),因此选取0.3 mmol/L作为本实验中的诱导剂浓度.转化了pET32a-RD22和pSUMO-RD22的重组 E.coli,经不同条件培养和诱导后,总蛋白中均分别有与各自目的蛋白分子量大小相等的特异性蛋白出现,且转化了pET32a-RD22的重组菌在被诱导1.5~12.0 h后目的条带清晰而粗厚,显示其目的蛋白的表达量较高.但可溶性蛋白中的特异性蛋白的存在情况不同.在诱导温度为37、28和16℃时,不同诱导时间后的pET32a-RD22重组菌经超声破碎获得的上清液作为可溶性蛋白,经SDS-PAGE后均未见与目的蛋白分子量大小一致的明显条带.而pSUMORD22重组菌在不同的温度和时间下诱导培养后,其表达的可溶性蛋白中均有与目的蛋白分子量大小相等的特异性蛋白条带出现;当培养温度为28℃诱导6.0 h,或16℃诱导8.0 h以上时,可溶性蛋白中的特异性条带蛋白表达量相对较高,见图4(b)和图4(c).

图4 转化pSUMO-RD22的菌中融合蛋白诱导表达情况Fig.4 (Color online)The expression of fusion protein using pSUMO-RD22
2.3 可溶性蛋白的鉴定
通过对图4的结果分析,对转化了 pSUMORD22重组载体的E.coli在优化条件下,即在IPTG浓度为0.3 mmol/L时,28℃诱导6 h,进行融合蛋白的表达.分别取总蛋白、包涵体蛋白和可溶性蛋白进行SDS-PAGE电泳后转膜进行蛋白质免疫印迹(western blot,WB)分析,一抗为小鼠抗His抗体,二抗为辣根过氧化物酶标记的兔抗小鼠IgG.结果如图5,由图5可见,在总蛋白及可溶性蛋白中均有一条约60 kD(1 D=1 u)的条带,见图5.进一步对该特异性条带进行质谱鉴定,确认该蛋白条带为拟南芥AtRD22蛋白.证明利用pSUMO-RD22载体成功表达了可溶性的SUMO-RD22融合蛋白.

图5 利用WB鉴定重组菌蛋白的表达Fig.5 (Color online)Identification of fusion protein using WB
3 讨论
利用原核表达系统表达异源蛋白具有简便、价廉、高效等优点,已广泛用于科学研究中.但重组的外源蛋白在E.coli中高水平表达时经常导致蛋白聚集容易形成不溶的、无活性的包涵体,而包涵体蛋白虽然较易纯化,但后续的复性等工作繁琐,且不一定能得到具有功能的蛋白,所以在体外表达可溶性的蛋白将大大简化进一步的蛋白实验[7].
目前,许多融合标签系统已作为实现蛋白可溶性表达和纯化常用的方法,但不同的融合标签对于提高不同蛋白溶解性及表达量的能力不同[14].TrxA是还原蛋白二硫键的催化剂,它作为融合标签可以提高蛋白的溶解性[15].AtRD22蛋白中可能含有较多的二硫键,其在原核表达中难以进行可溶性表达的原因之一可能是二硫键未能正确折叠,与TrxA融合表达后的AtRD22蛋白的大部分以包涵体形式存在,可溶性目的蛋白的量很少,这可能是由于TrxA未能促进AtRD22蛋白的正确折叠.SUMO作为N-端融合标签,能够显著提高融合蛋白的表达量[10].AtRD22具有亲水的外表面,内部是一个疏水核心,这种结构可能使它对其他不溶性的蛋白以一个类似去垢剂的物质发挥作用,能够促进蛋白的正确折叠[16],提高目标蛋白的稳定性和可溶性[10].本研究将pET32a-RD22转化E.coli后表达的融合蛋白在不同的诱导温度及诱导时间下,融合蛋白的可溶性均很低,而利用pSUMO-RD22转化E.coli表达出的融合蛋白在不同的温度及诱导时间下,融合蛋白的可溶性均相对提高.由此可知,促溶标签对于提高AtRD22蛋白溶解性的影响较大,SUMO融合标签对AtRD22蛋白的促溶作用明显优于TrxA.利用pSUMO-RD22重组载体可在E.coli中表达出可溶性程度较高的AtRD22融合蛋白.
分析不同诱导温度及诱导时间对pSUMO-RD22蛋白可溶性表达的影响,结果发现,当诱导温度为37℃时,随着诱导时间的延长,可溶性目的蛋白的含量在1.0、2.0和3.0 h时没有明显改变;当诱导温度为28℃时,可溶性目的蛋白量在诱导4.0和6.0 h时要明显多于诱导2.0 h时;当诱导温度为16℃时,随着诱导时间的增加,可溶性目的蛋白量增加,在诱导的8.0和12.0 h都表现为有较高含量的可溶性目的蛋白.当诱导温度为28和16℃时,可溶性目的蛋白量均明显高于37℃时的获取量.推测当诱导温度较高时,蛋白的表达速度较快,可能使得蛋白不能够正确折叠,进而造成蛋白的可溶性降低.这些结果说明,低温诱导有利于可溶性AtRD22蛋白的表达和积累,一定的诱导时间对于提高可溶性蛋白的量是有效的.考虑到后续蛋白大量纯化的时间和效率,28℃诱导培养6.0 h将是诱导获得该蛋白的较为合适的条件.
体外获得具有活性的AtRD22蛋白将有利于对该蛋白的结构和功能的认识,进而丰富对BURP蛋白家族的了解,而在E.coli中表达出可溶性的AtRD22蛋白则为这一工作奠定了基础.
结 语
本研究构建了拟南芥AtRD22基因的原核表达载体,探索了体外表达可溶性融合蛋白的条件,结果表明,利用SUMO表达系统在诱导温度为28℃,诱导6.0 h,或16℃,诱导8.0 h以上时,可在重组菌中表达出相对含量较多的可溶性目的蛋白.
/References:
[1]Yamaguchi-Shinozaki K,Shinozaki K.The plant hormone abscisic acid mediates the drought-induced expression but not the seed-specific expression of rd22,a gene responsive to dehydration stress in Arabidopsis thaliana[J].Molecular& General Genetics,1993,238(1/2):17-25.
[2]Hattori J,Boutilier K A,Campagne M M L,et al.A conserved BURP domain defines a novel group of plant proteins with unusual primary structures[J].Molecular&General Genetics:MGG,1998,259(4):424-428.
[3]Tang Yulin,Cao Yan,Ou Zhonghua,et al.Regulatable gene expression controlled by the promoter of Sali3-2 under different abiotic stresses[J].Journal of Shenzhen University Science and Engineering,2012,29(1):73-79.(in Chinese)唐玉林,曹 雁,欧忠华,等.非生物胁迫因子对大豆Sali3-2基因的调控作用 [J].深圳大学学报理工版,2012,29(1):73-79.
[4]Harshavardhan V T,Son L V,Seiler C,et al.AtRD22 and AtUSPL1,members of the plant-specific BURP domain family involved in Arabidopsis thaliana drought tolerance[J].PlOS One,2014,9(10):e110065.
[5]Tang Yulin,Cao Yan,Gao Zhan,et al.Expression of a vacuole-localized BURP-domain protein from soybean(SALI3-2)enhances tolerance to cadmium and copper stresses[J].PlOS One,2014,9(6):e98830.
[6]Tomas Matus J,Aquea F,Espinoza C,et al.Inspection of the grapevine BURP superfamily highlights an expansion of RD22 genes with distinctive expression features in berry development and ABA-mediated stress responses [J].PLOS One,2014,9(10):e110372.
[7]Sorensen H P,Mortensen K K.Soluble expression of recombinant proteins in the cytoplasm of Escherichia coli[J].Microbial Cell Factories,2005,4(1):1-8.
[8]Young C L,Britton Z T,Robinson A S.Recombinant protein expression and purification:a comprehensive review of affinity tags and microbial applications[J].Biotechnology Journal,2012,7(5):620-634.
[9]Dümmler A,Lawrence A M,De Marco A.Simplified screening for the detection of soluble fusion constructs expressed in E.coli using a modular set of vectors[J].Microbial Cell Factories,2005,4(34):1-10.
[10]Malakhov M P,Mattern M R,Malakhova O A,et al.SUMO fusions and SUMO-specific protease for efficient expression and purification of proteins[J].Journal of Structural and Functional Genomics,2004,5(1/2):75-86.
[11]Zhang Licong,Li Xiaodan,Wei Dandan,et al.Expression of plectasin in Bacillus subtilis using SUMO technology by a maltose-inducible vector[J].Journal of Industrial Microbiology& Biotechnology,2015,42(10):1369-1376.
[12]Logemann J,Schell J,Willmitzer L.Improved method for the isolation of RNA from plant tissues[J].Analytical Biochemistry,1987,163(1):16-20.
[13]Hu Wei,Fu Qiang,Zhu Pingchuan,et al.An optimized method of protein in-gel digestion for mass spectrometry identification [J].Journal of Southern Agriculture,2011,42(7):802-805.(in Chinese)胡 炜,付 强,朱平川,等.用于质谱鉴定蛋白质胶内酶解方法的优化 [J].南方农业学报,2011,42(7):802-805.
[14]Wu Shanshan,Zhu Yun,Chen Shanshan,et al.Progress in fusion tags and its applications in protein soluble expression [J].Chemical Industry and Engineering Progress,2014,33(4):993-998.(in Chinese)吴珊珊,朱 芸,陈珊珊,等.融合标签在蛋白质可溶性表达中的应用进展 [J].化工进展,2014,33(4):993-998.
[15]Li Juan,Liu Wen,Xiao Lei,et al.Two strategies for efficient expression of soluble recombinant human FGF-21[J].Journal of East China Normal University Natural Science,2012(6):114-121.(in Chinese)李 娟,刘 雯,肖 磊,等.实现人源FGF-21高效可溶性表达的两种策略[J].华东师范大学学报自然科学版,2012(6):114-121.
[16]Butt T R,Edavettal S C,Hall J P,et al.SUMO fusion technology for difficult-to-express proteins[J].Protein Expression and Purification,2005,43(1):1-9.
