纳米粒子对amyloid-β聚集的影响的研究进展
2015-11-26李冰石宋国丽
李冰石,薛 山,宋国丽
1)深圳大学化学与环境工程学院,深圳518060;2)深圳大学生命与海洋科学学院,深圳518060
蛋白质是生命的基本物质,参与生物体代谢的各个环节,执行多种生物化学功能.当蛋白代谢异常,在细胞内或细胞周围发生聚集,甚至纤维化时,就会引发多种疾病[1].例如,类淀粉蛋白的纤维化,会导致阿尔茨海默症(Alzheimer's disease,AD)、帕金森症和亨廷顿症等多种神经性疾病[2].其中,AD又称原发性老年痴呆症,是一种致死性的神经系统退行性疾病,折磨着全球数千万人,目前还没有精确的诊断工具和有效的治疗手段,临床表现为认知和记忆功能不断恶化,并伴随各种神经性的症状和行为障碍[3-4].导致这一疾病的主要因素是β-类淀粉蛋白(amyloid-β,Aβ)在大脑皮层发生错误聚集,生成了难溶的类淀粉纤维,纤维进而聚集成斑块,引起一系列的神经系统功能紊乱[2].其中,Aβ聚集形成的β-折叠状中间体也可能具有神经毒性[5].
Aβ一般含有36~43个氨基酸残基[6],由它的前体蛋白——类淀粉前体蛋白(amyloid precursor protein)通过水解酶水解得到[7].类淀粉蛋白的纤维化过程极为类似,即都包括成核和生长延伸阶段[8-9],并且形成 β 片层折叠结构[10].两个 Aβ 肽链分子的疏水部分结合在一起,形成三明治状的β-交叉结构,多个三明治状结构进一步通过疏水作用叠在一起,形成一个含有疏水核心及表面的胶束状寡聚体[11-13];寡聚体作为纤维核心,通过疏水作用、氢键和芳香基团间的堆叠等相互作用[14-15],进一步聚集和延伸,形成较稳定具有反向平行螺旋结构的原纤维;原纤维进而生长和缠绕形成成熟的更粗的纤维[16-17].Aβ1-40比 Aβ1-42更为常见,但 A-β1-42相对 A-β1-40更容易纤维化,毒性更强[12,18-19].
揭示Aβ在分子水平上的识别和自我组装原理是有效控制Aβ聚集和纤维化的关键,而抑制Aβ的聚集,溶解已形成的Aβ聚集体则被认为是一种治疗AD的潜在方法.正因如此,对Aβ的纤维化聚集的影响因素研究日益引起关注.研究表明,Aβ的聚集除了受溶液pH值、蛋白浓度、培养时间和温度变化等因素的影响外[17,20-21],纳米粒子也对Aβ的聚集具有重要影响.纳米粒子因其独特的物理、化学、电学和生物相容等性能,已成为生物和生物化学领域内不可或缺的工具[22-24].本文综述了金、金属复合物、金属氧化物及有机-无机等纳米粒子对Aβ的聚集影响的最新研究进展.
1 β-类淀粉蛋白聚集的影响因素
1.1 金纳米粒子对Aβ聚集的影响
金纳米粒子在生物医学方面的应用广泛[22,25].Liao等[26]通过Aβ1-40单体和预先培育的Aβ纤维与不同浓度的金纳米粒子共同培育,研究金纳米粒子对Aβ聚集的影响.结果显示,未经修饰的金纳米粒子能抑制Aβ纤维的形成,且改变原纤维的状态,使其生成片状纤维和球形寡聚体,如图1(a)所示;金纳米粒子还能影响已生成的Aβ成熟纤维,将其变成短的无定形状态,并且金纳米粒子会优先结合Aβ纤维而不是无定形的聚集体,如图1(b)所示.通过表面修饰共轭的羧基和氨基后金纳米粒子分别带负电荷和正电荷,只有未经修饰和羧基修饰带负电荷的金纳米粒子才能抑制Aβ聚集,这说明负电势是影响Aβ聚集的关键.疏水金纳米粒子与Aβ间的疏水作用只能影响纤维形成的成核阶段,而随后的延长生长阶段则是通过带电纳米粒子的静电作用来调节.Majzik等[27]通过金纳米粒子与Aβ1-42共同培育发现Aβ1-42分子能包裹在金纳米粒子的表面,使金纳米粒子无法团聚成簇,这与Liao等[26]的实验结果一致.Lee等[28]利用大脑内脂质双分子层作为基底,研究金纳米粒子对Aβ聚集的影响,结果发现,当金纳米粒子存在时,流动的大脑脂质双分子层可以为金纳米粒子和Aβ提供结合位点,金纳米粒子能促进大尺寸的Aβ聚集体快速形成,更奇特的是Aβ斑块形成前并未形成Aβ纤维结构;当没有金纳米粒子时,则没有形成大尺寸的Aβ聚集体.这一结果说明金纳米粒子能够改变在脂质双分子层上的Aβ的2级结构及组装路径.

图1 不同形态下的Aβ在加入不同浓度未经修饰的金纳米粒子情况下培育后的TEM图[26]Fig.1 Morphologies of the Aβ species respectively with different concentration AuNPs monitored by TEM[26]
有机分子姜黄素能在体外和体内抑制Aβ的聚集[29],且有效地抑制由金属离子(如 Cu2+和Zn2+)诱导引起的Aβ的纤维化聚集[30].Palmal等[31]用羧基修饰的姜黄素和伯胺封端的氧化硅包覆的金纳米粒子通过共价键结合得到了水溶性的姜黄素修饰的金纳米粒子.研究发现该复合粒子不仅能有效抑制Aβ的纤维化,还能分解已聚集的Aβ纤维,其效果超过单独作用的金纳米粒子、姜黄素或两者的混合物.这可能是因为金-姜黄素复合纳米粒子具有很好的水溶性及金纳米粒子表面结合了更多的姜黄素基团.通过对小鼠神经瘤细胞的毒性测试发现,在姜黄素修饰后的金纳米粒子的存在条件下,细胞的存活率由只有Aβ纤维存在时的50%提高到90%.实验显示被分解后的Aβ纤维片段和寡聚体对小鼠神经瘤细胞毒性很低,基本不影响其存活率.这一结果说明,这种抑制Aβ纤维化和分解Aβ纤维的方法对治疗AD症极具潜力.
1.2 金属复合物对Aβ聚集的影响
有研究表明,一些金属离子如 Cu2+、Zn2+、Fe3+和Al3+能影响Aβ的聚集[32-41],而且是老年斑形成过程中的生长因子,在老年斑和AD病人的大脑皮质组织中也发现了高浓度的上述金属离子[42-43].
在过渡金属复合物中,2价的铜、铂和钌的复合粒子能够结合和抑制 Aβ的聚集[44-46].Streltsov等[47]使用X射线吸收光谱、动态光散射及密度泛函理论等手段研究了铂金属复合物与Aβ1-16和Aβ1-40蛋白之间的相互作用,发现含有1,10-邻二氮杂菲的2价铂复合物(L-PtCl2)能与Aβ侧链的组氨酸咪唑相互结合,改变蛋白的生化和生理性质.他们认为芳香分子1,10-邻二氮杂菲使铂复合物能够优先与Aβ上的组氨酸结合.Man等[48]利用3组3价铱和3价铑的复合物(图2)来抑制Aβ1-40蛋白的聚集,并研究了几种不同的平面芳香性碳氮共配体对配合物抑制作用的影响.图2显示,可溶金属配合物都有不稳定的配体,可以被Aβ1-40蛋白中组氨酸的N端取代.通过荧光测试,当配合物的中心金属是铑,碳氮共配为2-苯基吡啶,配合物浓度为5 μmol/L时抑制效果最好,几乎完全抑制,这一结果可能与大的平面碳氮共配体的空间效应有关.

图2 三组承载不同金属中心和碳氮共配体的可溶金属复合物的化学结构[48]Fig.2 Chemical structures of the solvato complexes bearing different metal centers and C/N ligands[48]
金属复合物结合了无机金属和有机多功能性基团的优点,通过无机物的官能团与Aβ中的氨基酸形成配体来抑制Aβ纤维的生成,这比选择单一的无机金属粒子或有机化合物作为抑制剂更有应用前景.
1.3 金属氧化物对Aβ聚集的影响
关于金属氧化物对Aβ纤维化过程的影响研究,目前开展得较少,已报道的研究主要是在金属氧化物粒子表面包裹带电的有机物,通过纳米粒子的表面吸附,增大局部蛋白浓度及有机基团与Aβ单体或者寡聚体之间的相互作用,从而影响Aβ的聚集纤维化过程.
Wu 等[49]研究了 TiO2、SiO2、ZrO2和CeO2等氧化物纳米粒子对 Aβ聚集的影响,研究发现,TiO2能缩短纤维生成的成核阶段,促进Aβ纤维的生成,而其他氧化物粒子对其几乎没有影响.Wu等认为这一结果证明纳米粒子对Aβ聚集的影响取决于粒子的表面吸附能,而不是粒径大小.TiO2将Aβ吸附到表面,使其在溶液和粒子表面达到一个平衡,吸附到粒子表面的Aβ局部浓度升高,从而加快了低聚物的形成.
超顺磁氧化铁纳米粒子具有较好的生物相容性和特有的磁性,是具有应用前景的生物医学材料[50].Mahmoudi等[51]用氨基和羧基修饰、葡萄聚糖包裹的超顺磁Fe2O3纳米粒子,并研究了其包裹层的厚度和带电情况对Aβ聚集的影响.他们发现带正电的双层包覆的磁性Fe2O3纳米粒子对Aβ的聚集有双重影响,如图3,低粒子浓度时,抑制其聚集;而高浓度时,通过缩短其成核时间促进其纤维化.Cabaleiro-Lago等[52]研究的由氨基修饰的聚苯乙烯纳米粒子对Aβ的聚集影响实验中也有相似的发现.纳米粒子表面的正电荷可能与Aβ带负电荷的部分相互作用,改变Aβ低聚物的构象使其更容易聚集.但是由羧基修饰的葡萄聚糖包裹的带负电的磁性Fe2O3纳米粒子,不论单层还是双层,在很低的粒子浓度条件下都会延迟或抑制Aβ的纤维化过程,其影响随粒子浓度增大无明显变化.一个可能的机理是,磁性Fe2O3纳米粒子的表面负电荷和Aβ的疏水核心中的氨基骨架结构相互作用,改变了疏水核心的结构从而抑制蛋白聚集.另外,磁性Fe2O3的粒子尺寸也是重要的影响因素:当减少葡萄聚糖包裹层的厚度而减少磁性Fe2O3粒子的尺寸时,粒子对Aβ纤维化过程的抑制更明显.
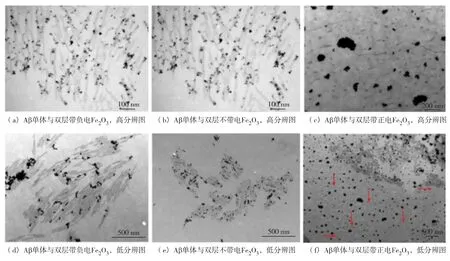
图3 Aβ单体(0.5 μmol/L)和双层带负电、不带电、带正电的由葡萄聚糖包裹的超顺磁Fe2O3纳米粒子(100 μg/mL)共同培育2 400 min后,两种不同放大倍率的TEM图[51].当带正电的葡萄聚糖包裹的超顺磁Fe2O3纳米粒子存在时,只发现了很短的纤维(图中箭头标出)Fig.3 (Color online)TEM images of Aβ fibrils after 2 400 min incubation of A β monomers(0.5 μmol/L)with double layer negative(left),plain(middle),and positive(right)dextran-coated superparamagnetic iron oxide nanoparticles(SPIONs)(100 μg/mL)[51].only very small fibrils are observed in the case of the positively charged dextran-coated SPIONs(as arrows indicated)
1.4 有机-无机纳米粒子对Aβ聚集的影响
有机聚合物因具有很大的表面积及有可作为反应的结合位点的多官能团,对Aβ的聚集有显著影响.Cabaleiro-Lago等[53]刚开始发现异丙基丙烯酰胺纳米粒子能与Aβ单体和寡聚体相互作用,抑制其成核过程进而延长其纤维化进程.在不同浓度氨基改良的聚苯乙烯纳米粒子存在下Aβ纤维化的动力学显示,蛋白浓度一定时,随着纳米粒子总表面积的变化会产生不同的效果:当纳米粒子单位表面积上蛋白浓度较大时,可促进Aβ纤维化进程;当纳米粒子单位表面积上蛋白浓度较小时,则抑制Aβ 纤维化[52].Cabaleiro-Lago等[52]提出当Aβ 和纳米粒子共存时,至少存在两个不同的聚集路径.路径1:Aβ单体在溶液中能自由聚集形成纤维,聚集速率v=vsolution;路径2:Aβ单体吸附在粒子表面发生聚集,聚集速率v=vparticle(图4).整个纤维化过程取决于这两种不同路径的贡献作用大小.未加入颗粒时,Aβ单体在溶液中能自由结合形成纤维;当加入纳米颗粒且浓度较低时,除溶液中自由形成纤维外,颗粒表面也会吸附Aβ单体,形成纤维核心,并进一步生成Aβ纤维.纤维生成的总速率大于未加入颗粒时的速率;当颗粒浓度高到某一定值时,由于比表面积较大,溶液中的大部分Aβ单体被吸附到粒子表面,导致溶液中的Aβ浓度很小,溶液中形成纤维的速率大大降低,而单个粒子表面所吸附的Aβ单体也很少,粒子表面的Aβ纤维化也很难进行,这样粒子对纤维生成具有抑制作用,如图4.

图4 不同浓度的纳米颗粒对Aβ聚集的不同影响效果示意图,其中椭圆小颗粒代表Aβ单体,圆球代表纳米粒子[52]Fig.4 (Color online)Schematic illustration of the effect of nanoparticles with different concentrations on Aβ aggregation.Ellipses representing Aβ monomers and circles representing nanoparticles[52]
丙炔苯丙胺是一种单胺氧化酶的抑制剂.有研究表明,单胺氧化酶抑制剂能够减少神经损害[54],且可能抑制 Aβ 纤维的形成[55].Baysal等[56]用水-油-水乳化液蒸发法制备了一种装载了丙炔苯丙胺的聚乳酸-b-聚乙二醇有机纳米聚合粒子,并研究了该纳米粒子对Aβ纤维的去稳定化影响.研究发现,随着负载物丙炔苯丙胺量的增加,其对Aβ纤维生成的抑制效果越好,且在前6 h内,随着培养时间的延长抑制效果也增加,6 h后达到最好效果.在前2 h内,聚乳酸-b-聚乙二醇纳米粒子上负载的丙炔苯丙胺的释放率约为70%,这种井喷式的释放是由于粒子上负载的丙炔苯丙胺快速溶解;丙炔苯丙胺的释放在2~10 h达到平衡,可持续72 h.其对Aβ纤维形成的主要影响阶段还需要进一步实验来确定.
已有文献报道表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)能与Aβ相互作用,改变其聚集路径,促进其组装成低毒的聚合结构[57].另外,硒蛋白具有抗氧化和神经保护作用,能够预防阿尔茨海默症的发生[58].Zhang等[59]合成了一种由多肽四环素-1(Tet-1)包裹的表没食子儿茶素没食子酸酯稳定的硒纳米粒子(Tet-1-EGCG@Se)并研究了该有机-无机复合纳米粒子对Aβ聚集的影响.结果发现该纳米粒子对Aβ有很强的吸引.Tet-1-EGCG@Se和表没食子儿茶素没食子酸酯稳定的硒纳米粒子(EGCG@Se)都能有效抑制Aβ的聚集使其生成小的寡聚体,如图5.其中,前者比后者抑制效果更好,可能原因是Tet-1-EGCG@Se粒子带正电,且Tet-1能与Aβ发生疏水性相互作用.不仅如此,Tet-1-EGCG@Se复合粒子还能有效地将成熟的Aβ纤维分解,使其转化成随机盘绕的无定形结构.该有机/无机复合纳米粒子在抑制和分解Aβ纤维方面作用显著,是一种潜在的治疗剂.但它与Aβ和纤维的具体作用机理还需进一步研究,并进行更多的体外和体内研究来验证其在治疗阿尔茨海默症方面的效果以及在其他蛋白类疾病上的应用.
有机纳米聚合物粒子具有独特的尺寸效应,可以穿透生物屏障(如脑-血屏障),将药物分子更准确的运送到目标区域;并且能传送不溶性药物分子,运送完成后在体内被分解清除,具有低毒性等优点,因而在新的药物传送系统中具有重要应用前景[60-61].这些优点对于设计可作为Aβ纤维抗体载体的纳米粒子用于治疗阿尔茨海默症具有重要意义.

图5 Aβ聚集体形成的TEM图[59]Fig.5 TEM images of Aβ aggregates[59]
结 语
Aβ的纤维化被认为是导致AD的重要原因,纤维化速度的加快可能增加AD的发病风险,而抑制Aβ聚集和纤维的形成则被认为是对AD极富潜力的治疗方法.很多类淀粉蛋白可以吸附在不同基质上,针对Zn2+、Cu2+及Cu+等金属离子所引起的Aβ的无定形聚集,本课题组已开展相关研究,试图寻找抑制或逆转Aβ聚集的方法.前期研究发现:硒蛋白P的组氨酸富集区(His-rich domain of selenoprotein P,SelP-H)对Zn2+、Cu2+及Cu+具有较高的亲和力,通过螯合Zn2+、Cu+及Cu2+,从而有效抑制Zn2+、Cu+及Cu2+诱导的Aβ的无定形聚集,及其引发的ROS的生成及神经毒性.因此,SelP-H通过螯合金属离子,从而调控金属离子引发的Aβ的聚集,达到保护神经细胞的作用,可能在延缓AD进展方面具有一定的潜力.而具有小尺寸和高比表面积的纳米粒子,对很多类淀粉蛋白的聚集过程具有重要的影响.虽然纳米粒子和Aβ相互作用的研究及利用纳米技术来治疗AD已取得显著进展[62-63],然而,纳米粒子对各种 Aβ聚集体如Aβ斑块的形成的影响及其作用机理,抑制Aβ聚集过程中所产生的寡聚体等中间物对细胞毒性大小等问题仍有待进一步深入研究.探索某种纳米粒子与Aβ的相互作用,有助于了解Aβ的聚集机理及粒子对Aβ聚集的影响,设计和制备出特定的具有生物相容性、低毒性、副作用小和具有可降解性的纳米粒子,抑制Aβ的聚集或破坏其Aβ纤维结构,这将是未来研究的重点方向.
/References:
[1]Chiti F,Dobson C M.Protein misfolding,functional amyloid,and human disease [J].Annual Review of Biochemistry,2006,75(1):333-366.
[2]Swerdlow R H,Burns J M,Khan S M.The Alzheimer's disease mitochondrial cascade hypothesis:progress and perspectives[J].Biochimica et Biophysica Acta,2014,1842(8):1219-1231.
[3]Pimplikar S.Neuroinflammation in Alzheimer's disease:from pathogenesis to a therapeutic target[J].Journal of Clinical Immunology,2014,34(1):64-69.
[4]Jakob-Roetne R,Jacobsen H.Alzheimer's disease:from pathology to therapeutic approaches[J].Angewandte Chemie-International Edition,2009,48(17):3030-3059.
[5]Breydo L,Uversky V N.Structural,morphological,and functional diversity of amyloid oligomers[J].FEBS letters,2015,589(19):2640-2648.
[6]Iulita M F,Cuello A C.Nerve growth factor metabolic dysfunction in Alzheimer's disease and down syndrome[J].Trends in Pharmacological Sciences,2014,35(7):338-348.
[7]Selkoe D J.Alzheimer's disease:genes,proteins,and therapy[J].Physiological Reviews,2001,81(2):741-766.
[8]Sipe J D,Cohen A S.Review:history of the amyloid fibril[J].Journal of Structural Biology,2000,130(2/3):88-98.
[9]Westermark P,Benson M D,Buxbaum J N,et al.A primer of amyloid nomenclature[J].Amyloid-Journal of Protein Folding Disorders,2007,14(3):179-183.
[10]Nelson R,Sawaya M R,Balbirnie M,et al.Structure of the cross-beta spine of amyloid-like fibrils [J].Nature,2005,435(743):773-778.
[11]Lee C,Ham S.Characterizing amyloid-beta protein misfolding from molecular dynamics simulations with explicit water[J].Journal of Computational Chemistry,2011,32(2):349-355.
[12]Olofsson A,Lindhagen-Persson M,Sauer-Eriksson A ,et al.Amide solvent protection analysis demonstrates that amyloid-beta(1-40)and amyloid-beta(1-42)form different fibrillar structures under identical conditions[J].Biochemical Journal,2007,404(1):63-70.
[13]Olofsson A.Sauer-Eriksson A E,Ohman A.The solvent protection of alzheimer amyloid-beta-(1-42)fibrils as determined by solution NMR spectroscopy[J].The Journal of Biological Chemistry,2006,281(1):477-483.
[14]Azriel R,Gazit E.Analysis of the minimal amyloid-forming fragment of the islet amyloid polypeptide[J].Journal of Biological Chemistry,2001,276(36):34156-34161.
[15]Gazit E.A possible role for pi-stacking in the self-assembly of amyloid fibrils[J].FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology,2002,16(1):77-83.
[16]Mohamed A,Cortez L.De Chaves E P.Aggregation state and neurotoxic properties of alzheimer β-amyloid peptide[J].Current Protein and Peptide Science,2011,12(3):235-257.
[17]Serem W K,Bett C K,Ngunjiri J N.Studies of the growth,evolution,and self-aggregation of beta-amyloid fibrils using tapping-mode atomic force microscopy [J].Microscopy Research and Technique,2011,74(7):699-708.
[18]Shinkai Y,Yoshimura M,Ito Y,et al.Amyloid betaproteins 1-40 and 1-42(43)in the soluble fraction of extra-and intracranial blood vessels[J].Annals of Neurology,1995,38(3):421-428.
[19]Lewczuk P,Kornhuber J,Vanmechelen E,et al.Amyloid beta peptides in plasma in early diagnosis of Alzheimer's disease:a multicenter study with multiplexing[J].Experimental Neurology,2010,223(2):366-370.
[20]Yamaguchi T,Matsuzaki K,Hoshino M.Transient formation of intermediate conformational states of amyloid-beta peptide revealed by heteronuclear magnetic resonance spectroscopy [J].FEBS Letters,2011,585(7):1097-1102.
[21]Sabella S,Quaglia M,Lanni C,et al.Capillary electrophoresis studies on the aggregation process of beta-amyloid 1-42 and 1-40 peptides [J].Electrophoresis,2004,25(18/19):3186-3194.
[22]Bromberg L,Chang E P,Alvarez-Lorenzo C,et al.Binding of functionalized paramagnetic nanoparticles to bacterial lipopolysaccharides and DNA [J].Langmuir:the ACS Journal of Surfaces and Colloids,2010,26(11):8829-8835.
[23]Mu Bin,Liu Peng,Du Pengcheng,et al.Magnetic-targeted pH-responsive drug delivery system via layer-by-layer self-assembly ofpolyelectrolytes onto drug-containing emulsion droplets and its controlled release[J].Journal of Polymer Science Part A:Polymer Chemistry,2011,49(9):1969-1976.
[24]Jambhrunkar S,Qu Zhi,Popat A,et al.Effect of Surface Functionality of Silica Nanoparticles on Cellular Uptake and Cytotoxicity [J].Molecular Pharmaceutics,2014,11(10):3642-3655.
[25]Ke Qingqing,Pei Jiying,Yang Fan,et al.Visual Colorimetric Detection of Neurogenin 3 with Glutathione-Modified Gold Nanoparticle[J].Chinese Journal of Analytical Chemistry,2014,42(7):955-961.
[26]Liao Yihung,Chang Yujen,Yoshiike Yuji,et al.Negatively charged gold nanoparticles inhibit Alzheimer's amyloid-β fibrillization,induce fibril dissociation,and mitigate neurotoxicity[J].Small(Weinheim an der Bergstrasse,Germany),2012,8(23):3631-3639.
[27]Majzik A,Fueloep L,Csapo E,et al.Functionalization of gold nanoparticles with amino acid,beta-amyloid peptides and fragment[J].Colloids and Surfaces B Biointerfaces,2010,81(1):235-241.
[28]Lee H,Kim Y,Park A,et al.Amyloid-β aggregation with gold nanoparticles on brain lipid bilayer[J].Small(Weinheim an der Bergstrasse,Germany),2014,10(9):1779-1789.
[29]Yang F S,Lim G P,Begum A N,et al.Curcumin inhibits formation of amyloid beta oligomers and fibrils,binds plaques,and reduces amyloid in vivo[J].Journal of Biological Chemistry,2005,280(7):5892-5901.
[30]Banerjee R.Effect of curcumin on the metal ion induced fibrillization of amyloid-beta peptide[J].Spectrochimica Acta Part A Molecular and Biomolecular Spectroscopy,2014,117:798-800.
[31]Palmal S,Maity A R,Singh B K,et al.Inhibition of amyloid fibril growth and dissolution of amyloid fibrils by curcumin-gold nanoparticles[J].Chemistry(Weinheim an der Bergstrasse,Germany),2014,20(20):6184-6191.
[32]Zirah S,Kozin S A,Mazur A K,et al.Structural changes of region 1-16 of the Alzheimer disease amyloid beta-peptide upon zinc binding and in vitro aging[J].Journal of Biological Chemistry,2006,281(4):2151-2161.
[33]Danielsson J,Pierattelli R,Banci L,et al.High-resolution NMR studies ofthe zinc-binding site ofthe Alzheimer's amyloid beta-peptide [J].FEBS Journal,2007,274(1):46-59.
[34]Zou Jin,Kajita K,Sugimoto N.Cu2+inhibits the aggregation of amyloid β-peptide(1-42)in vitro [J].Angewandte Chemie International Edition,2001,40(12):2274-2277.
[35]Raman B,Ban T,Yamaguchi K,et al.Metal ion-dependent effects of clioquinol on the fibril growth of an amyloid beta peptide [J].Journal of Biological Chemistry,2005,280(16):16157-16162.
[36]Smith D P,Ciccotosto G D,Tew D J,et al.Concentration dependent Cu2+induced aggregation and dityrosine formation of the Alzheimer's disease amyloid-beta peptide [J].Biochemistry,2007,46(10):2881-2891.
[37]Dorlet P,Gambarelli S,Faller P,et al.Pulse EPR spectroscopy reveals the coordination sphere of copper(II)ions in the 1-16 amyloid-β peptide:a key role of the first two N-Terminus residues[J].Angewandte Chemie-International Edition,2009,48(49):9273-9276.
[38]Drew S C,Noble C J,Masters C L,et al.Pleomorphic Copper coordination by Alzheimer's disease amyloid-beta peptide [J].Journal of the American Chemical Society,2009,131(3):1195-1207.
[39]Huang X,Atwood C S,Hartshorn M A,et al.The Aβ peptide of Alzheimer's disease directly produces Hydrogen peroxide through metal ion reduction [J].Biochemistry,1999,38(24):7609-7616.
[40]Miura T,Suzuki K,Takeuchi H.Binding of iron(III)to the single tyrosine residue of amyloid beta-peptide probed by raman spectroscopy[J].Journal of Molecular Structure,2001,598(1):79-84.
[41]Ricchelli F,Drago D,Filippi B,et al.Aluminum-triggered structural modifications and aggregation of beta-amyloids[J].Cellular and Molecular Life Sciences,2005,62(15):1724-1733.
[42]Miller Y,Ma Buyong,Nussinov R.Zinc ions promote Alzheimer Aβ aggregation via population shift of polymorphic states[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(21):9490-9495.
[43]Lin Changjun,Huang Hanchang,Jiang Zhaofeng.Cu(II)interaction with amyloid-beta peptide:a review of neuroactivemechanismsin AD brains[J]. Brain Research Bulletin,2010,82(5/6):235-242.
[44]Lim S C,Paterson B M,Fodero-Tavoletti M T,et al.A copperradiopharmaceuticalfordiagnostic imaging of Alzheimer's disease:a bis(thiosemicarbazonato)copper(II)complex that binds to amyloid-beta plaques[J].Chemical Communications,2010,46(30):5437-5439.
[45]Barnham K J,Kenche V B,Ciccotosto G D,et al.Platinum-based inhibitors of amyloid-beta as therapeutic agents for Alzheimer's disease[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(19):6813-6818.
[46]Seixas J D,Santos M F,Mukhopadhyay A A,et al.A contribution to the rational design of Ru(CO)3Cl2L complexes for in vivo delivery of CO [J].Dalton Transactions,2015,44(11):5058-5075.
[47]Streltsov V A,Epa V C,James S A,et al.Structural insights into the interaction of platinum-based inhibitors with the Alzheimer's disease amyloid-beta peptide[J].Chemical Communications,2013,49(97):11364-11366.
[48]Man B Y W,Chan H M,Leung C H,et al.Group 9 metal-based inhibitors of β-amyloid(1-40)fibrillation as potential therapeutic agents for Alzheimer's disease [J].Chemical Science,2011,2(5):917-921.
[49]Wu Weihui,Sun Xun,Yu Yeping,et al.TiO2nanoparticles promote β-amyloid fibrillation in vitro [J].Biochemical and Biophysical Research Communications,2008,373(2):315-318.
[50]Mahmoudi M,Hofmann H,Rothen-Rutishauser B,et al.Assessing the in vitro and in vivo toxicity of superparamagnetic iron oxide nanoparticles [J].Chemical Reviews,2012,112(4):2323-2338.
[51]Mahmoudi M,Quinlan-Pluck F,Monopo M P,et al.Influence of the physiochemical properties of superparamagnetic iron oxide nanoparticles on amyloid β protein fibrillation in solution [J].ACS Chemical Neuroscience,2013,4(3):475-485.
[52]Cabaleiro-Lago C,Quinlan-Pluck F,Lynch I A,et al.Dual effect of amino modified polystyrene nanoparticles on amyloid beta protein fibrillation [J].ACS Chemical Neuroscience,2010,1(4):279-287.
[53]Cabaleiro-Lago C,Quinlan-Pluck F,Lynch I A,et al.Inhibition of amyloid beta protein fibrillation by polymeric nanoparticles[J].Journal of the American Chemical Society,2008,130(46):15437-15443.
[54]Foley P,Gerlach M,Youdim M B,et al.MAO-B inhibitors:multiple roles in the therapy of neurodegenerative disorders?[J].Parkinsonism & Related Disorders,2000,6(1):25-47.
[55]Ono K,Hasegawa K,Naiki H,et al.Anti-Parkinsonian agents have anti-amyloidogenic activity for alzheimer's βamyloid fibrils in vitro[J].Neurochemistry International,2006,48(4):275-285.
[56]Baysal I,Yabanoglu-Ciftci S,Tunc-Sarisozen Y A,et al.Interaction of selegiline-loaded PLGA-b-PEG nanoparticles with beta-amyloid fibrils[J].Journal of Neural Transmission,2013,120(6):903-910.
[57]Engel M F,Vandenakker C C,Schleeger M,et al.The polyphenol EGCG inhibits amyloid formation less efficiently at phospholipid interfaces than in bulk solution [J].Journal of the American Chemical Society,2012,134(36):14781-14788.
[58]Bellinger F P,Raman A V,Reeves M A.Regulation and function of selenoproteins in human disease[J].Biochemical Journal,2009,422(1):11-22.
[59]Zhang Jingnan,Zhou Xianbo,Yu Qianqian,et al.Epigallocatechin-3-gallate(EGCG)-stabilized selenium nanoparticles coated with Tet-1 peptide to reduce amyloid-β aggregation and cytotoxicity[J].ACS Applied Materials& Interfaces,2014,6(11):8475-8487.
[60]Medina C,Santos-Martinez M J,Radomski A,et al.Nanoparticles:pharmacological and toxicological significance[J].British Journal of Pharmacology,2007,150(5):552-558.
[61]Mulik R S,Monkkonen J,Juvonen R O,et al.ApoE3 mediated poly(butyl)cyanoacrylate nanoparticles containing curcumin:study of enhanced activity of curcumin against beta amyloid induced cytotoxicity using in vitro cell culture model[J].Molecular Pharmaceutics,2010,7(3):815-825.
[62]Brambilla D,Le Droumaguet B,Nicolas J A,et al.Nanotechnologies for alzheimer's disease:diagnosis,therapy,and safety issues [J].Nanomedicine:Nanotechnology,Biology,and Medicine,2011,7(5):521-540.
[63]Ni Jiazuan,Chen Ping,Liu Qiong,et al.Advance reseach on strategies for the prevention of Alzheimer's disease[J].Journal of Shenzhen University Science and Engineering,2013,30(4):331-348.(in Chinese)倪嘉缵,陈 平,刘 琼,等.阿尔茨海默病的防治策略研究进展[J].深圳大学学报理工版,2013,30(4):331-348.
