测定医用双氧水浓度实验方案设计及优化
2015-11-25周梅华李德前
文 周梅华 李德前
测定医用双氧水浓度实验方案设计及优化
文 周梅华 李德前
为测定医用双氧水中过氧化氢的浓度,笔者设计了几套实验方案;并通过逐步优化,培养学生的思维能力和操作技能,继而提升实验教学的有效性。过氧化氢溶液俗称双氧水,是初中化学常用的试剂,也是常用的医用消毒剂;也是一种不稳定的物质,随着放置时间的延长会逐渐分解,导致浓度下降。为了深化对溶质质量分数概念的理解,提升学生的化学实验技能,培养他们学以致用的能力,笔者在教学中设计了“测定医用双氧水浓度”的实验;通过对3种实验方案的逐步完善和优化,最终探究出适合学生实验的微型装置。
一、实验原理
根据溶质质量分数的概念,不难写出测定医用双氧水中过氧化氢浓度的数学表达式。
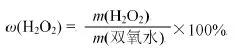
由公式可知,需要测定的数据是溶液质量(双氧水质量)及相应溶液中溶质质量(过氧化氢质量)。其中,溶液的质量既可以直接称质量,也可以量出体积后根据密度公式算出质量;溶质过氧化氢的质量一般通过其分解产物氧气的量来推算,氧气的量既可以测其质量,也可以测其体积。
二、设计实验方案
1.方案Ⅰ
通过测定氧气的质量来计算过氧化氢的质量,实验装置如图1所示。
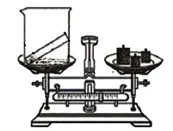
图1 通过质量差测定氧气质量
(1)测定氧气的质量
根据质量守恒定律可知,反应前后总质量的差值就是反应放出的氧气质量。
(2)确定实验用品
根据托盘天平的感量(精确到0.1g),并兼顾计算的方便,生成氧气的量可以预设为0.8 g左右,则过氧化氢的质量约为1.7 g;再根据医用双氧水浓度(约为3%)和密度(约为1.0 g/mL)可知,双氧水的体积至少为56.7 mL,所以烧杯的规格可选用100 mL的。为了便于控制反应的进行,可以将催化剂二氧化锰放在小试管内。
本实验的用品是:200 g托盘天平、100 mL烧杯、小试管、药匙等,适量的双氧水、二氧化锰等。
(3)实验操作
①先称量100 mL烧杯的质量,为53.7 g。加砝码拨游码到113.7 g,往烧杯内加入双氧水直到天平平衡,则双氧水质量为60 g。
②小试管内放入一定量的二氧化锰(不要让二氧化锰沾在试管外壁,防止称量总质量前就发生反应),然后小心地把小试管管口向上斜靠在盛有双氧水的烧杯内壁,称量反应前总质量(这样便于一次称出总质量,小试管壁外侧黏附的溶液不影响总质量,因为反应后小试管依然放在溶液内称量)。
③小心地把小试管内的二氧化锰倒入烧杯内,振荡烧杯,使反应充分,继续把小试管放入烧杯内,称量反应后总质量,差值则为氧气质量。
(4)实验的优缺点
优点:直接根据差量来测定氧气的质量,操作比较简单。
缺点:托盘天平精确到0.1 g,所以用药量比较大,反应的时间长,且不能保证双氧水全部分解。另外,该反应放出较多热量,使水蒸气逸出多,误差很大。
2.方案Ⅱ
通过测定氧气体积来计算过氧化氢的质量,实验装置如图2所示。
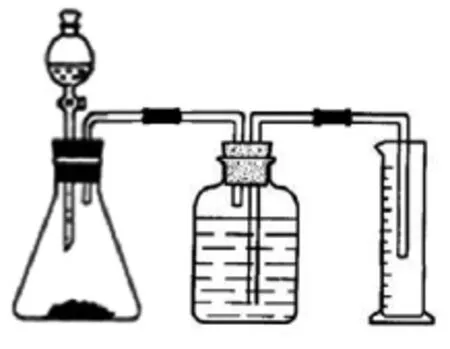
图2 直接测定氧气体积
(1)测定氧气的体积
根据已有的经验,可以选用量筒和广口瓶组装成量气装置[1],以量取氧气的体积。
(2)确定实验用品
根据氧气的密度为1.429 g/L,如果要收集的氧气量为50 mL,则氧气质量为0.071 45 g,则过氧化氢质量为0.16 g,进而可知3%的双氧水质量为5.3 g;由于此双氧水密度可看作为1.0 g/cm3,所以直接量取双氧水体积5.3 mL。
实验用品是250 mL锥形瓶、150 mL广口瓶、100 mL量筒、分液漏斗、双孔橡皮塞及胶皮管等,适量的双氧水、二氧化锰等。
(3)实验操作
①把分液漏斗和锥形瓶相连,检查装置气密性。
②广口瓶中装满水,然后把上述装置按照图2连接起来。
③在锥形瓶中加入二氧化锰,分液漏斗中加入双氧水,打开活塞,双氧水进入锥形瓶反应,随即气体进入广口瓶,把水压入量筒。
(4)实验的优缺点
优点:直接量取氧气的体积,方便直观。
缺点:由于少量的双氧水生成氧气的体积也是可观的,所以广口瓶内排出的水既快且多,学生不易控制,且该装置误差也较大。
3.方案Ⅲ
由于装置1、装置2需要的实验药品多,误差也比较大,因此从绿色化学角度考虑,利用注射器和小药瓶组合的微型实验测定氧气的体积,实验装置如图3所示。
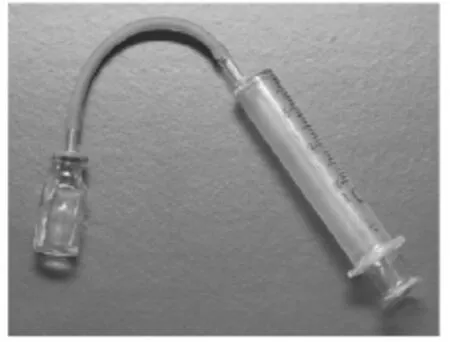
图3 测定氧气体积的微型装置
(1)测定双氧水和氧气的体积
使用注射器直接量取一定体积的双氧水并且测定生成的氧气体积。
(2)确定实验用品
本实验采用了规格是30 mL的注射器,产生氧气体积需控制在这量程内,可以取中间值约20 mL。据此可知,双氧水约需2 mL。
实验用品是青霉素小药瓶(带有胶皮盖)、30 mL注射器、长短合适的胶皮管等,适量的双氧水、二氧化锰等。
(3)实验操作
①将上述仪器按图3连接,先检查装置气密性:将注射器活塞往后拉,胶皮管变瘪,松开手后,活塞则慢慢回到原处,说明气密性好。
②小药瓶中装入少量二氧化锰,用注射器吸取双氧水2 mL,胶皮管连接注射器,然后把双氧水注入小药瓶中,反复推(目的是使双氧水充分分解),最后读出气体的体积数。
(4)实验数据的处理
量取2 mL医用双氧水(相当于2 g双氧水),氧气体积实际测得为21 mL,则氧气质量为0.03g,根据方程式计算得出过氧化氢质量为0.063 8 g,则根据公式计算:
ω(H2O2)=0.0638g/2g×100%=3.19%
由于测定的医用双氧水标签标示为3%左右,按照实验测定为3.19%,所以该医用双氧水符合标示。
(5)实验优点
①实验操作简便,利于学生实验;
②微型化实验,药品取用少,节约资源;
③在密闭体系内做实验,误差小,环保;
④利用废弃物小药瓶做实验,变废为宝。
三、结束语
该实验方案不仅适用于测定医用双氧水的浓度,同样也适用于能够固-液反应产生气体的实验,不仅能测定气体的体积,也能测定反应的溶液浓度,具有一定的实用性和推广性。化学教学的核心在于观念的教学[2],用所学知识设计实验解决问题正是化学科学价值观的体现。
[1]巩庆凯,胡贵和.测量气体体积的方法[J].中学化学教学参考,2012(11):36.
[2]卢巍.对化学基本观念及“观念建构”教学的认识[J].当代教育科学,2010(18):62-64.
作者信息
周梅华,本科,中教高级。常熟市外国语初级中学,215500
李德前,本科,中教特级。徐州市西苑中学,221006
