西藏设施茄子镰孢根腐病病原的分离及鉴定
2015-11-25杨成德代万安郝蓉蓉刘心刚
杨成德, 王 振, 代万安, 郝蓉蓉, 刘心刚, 杨 杰
(1.甘肃农业大学草业学院草业生态系统教育部重点实验室, 甘肃省草业工程实验室, 中-美草地畜牧业可持续发展研究中心,兰州 730070; 2. 西藏自治区农牧科学院蔬菜研究所, 拉萨 850032)
西藏设施茄子镰孢根腐病病原的分离及鉴定
杨成德1, 王 振1, 代万安2, 郝蓉蓉1, 刘心刚1, 杨 杰2
(1.甘肃农业大学草业学院草业生态系统教育部重点实验室, 甘肃省草业工程实验室, 中-美草地畜牧业可持续发展研究中心,兰州 730070; 2. 西藏自治区农牧科学院蔬菜研究所, 拉萨 850032)
本试验对西藏设施茄子镰孢根腐病症状和病原进行了研究。结果表明,其症状主要表现为植株根部或茎基部逐渐腐烂,后导致整个植株萎蔫枯死。根据病原菌形态特征及ITS序列分析结果,将致病菌鉴定为层出镰孢(Fusariumproliferatum),该病原菌的最适生长温度为30 ℃,最适碳源为树胶醛糖和甘露糖,最适氮源为硝酸钠;研究结果为该病害的综合防治提供依据。
茄子根腐病; 鉴定; 生物学特性
随着生活水平的提高,对蔬菜的需求量越来越大,且正向新鲜和安全的洁净蔬菜转变[1]。有“世界屋脊”之称的西藏自治区从20世纪80年代在拉萨城关区蔡公堂乡、堆龙德庆县及林芝地区等地新建温室或大棚进行设施蔬菜生产,极大地满足了当地人民对各种蔬菜的需求,蔬菜播种面积由1985年占农作物播种面积的1.61%提高到2011年的9.49%[2]。随着蔬菜种植年限的增长,根腐病发生越来越重,主要原因是温室大棚修建之后多年不移动,使用的土地相对固定,且在温室和大棚种植的蔬菜主要集中在茄科和葫芦科,轮作倒茬困难,使土壤中病原菌逐年积累;另一方面,农户对预防为主的防控策略重视不够,如在土壤消毒、无病土育苗及有机肥充分腐熟等方面做得不到位,没有彻底清洁温室环境,病残体随意处理,造成人为传播严重。设施蔬菜生产是农业增效、农民增收的重要途径之一,也是促进农牧区农业经济发展的重要措施之一。但根腐病成为制约设施蔬菜生产的主要问题之一,同时根腐病的发生对新种植户的积极性打击较大,对设施蔬菜的示范推广造成一定困难,也对市场蔬菜的供应产生了影响[3]。因此,2011年对西藏拉萨郊县和林芝等地区设施茄子生产地进行了根腐病调查,以期明确设施茄子镰孢根腐病菌的种类和发生程度,为综合防治提供依据,也为设施蔬菜的持续发展提供技术支撑。
1 材料和方法
1.1 供试材料
供试病原菌:分离自西藏自治区拉萨市城关区设施茄子根部的镰孢菌(Fusariumsp.)。
供试培养基[4]:PDA培养基和PSA培养基用于病原菌的分离和纯化;PS液体培养基用于病原菌DNA的提取。
1.2 试验方法
1.2.1 症状的描述及病原的分离与纯化
在西藏自治区拉萨市城关区蔡公堂乡对典型病株进行症状描述后采集病株带回实验室,按照常规组织分离法分离病原菌,在PSA培养基上进行培养与纯化,将纯化获得的菌株黑暗培养,待产孢后进行单孢分离[5],进一步纯化后移入PSA斜面培养保存备用。
1.2.2 致病性测定
在实验室采用根部接种法,将供试菌株用无菌水配制成孢子悬浮液(约 106个/mL),取约10 mL接种到健康茄子植株根围,以无菌水为对照,后连续观察植株的发病情况,形成典型症状后,对病原菌进行再分离,按柯赫氏法则确定病原菌。
1.2.3 不同温度对菌丝生长的影响
采用生长速率法。经活化的病原菌用0.5 cm直径的打孔器切取菌饼,接种到PSA平板中央,置于0、5、10、15、20、25、30、35和40 ℃下培养, 5次重复,5 d后用十字交叉法测量菌落直径,所得数据用Excel软件作图。
1.2.4 不同碳氮源对菌丝生长的影响
将病原菌接种于含1%的碳源(葡萄糖、乳糖、D-树胶醛糖、麦芽糖、氯醛糖、D-半乳糖、蔗糖、可溶性淀粉、甘露糖、D-木糖、D-果糖)和含0.25%氮源(氯化铵、硝酸铵、碳酸铵、硝酸钠、L-谷氨酸、尿素、大豆蛋白胨、L-组氨酸、 L-精氨酸、亮氨酸、蛋白胨、甘氨酸)的马铃薯琼脂培养基后置于最适温度下培养,分别以不加碳氮源的水琼脂为对照,5次重复,5 d后用十字交叉法测量菌落直径,所得数据用Excel软件作图。
1.2.5 病原菌的鉴定
1.2.5.1 形态学鉴定
将经致病性测定的病原菌培养产孢后,在显微镜(10倍×40倍)下观察分生孢子梗和分生孢子特征,测定100个分生孢子大小,并显微拍照。根据病原形态、大小,查阅相关资料[6-8],确定属种。
1.2.5.2 基因序列分析鉴定
病原菌经活化培养后取50~100 mg新鲜菌丝,液氮中充分研磨成粉末,采用上海生工生物工程技术服务有限公司的UNIQ-10柱式真菌基因组DNA抽提试剂盒提取病原菌基因组DNA。选取由上海生工生物工程有限公司合成的通用引物ITS1(5′-TCC GTA GGT GAA CCT GCG G-3′)和ITS4(5′-TCC TCC GCT TAT TGA TAT GC-3′)进行PCR扩增;扩增体系为50 μL,即10×PCR buffer 5.0 μL,TaqDNA聚合酶(2 U/μL)1.2 μL,ITS1 (10 mmol/L)2.0 μL,ITS4 (10 mmol/L)2.0 μL,dNTPs (10 mmol/L)3.0 μL,DNA模板(10 ng/μL)2.0 μL (以加2.0 μL ddH2O为阴性对照),ddH2O 34.8 μL;扩增程序为95 ℃预变性3 min;94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸1.5 min,30 个循环;72 ℃终延伸10 min。将具特异性条带的PCR产物送上海生工生物工程有限公司测序;所测序列提交到GenBank数据库进行相似性比较,并与GenBank中的相似序列在Claustal 1.8程序包中进行多重序列匹配排列分析,最后形成一个多序列匹配排列阵,用MEGA 4.0程序包中的Neighbor-Joining法构建系统发育树,明确其系统发育地位。
2 结果与分析
2.1 症状描述
茄子发病后,初期表现为叶片变黄,生长缓慢,后下部叶片萎蔫下垂,植株茎基部或根部表皮逐渐腐烂,并与木质部分离,最后整个植株萎蔫枯死,潮湿时发病部位有白色霉层。
2.2 病原的分离和致病性测定
利用常规分离方法获得6株镰孢霉属真菌,经室内接种只有1株可以引起典型症状,并从发病植株上再次分离到了所接种的菌株,表明该镰孢霉菌即为茄子镰孢根腐病的病原菌。
2.3 病原鉴定
2.3.1 形态学鉴定
从拉萨市城关区分离的茄子镰孢根腐病的病原菌菌落白色,均匀隆起,绒状,较厚,菌背白色;菌丝无色,有隔,直径1.2~3.5 μm,有球状膨大体;大型分生孢子马特型,稍弯曲,隔膜不清晰(图1),大小(18.8~23.5)μm×(2.4~2.9)μm;小型分生孢子短杆状,两端圆,较多,大小(5.9~11.8)(8.2)μm×(1.4~2.4)(1.8)μm;产孢梗单瓶梗,大小(9.4~37.6)(17.9)μm×(1.8~2.9)(2.1)μm。根据其形态特征鉴定其为镰孢属真菌Fusariumsp.,种待定。
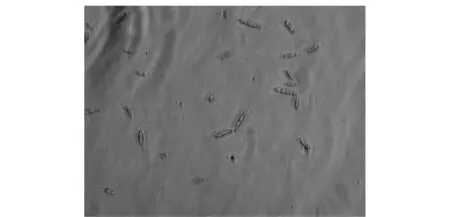
图1 茄子镰孢根腐病菌的大型分生孢子Fig.1 The macroconidia of eggplant Fusarium rot
2.3.2 病原ITS鉴定
经PCR扩增和测序,病原菌rDNA-ITS的碱基长度为563 bp,在系统发育树中,茄子镰孢根腐病病原菌与GenBank中层出镰孢菌(Fusariumproliferatum)(FJ040179)聚在一起(图2),且相似性在99%以上,结合形态特征鉴定其为层出镰孢菌(F.proliferatum)。
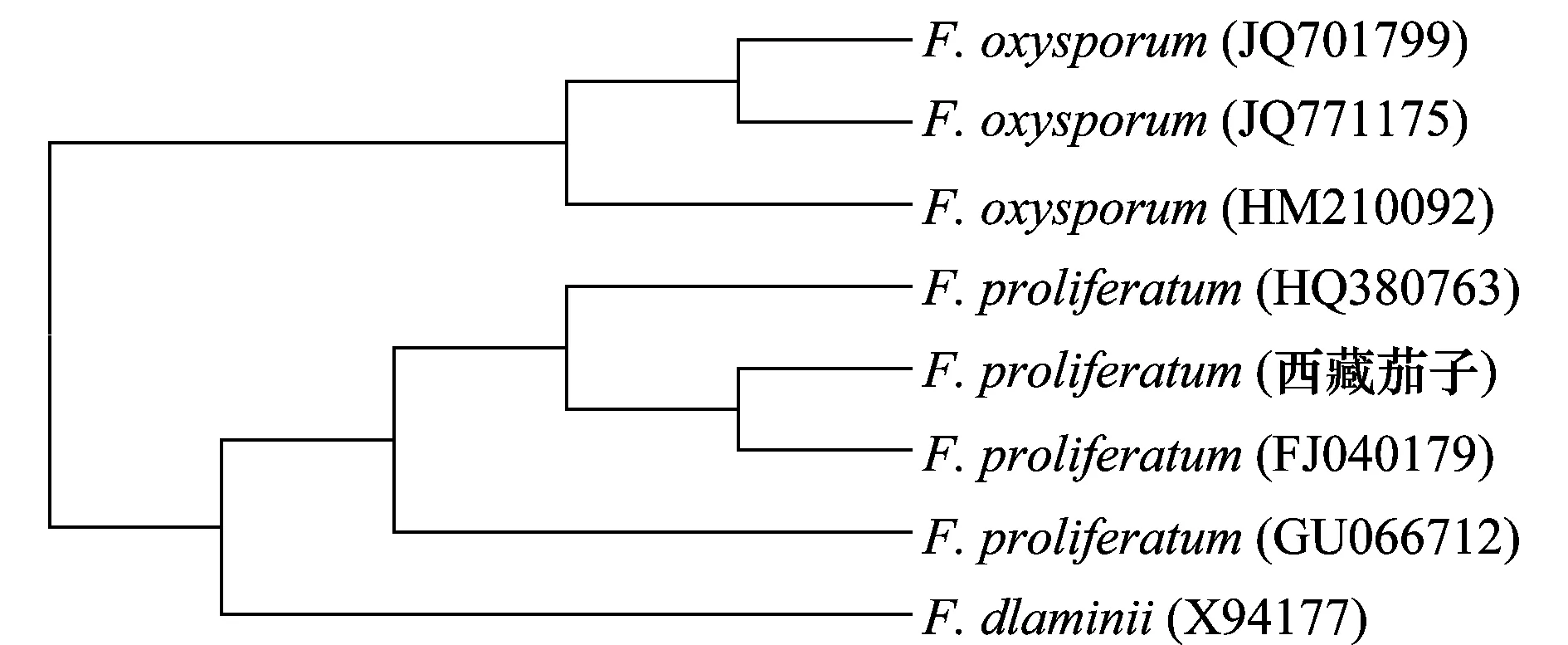
图2 茄子根腐病菌的系统发育树Fig.2 The phylogenetic tree of Fusarium proliferatum
2.4 病原生物学及培养性状测定
2.4.1 生长温度测定
图3表明,茄子层出镰孢菌在10~40 ℃均可生长,适宜温度为25~35 ℃,最适温度为30 ℃。
2.4.2 碳源利用能力测定
图4表明,茄子层出镰孢菌对供试的11种碳源均可利用,在以乳糖为碳源的培养基上生长最慢,菌落直径只大于水琼脂对照1.1 cm;在以D-树胶醛糖和甘露糖为碳源的培养基上生长最快,菌落直径大于对照(水琼脂)2.7 cm;在其他供试碳源上生长速率差异不明显,但菌落直径均大于水琼脂培养基上的菌落直径。

图3 温度对茄子层出镰孢菌菌丝生长的影响Fig.3 The effect of temperature on mycelium growth of Fusarium proliferatum
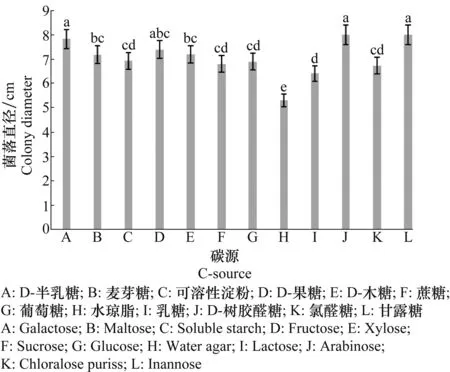
图4 碳源对茄子层出镰孢菌菌丝生长的影响Fig.4 The effect of C-source on mycelium growth of Fusarium proliferatum
2.4.3 氮源利用能力测定
图5表明,茄子层出镰孢菌对供试的12种氮源均可利用,在以碳酸铵、L-谷氨酸为氮源的培养基上生长最慢,菌落直径小于水琼脂对照2.3~4.0 cm;在以氯化铵、硝酸铵、硝酸钠、大豆蛋白胨、亮氨酸和蛋白胨为氮源的培养基上生长速率差异不大,但均高于水琼脂对照,说明这些供试氮源对该病原菌有促进作用。
3 结论与讨论
镰孢菌(Fusariumspp.)因其在无性阶段产生的大型分生孢子形似镰刀而得名。1809年Link首先从锦葵科植物上发现第一株镰孢菌,定名为粉红镰孢菌(F.roseumLink)。镰孢菌种类多,迄今已发现40余种,普遍存在于土壤及动植物有机体内,其中不少是导致多种农林植物病害的病原菌。镰孢菌的分类鉴定是一项十分复杂的工作,一般植物病原真菌主要依据营养体和子实体进行鉴定[9-10],但是,大部分镰孢菌形态相似,且一些镰孢菌的产孢条件难于摸索[11],利用镰孢菌形态特征在种水平上进行鉴定并非易事。近年研究表明真菌rDNA的ITS 区段既具保守性,又在科、属、种水平上均有特异性,因此,常常将这一可变区作为真菌种和分离物鉴定的可靠依据之一[12-13],如Volossiouk[14]根据 ITS序列设计合成的引物ITS-Fu-f和ITS-Fu-r在棉花枯萎病菌(F.oxysporumf.sp.vasinfectum)的专化性和灵敏度方面做了深入研究。本研究采用形态学和分子鉴定相结合的方法,将致病菌鉴定为层出镰孢菌(Fusariumproliferatum),该菌有侵染玉米的报道[15],但侵染茄子为首次报道。

图5 氮源对茄子层出镰孢菌菌丝生长的影响Fig.5 The effect of N-source on mycelium growth of Fusarium proliferatum
该病原菌生物学特性研究表明,病原菌生长最适温为30 ℃,能够在10~40 ℃条件下生长,温度过高或过低对菌丝生长均不利;在供试的所有碳源中,最佳碳源是树胶醛糖和甘露糖;氯化铵、硝酸铵、硝酸钠、大豆蛋白胨、亮氨酸和蛋白胨等氮源对菌丝生长有促进作用,但差异不显著,碳酸铵、谷氨酸可抑制
该病原菌的生长。本试验较全面地研究了西藏设施茄子镰孢根腐病的症状和病原的培养性状及生物学特性等,且利用ITS序列分析对其进行了鉴定,为西藏设施茄子根腐病的诊断和综合防治提供依据。
[1] 江舰,闫晓明,尤逢惠.安徽省蔬菜贮藏加工业发展现状·存在问题及对策[J].安徽农业科学,2011,39(36):22597-22598.
[2] 依斯麻,李芳,代安国,等.西藏蔬菜产业化发展现状及发展对策[J].西藏科技,2011(8):20-22.
[3] 张淑莲,陈志杰,张锋,等.陕西棚室蔬菜根病发生为害现状及防治技术[J].中国植保导刊,2007,27(3):16-17.
[4] 陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社,1995:429-525.
[5] 龚国淑,徐琴,张敏,等.一种简便的病原真菌单孢分离方法研究[J].玉米科学,2010,18(1):126-134.
[6] 戴芳澜.中国真菌总汇[M].北京:科学出版社,1979.
[7] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[8] 王拱辰.常见镰刀菌鉴定指南[M].北京:中国农业出版社,1996:22-34.
[9] 陈剑山,郑服丛.ITS序列分析在真菌分类鉴定中的应用[J].安徽农业科学,2007,35(13):3785-3786.
[10]刘盼红. 贮藏苹果中展青霉素产生菌的分离鉴定和生长代谢特征研究[D].杨凌:西北农林科技大学,2008:2-3.
[11]Bonants P, Weerdt M H, Lacourt I, et al. Detection and identification ofPhytophthorafragariaeHickman by the polymerase chain reaction [J].European Journal of Plant Pathology,1997,103: 345-355.
[12]Abd-Elsalam K A, Aly I N, Abdel-Satar M A.PCR identification ofFusariumgenus based on nuclear ribosomal-DNA sequence data [J].African Journal of Biotechnology, 2003,2 (4):82-85.
[13]匡治州,许杨. 核糖体rDNA ITS序列在真菌学研究中的应用[J].生命的化学,2004,24(2):120-122.
[14]Volossiouk T, Robb E J,Nazar R N.Direct DNA extraction for PCR-mediated assays of soil organisms [J]. Applied and Enviromental Microbiololgy,1995, 61 (11):3972-3976.
[15]陈璐,高增贵,庄敬华,等. 玉米顶腐镰孢菌rDNA-ITS和EF-la基因序列及UP-PCR遗传多样性分析[J].沈阳农业大学学报,201l,42(1):31-36.
(责任编辑:杨明丽)
Isolation and identification of the pathogen of eggplant root rot in Tibet Autonomous Region
Yang Chengde1, Wang Zhen1, Dai Wan’an2, Hao Rongrong1, Liu Xingang1, Yang Jie2
(1. College of Prataculture, Gansu Agricultural University; Key Laboratory of Grassland Ecosystem, Ministry of Education;Pratacultural Engineering Laboratory of Gansu Province; Sino-U.S.Center for Grazingland Ecosystem Sustainability, Lanzhou 730070, China; 2. Institute of Vegetables, Tibetan Institute of Agriculture and Animal Husbandry, Lhasa 850032, China)
The symptoms and pathogen of eggplant root rot were studied. The results showed that the symptom was rot of roots or stems, and then the plants wilted. Based on morphological characteristics and ITS sequence analysis, the pathogenic fungus was identified asFusariumproliferatum. The optimum growth temperature was 30 ℃. The optimum carbon source were arabinose and mannose, and the optimum nitrogen source was sodium nitrate. This study provided a foundation for controlling the disease.
eggplant root rot; identification; biological characteristics
2014-03-17
2014-05-12
西藏自治区科技厅重点科研项目(2012年)
S 436.41
A
10.3969/j.issn.0529-1542.2015.03.024
联系方式 E-mail: yangcd@gsau.edu.cn
