利用四唑盐染料WST反映巨噬细胞受脂多糖刺激活化后的氧化应激和代谢变化
2015-11-25鞠瑞陈玮陈晨郭磊李娟叶菜英张德昌
鞠瑞,陈玮,陈晨,郭磊,李娟,叶菜英,张德昌
利用四唑盐染料WST反映巨噬细胞受脂多糖刺激活化后的氧化应激和代谢变化
鞠瑞,陈玮,陈晨,郭磊,李娟,叶菜英,张德昌
目的 通过四唑盐染料显色方法分析巨噬细胞受脂多糖刺激后的氧化应激和代谢变化,分析这种方法在炎症研究中的应用价值。
方法 通过活细胞计数方法和 CCK-8 检测试剂分别检测RAW264.7 巨噬细胞的活力;用 CCK-8 和 WST-1 显色方法研究超氧阴离子的释放;用 DCFH-DA 荧光染色和流式细胞术检测细胞内活性氧的生成;用乳酸检测试剂盒和烟酰胺腺嘌呤二核苷酸 NAD+(H) 检测试剂盒分别检测上清中乳酸和细胞内 NADH 的含量。
结果 经脂多糖刺激的 RAW264.7 细胞的活细胞计数结果和 CCK-8 显色结果存在反差;相同数目的正常培养细胞和脂多糖刺激细胞的 CCK-8 显色比较,后者读数显著升高,超氧化物歧化酶能够下调 CCK-8 显色读数,WST-1 显色结果与 CCK-8 一致,脂多糖刺激细胞中的活性氧含量显著增加;脂多糖导致 RAW264.7 细胞上清中的乳酸含量和细胞内的 NADH 含量显著增加。
结论 应用 WST 染料测定经脂多糖刺激的 RAW264.7细胞活力时,测定结果会受到细胞中还原性物质——超氧阴离子和 NADH含量变化的干扰。通过 WST-1 或 WST-8显色实验,可验证脂多糖能够刺激 RAW264.7 巨噬细胞发生氧化应激和能量代谢变化。这一显色实验在炎症研究和药物筛选中可能有重要应用价值。
脂多糖类; 氧化性应激; 能量代谢; 四唑盐染料
四唑盐是一种被广泛用于细胞活性、细胞代谢和超氧化物检测的重要试剂。噻唑蓝(MTT)是检测细胞活性的常规试剂之一,其检测原理是大部分MTT 可被细胞内还原型的吡啶核苷酸——辅酶烟酰胺腺嘌呤二核苷酸(NADH)还原,从而间接反映细胞活力。近年来,第二代四唑盐——水溶性四唑盐(WST)得到广泛应用。与 MTT 相比,WST (WST-1 或 WST-8)主要有两个特点,一是不可通过细胞膜,二是被还原生成的甲瓒为水溶性物质。其中 WST-1 是 WST 系列的第一个四唑盐试剂,WST-8 相比 WST-1 更加稳定,灵敏度更高,溶解性更强。由于 WST 不可通过细胞膜,如果在没有中间电子载体 1-甲氧基-5-甲基酚嗪硫酸甲酯盐(1-mPMS)的情况下显色,则是因为被释放至细胞外的超氧阴离子还原,可反映细胞超氧阴离子的释放和呼吸爆发情况;如果在 1-mPMS 存在的情况下显色,不仅反映超氧阴离子的生成,还可能是通过 1-mPMS 接受了细胞膜上的跨膜电子,可以反映细胞内 NADH 生成的情况[1-2]。NADH 的含量变化以及 NAD+/NADH 比值的变化是细胞代谢变化的重要指标,可反映线粒体三羧酸循环和电子传递链活性的改变[3]。
脂多糖(LPS)可以刺激巨噬细胞的经典活化,引发强烈的炎症反应,释放大量的炎症细胞因子。Check 等[4]采用高铁细胞色素 c 还原的方法进行检测表明,RAW264.7 巨噬细胞经 LPS 刺激后,细胞膜上的 NADPH 氧化酶活性显著升高,释放的超氧阴离子增多。
在 LPS 刺激巨噬细胞炎症反应的过程中,细胞能量代谢的变化参与其中,并发挥重要作用。LPS会促进巨噬细胞利用糖酵解进行能量代谢,其原因之一是 LPS 引起巨噬细胞线粒体功能损伤,这一代谢变化伴随着 NADH 的聚积和 NADH/NAD+的比值升高。糖酵解抑制剂 2-脱氧葡萄糖(2-DG)能够抑制 LPS 引起的 IL-1β 和 TNF-α 的生成,显示了糖酵解代谢在炎症反应中的重要作用[5]。
我们在检测 LPS 刺激 RAW264.7 细胞后的细胞活力时发现,以 WST-8 为主要成分的 CCK-8细胞计数试剂盒的检测结果和活细胞镜下计数结果存在差异。我们对经 LPS 刺激后 RAW264.7 细胞超氧阴离子产生及 NADH 含量进行检测。结果显示,WST 在这一实验体系中的还原可能是 LPS促进巨噬细胞氧化应激和代谢改变(NADH 增加)导致的。由于氧化应激和糖酵解增加是炎症反应的重要环节,因此我们认为,WST 与其中间电子载体 1-mPMS 可能会在抗炎药物筛选方面有重要应用。
1 材料与方法
1.1 材料
1.1.1 细胞系 RAW264.7 巨噬细胞购自中国医学科学院基础医学研究所细胞中心,用DMEM 高糖培养基(加入 10% 胎牛血清、1% 谷氨酰胺、50 mg/ml 青霉素和 100 mg/ml 链霉素)在 37 ℃、5% CO2环境中培养。
1.1.2 试剂 LPS、台盼蓝购自美国 Sigma 公司;L-乳酸检测试剂盒购自德国 R-Biopharm 公司;WST-1、WST-8 试剂(CCK-8)购自同仁化学公司;活性氧检测试剂盒购自碧云天生物技术公司;NAD+(H) 浓度测定试剂盒购自美国 Bioassay Systems 公司。
1.2 方法
1.2.1 细胞台盼蓝染色计数 收集处于对数生长期的 RAW264.7 细胞接种于 24 孔板中,2 × 105个/孔。将细胞分两组处理:一组为对照组,以正常培养基培养;另一组为 LPS 组,以含 100 ng/ml LPS 的培养基培养。每组 3 复孔。培养 4、12、24 h后消化收集各孔细胞。将细胞悬液以 1000 r/min 离心 5 min 后,以 1 ml PBS 重悬细胞。将 90 μl 细胞悬液与 10 μl 0.5% 台盼蓝染液混匀。在光学显微镜下进行活细胞计数。
1.2.2 CCK-8检测 收集处于对数生长期的RAW264.7 细胞接种于 24 孔板中,2 × 105个/孔。将细胞分两组处理:一组为对照组,以正常培养基培养;另一组为 LPS 组,以含 100 ng/ml LPS 的培养基培养。每组 3 复孔。培养 4、12、24 h 后,吸弃各孔上清,每孔加入 500 μl PBS 及 50 μl WST-8 试剂,混匀。设置空白孔,为不含细胞的500 μl PBS及 50 μl WST-8 试剂。放置在培养箱中培养 2 h,每孔上清摇匀,将每孔 200 μl 上清加入至 96 孔板中,每组 4 复孔。测定 450 nm 处吸光度。
1.2.3 WST-1检测 收集处于对数生长期的RAW264.7 细胞接种于中皿中,1 × 106个/皿。将细胞分两组处理:一组为对照组,以正常培养基培养;另一组为 LPS 组,以含 100 ng/ml LPS 的培养基培养。培养 24 h 后,将两组细胞分别消化,用HBSS 重悬调整成为 1 × 106个/ml。然后将细胞悬液加入至 96 孔板中,160 μl/孔。再向每孔中加入20 μl HBSS 及 20 μl WST-1(5 mmol/L,10 ×)溶液或 CCK-8 试剂。混匀后放置 37 ℃ 孵育 30 min后测定 450 nm 吸光度。
1.2.4 细胞内 ROS 检测 收集处于对数生长期的 RAW264.7 细胞接种于中皿中,1 × 106个/皿。将细胞分两组处理:一组为对照组,以正常培养基培养;另一组为 LPS 组,以含 100 ng/ml LPS 的培养基培养。培养 24 h 后,将两组细胞分别消化,重悬于稀释好的 DCFH-DA(10 μmol/L),调细胞悬液密度为 1 × 106个/ml。混匀后放置 37 ℃ 孵育 30 min,然后用无血清培养基洗涤细胞 3 次,进行流式细胞术检测。
1.2.5 细胞上清中乳酸含量检测 收集处于对数生长期的 RAW264.7 细胞接种于 24 孔板中,2 × 105个/孔。将细胞分两组处理:一组为对照组,以正常培养基培养;另一组为 LPS 组,以含 100 ng/ml LPS 的培养基培养。每组 3 复孔。培养 24 h 后,收集各孔细胞的培养上清,按照 L-乳酸检测试剂盒的说明步骤对乳酸含量进行测定。
1.2.6 细胞内 NADH 含量检测 收集处于对数生长期的 RAW264.7 细胞接种于大皿中,1 × 107个/皿。将细胞分两组处理:一组为对照组,以正常培养基培养;另一组为 LPS 组,以含 100 ng/ml LPS 的培养基培养。培养 24 h 后,消化收集细胞,按照 NADH 浓度测定试剂盒的说明步骤对NADH 浓度进行测定。
1.3 统计学处理
应用 SPSS 13.0 软件进行数据处理,对照组与诱导组检测结果比较采用 Student's t 检验,以 P <0.05 为有统计学意义的差异。
2 结果
2.1 CCK-8 检测经 LPS 刺激的 RAW264.7 细胞活力受到其他因素干扰
通过显微镜观察发现,经 LPS 刺激的RAW264.7 细胞相比对照组体积变大,数目减少。用台盼蓝染色的方法对活细胞进行计数,发现 LPS处理 24 h 后细胞数目显著减少(图 1A),与镜下观察一致。用 CCK-8 试剂对细胞活力进行检测,LPS 组的 OD450自诱导 4 h 开始便显著高于对照组(图 1B)。因此在这一实验条件下,CCK-8 的显色结果与细胞活力变化不一致。
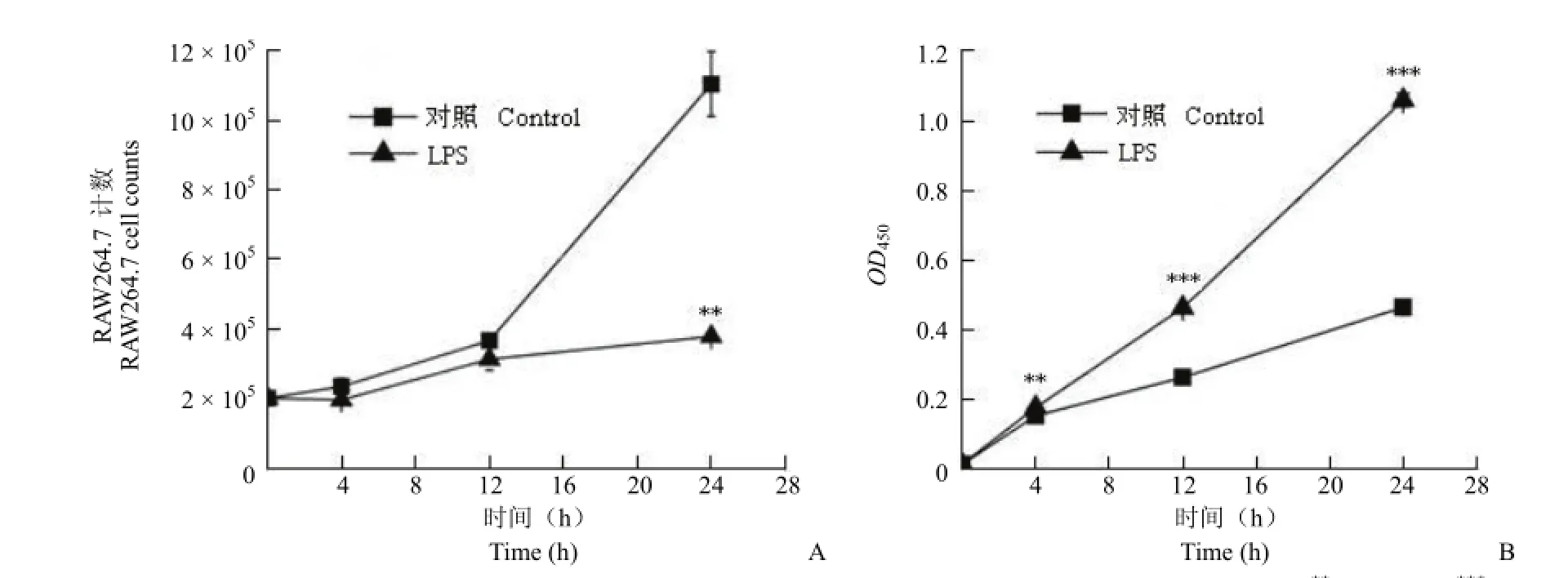
图1 正常培养和 LPS 刺激的 RAW264.7 细胞 24 h 内活细胞计数(A)和 CCK-8 检测结果(B)(**P < 0.01,***P < 0.001)Figure 1 Live cell counts (A) and CCK-8 absorbance at 450 nm (B) of RAW264.7 macrophages in control and LPS groups during 24 h (**P < 0.01,***P < 0.001)
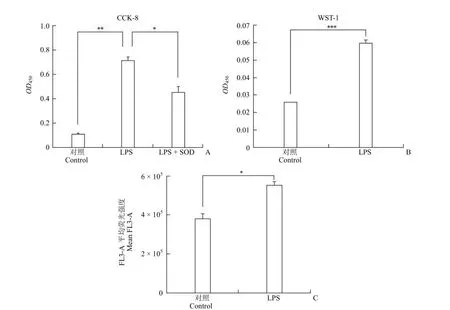
图2 LPS 刺激引起 RAW264.7 细胞的氧化应激(A、B:正常培养和 LPS 刺激的 RAW264.7 细胞调整为相同数目后的CCK-8 和 WST-1 显色差异;C:RAW264.7 细胞中活性氧含量改变;*P < 0.05,**P < 0.01,***P < 0.001)Figure 2 Oxidative stress elicited in RAW264.7 macrophages by LPS (A and B: CCK-8 and WST-1 tests of same amounts of RAW264.7 macrophages in control and LPS groups; C: Reactive oxygen species in RAW264.7 macrophages in control and LPS groups;*P < 0.05,**P < 0.01,***P < 0.001)
将正常培养和经过 LPS 刺激 24 h 的RAW264.7 细胞调成相同的密度,然后加入至96 孔板中。向各孔细胞中加入 CCK-8 或 WST-1试剂。30 min 后 OD450检测结果显示,LPS 组细胞的 CCK-8 读数相比正常对照组显著升高,而在LPS 组细胞中加入超氧化物歧化酶(SOD)后,OD450读数显著降低(图 2A)。LPS 组细胞的WST-1 读数相比正常对照组也显著升高(图 2B)。WST-1 反应体系与 CCK-8 反应体系相比,不含有中间电子载体 1-mPMS,因此 WST-1 无法被跨膜电子还原,其读数升高反映的是被释放至胞外的超氧阴离子增加。为验证 CCK-8 或 WST-1 检测的氧化应激结果,我们用 DCFH-DA 对胞内活性氧进行检测,发现 LPS 可显著增加 RAW264.7 细胞中活性氧的含量(图 2C)。因此,经 LPS 刺激的RAW264.7 细胞 CCK-8 读数升高部分归因于细胞超氧阴离子的生成增加。
2.3 LPS 显著增加 RAW264.7 细胞乳酸生成和NADH 含量
CCK-8 试剂中的 WST-8 通过中间电子载体1-mPMS 接受来自细胞膜上的电子,这些电子主要来自细胞内的 NADH。胞内 NADH 可通过细胞膜上的 NADH 氧化酶将电子传递给氧气,生成超氧阴离子,进而还原 WST-8,也可以通过细胞膜上的泛醌循环将电子传递给 1-mPMS,进而还原WST-8。因此,在 1-mPMS 存在的情况下,CCK-8读数的升高不仅可反映 NADH 氧化酶活性升高和氧化应激,还可能反映细胞内 NADH 含量升高。
以 LPS 刺激 RAW264.7 细胞 24 h,培养上清中的酚红指示上清明显酸化。经过测定,发现 LPS处理组的乳酸含量相比对照组显著升高(图 3A),显示 LPS 促进 RAW264.7 巨噬细胞通过糖酵解途径进行代谢。这一结果提示 LPS 对线粒体能量代谢有干扰并可能促进线粒体内 NADH 蓄积。对RAW264.7 细胞内的 NADH 含量进行测定,结果显示 LPS 显著增加 RAW264.7 细胞内 NADH的含量(图 3B)。因此,经 LPS 刺激的 RAW264.7细胞 CCK-8 读数升高的另一部分原因可能是细胞内 NADH 含量的增加,可能反映了细胞能量代谢的变化。
3 讨论
四唑盐显色方法是检测细胞增殖和活力的常用方法,其染料吸光度与活细胞数目有着很好的相关性。但是在某些实验体系中,如用于 LPS 刺激的巨噬细胞检测时,其检测结果会受到明显的干扰。根据第二代四唑盐——不可通过细胞膜的WST 染料的检测原理,其检测结果反映的是细胞超氧阴离子产生和代谢方面的变化[1-2, 6-9]。
具体说来,在没有其中间电子载体 1-mPMS存在时,WST-1 可直接用于胞外超氧阴离子的检测,其检测性能优于高铁细胞色素 c[8];在电子载体 1-mPMS 存在的情况下,WST-1 还可能反映细胞内 NADH 的含量。对细胞代谢有显著影响的药物,如减少 NADH 消耗的 rotenone、azide 等药物能够促进 WST-1 的还原;而能够减少糖酵解NADH 生成的 2-脱氧葡萄糖,则显著抑制 WST-1的还原[9]。在巨噬细胞炎症活化过程中,氧化应激是比较明确的现象,而能量代谢在其中的作用也被日益重视。因此,当细胞数没有显著变化,或者CCK-8 检测与细胞计数结果存在差异时,鉴于氧化应激和代谢变化在炎症活化中的重要作用,可以通过测定 WST 染料的还原来判断炎症的激活。
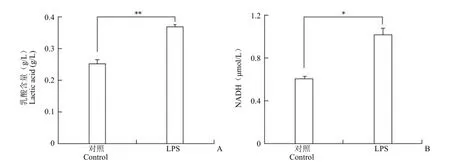
图3 LPS 刺激增加 RAW264.7 细胞培养上清中乳酸含量(A)和细胞内NADH含量(B)(*P < 0.05,**P < 0.01)Figure 3 Lactic acid in RAW264.7 culture medium (A) and intracellular NADH (B) were increased by LPS (*P < 0.05,**P < 0.01)
LPS 是刺激巨噬细胞经典活化的典型物质,能够导致线粒体功能损伤,并且显著增加糖酵解代谢。有报道指出小胶质细胞 BV-2 被 LPS 激活的炎症反应伴随着糖酵解代谢的增强[10]。糖酵解抑制剂 2-脱氧葡萄糖能够抑制 LPS 引起的巨噬细胞内 IL-1β 和 TNF-α 的生成,显示了糖酵解在 LPS刺激炎症活化过程中的重要参与[5]。
我们利用 CCK-8 的直接检测原理对 LPS 刺激的 RAW264.7 细胞进行检测,检测读数显著升高,与真实细胞活力不符。这一结果实际反映了LPS 引起的氧化应激,还可能会反映代谢变化。CCK-8 检测结果被 WST-1 显色、胞内活性氧检测及胞内 NADH 含量检测的结果证实。因此,WST染料在炎症活化的检测和抗炎药物的筛选方面可能会有重要应用价值。
[1]Berridge MV, Herst PM, Tan AS. Tetrazolium dyes as tools in cell biology: new insights into their cellular reduction. Biotechnol Annu Rev, 2005, 11:127-152.
[2]Kimura Y, Niki K. Electrochemical oxidation of nicotineamide-adenine dinucleotide (NADH) by modified pyrolytic graphite electrode. Anal Sci, 1985, 1(3):271-274.
[3]Fendt SM, Bell EL, Keibler MA, et al. Reductive glutamine metabolism is a function of the α-ketoglutarate to citrate ratio in cells. Nat Commun, 2013, 4:2236.
[4]Check J, Byrd CL, Menio J, et al. Src kinase participates in LPS-induced activation of NADPH oxidase. Mol Immunol, 2010,47(4):756-762.
[5]Tannahill GM, Curtis AM, Adamik J, et al. Succinate is an inflammatory signal that induces IL-1β through HIF-1α. Nature, 2013,496(7444):238-242.
[6]Ukeda H, Shimamura T, Tsubouchi M, et al. Spectrophotometric assay of superoxide anion formed in maillard reaction based on highly water-soluble tetrazolium salt. Anal Sci, 2002, 18(10):1151-1154.
[7]Xu C, Liu S, Liu Z, et al. Superoxide generated by pyrogallol reduces highly water-soluble tetrazolium salt to produce a soluble formazan: a simple assay for measuring superoxide anion radical scavenging activities of biological and abiological samples. Anal Chim Acta, 2013,793:53-60.
[8]Berridge MV, Tan AS. Superoxide produced by activated neutrophils efficiently reduces the tetrazolium salt, WST-1 to produce a soluble formazan: a simple colorimetric assay for measuring respiratory burst activation and for screening anti-inflammation agents. J Immunol Methods, 2000, 238(1-2):59-68.
[9]Tan AS, Berridge MV. Trans-plasma membrane electron transport: a cellular assay for NADH- and NADPH-oxidase based on extracellular,superoxide-mediated reduction of the sulfonated tetrazolium salt WST-1. Protoplasma, 1998, 205(1-4):74-82.
[10]Voloboueva LA, Emery JF, Sun X, et al. Inflammatory response of microglial BV-2 cells includes a glycolytic shift and is modulated by mitochondrial glucose-regulated protein 75/mortalin. FEBS lett, 2013,587(6):756-762.
Methods Viability of RAW264.7 macrophages were determined by trypan blue excluding test and CCK-8 test, respectively. Superoxide production was measured by CCK-8 or WST-1. Reactive oxygen species were measured by flow-cytometry with DCFH-DA. Lactic acid production and reduced form of nicotineamide adenine dinucleotide (NADH) concentration were also determined.
Results Inconsistent results of the LPS-stimulated RAW264.7 macrophages viability were obtained with trypan blue excluding test and CCK-8 assay. CCK-8 absorbance was significantly elevated in LPS-stimulated macrophages as compared to the same amount of macrophages cultured normally, which could be inhibited by superoxide dismutase (SOD). The result of WST-1 reduction was similar with CCK-8. Lactic acid in the culture medium, intracellular reactive oxygen species and NADH were all significantly increased by LPS.
Conclusion When being used to test the LPS-stimulated macrophages, WST tetrazolium salt reduction reflecting cell viability was significantly disturbed by the content of reduced substances including the superoxide and NADH. WST tetrazolium salt reduction test might be a useful tool in the inflammation research and the anti-inflammation drug screening.
Oxidative stress and metabolic changes in LPS-stimulated macrophages tested by WST tetrazolium salts
JU Rui, CHEN Wei, CHEN Chen, GUO Lei, LI Juan, YE Cai-ying, ZHANG De-chang
Objective To investigate the oxidative stress and metabolic changes in LPS-stimulated macrophages via the spectrophotometric assay based on WST tetrazolium salts, and analyze the application value of WST in inflammatory research.
Lipopolysaccharides; Oxidative stress; Energy metabolism; Tetrazolium salts
s: ZHANG De-chang, Email: zhangdechang45@vip.sina.com; YE Cai-ying, Email: caiyingye@126.com
10.3969/cmba.j.issn.1673-713X.2015.03.009
“十二五”国家科技重大专项(2014ZX09507003-003);国家自然科学基金(81201728);高等学校博士学科点专项科研基金新教师类(20121106120019)
100005 北京,中国医学科学院北京协和医学院基础医学研究所药理学系
张德昌,Email:zhangdechang45@vip.sina.com;叶菜英,Email:caiyingye@126.com
2015-01-08
www.cmbp.net.cn 中国医药生物技术, 2015, 10(3):242-247
Author Affiliation: Department of Pharmacology, Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100005, China
www.cmbp.net.cn Chin Med Biotechnol, 2015, 10(3):242-247
