流感疫苗的研究进展
2015-11-25秦添黄凤杰顾觉奋
秦添,黄凤杰,顾觉奋
流感疫苗的研究进展
秦添,黄凤杰,顾觉奋
流 感 病 毒 ( influenza virus) 是正 黏 病 毒 科(Orthomyxoviridae)的代表种,系 RNA 病毒,直径 80 ~ 120 nm,呈球形或丝状,其包膜上含有血凝素(HA)和神经氨酸酶(NA),从而形成了不同的亚型。人流感病毒分为甲(A)、乙(B)、丙(C)三型,是流行性感冒的病原体[1]。其特点是容易发生变异,其中甲型流感病毒最容易发生变异,可感染人和多种动物,为人类流感的主要病原,常引起大流行和中、小流行。例如,2009 年甲型 H1N1 流感在全球范围内的大流行造成了至少 1.2 万人死亡[2]。乙型流感病毒一般不会引起全球范围内的大流行,但是它能够引起地区性、季节性的流行。丙型流感病毒只会引起人类轻微的上呼吸道感染,极少造成流行。目前,预防人类流感致病和流行最有效的方法仍是接种疫苗。本文就近年来流感疫苗的研究进展作一概述。
1 流感病毒灭活疫苗
流感病毒灭活疫苗主要分为四类,包括全病毒灭活疫苗、裂解疫苗、亚单位疫苗以及病毒原质体疫苗(图 1)。
1.1 全病毒疫苗
全病毒疫苗即完整的病毒粒子,其包含病毒全部抗原和脂质外壳。将流感病毒接种于鸡胚尿囊腔中,两天后收获尿囊液,加入福尔马林使其灭活,然后采用离心或色谱的方法对尿囊液进行进一步的浓缩和纯化,得到病毒原液,最后加入适当的佐剂即为流感全病毒灭活疫苗。灭活疫苗免疫原性高且具有相对较低的生产成本,是目前最常用的方法。但这种方法对流感病毒进行分离或传代易引起其抗原性的改变,且批量化生产时易造成污染。近年来,使用非洲绿猴肾细胞(Vero 细胞)代替鸡胚成为流感疫苗生产的发展趋势。Vero细胞已成功开发出了多种疫苗,研究表明,以低感染复数接种 Vero 细胞时,亦可获得高产量的流感病毒,且当细胞维持液中胰酶浓度为 12.5 ~ 15 μg/ml,pH 为 7.4 ~ 7.6 时,可得到最大产量[3]。
尽管如此,灭活疫苗仍存在许多缺陷,主要表现在:灭活疫苗是一种死疫苗,失去了病毒的自然感染能力,皮下接种只能刺激机体产生相应的 IgG 抗体,无法刺激呼吸道黏膜产生分泌型免疫球蛋白 A(sIgA),故不能有效地阻止病毒在呼吸道内繁殖;由于流感病毒具有很高的变异性,故需要每年接种,这无疑增加了接种的痛苦和潜在的感染风险;其保护作用有限,交叉保护作用很弱;由于存在病毒膜脂质成分,具有较强的反应原性,在儿童中的发热率高,故不适用于 12 岁以下的儿童。
1.2 裂解疫苗
裂解型流感病毒灭活疫苗是采用合适的裂解剂和裂解条件将流感病毒裂解,去除核酸和大分子蛋白,只保留其抗原有效成分 HA 和 NA 以及部分基质蛋白(M 蛋白)和核蛋白(NP),然后进一步分离纯化制备而成。
1.3 亚单位疫苗
亚单位疫苗是在裂解疫苗的基础上开发出的一种新型疫苗,其只包含病毒的 HA 和 NA 抗原蛋白,其他基质蛋白均被去除。这类疫苗大大降低了副反应的发生,安全性较高,但相应的,免疫原性也大大削弱,常不能引起有效的免疫应答。
1.4 病毒原质体疫苗
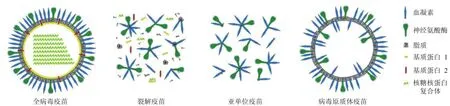
图1 流感病毒灭活疫苗示意图[1]
流感病毒中的基质蛋白是由高度保守的氨基酸残基组成的膜蛋白,与 HA 和 NA 的易变性形成了鲜明对比。Berthoud 等[4]设计制备出针对流感病毒 A 的核蛋白和基质蛋白 1(MVA-NP+M1)的新型疫苗,并进行了 I 期临床试验。该疫苗具有良好的安全性和耐受性,诱导产生的T 细胞数远高于目前市售的任何一种流感疫苗。
2 流感病毒减毒活疫苗
流感病毒减毒活疫苗(LAIV)是将病毒在人工培育的条件下,使其致病性大部分丧失,但仍保留其免疫原性,故仍可刺激机体免疫细胞产生抗体的一类疫苗。其和自然感染具有很大的相似性,克服了灭活疫苗对儿童和老人免疫原性低的不足,所以其诱导的免疫反应相比灭活疫苗更加迅速和强烈。与灭活疫苗相比,优势主要表现在:①能有效地控制流感病毒在呼吸道的繁殖;②可滴鼻或喷鼻途径给药;③对不同亚型的流感病毒具有一定的交叉保护作用。
LAIV 一般为经鼻接种的三价季节性疫苗,包括两种A 型(H1N1和 H3N2 亚型)和一种 B 型流感病毒[5]。LAIV在婴幼儿、儿童和成人中均具有良好的耐受性。LAIV 相对于三价灭活流感疫苗(TIV)显示出了更好的免疫效果,在许多国家 6 ~ 59 个月的婴幼儿和儿童中已进入了 III 期临床试验。而在成人中,这种优势却不明显,故欧洲健康署还未批准其应用于成人[6]。目前,应用比较广泛的 LAIV 为冷适应性疫苗,通常由基因重组的方法获得。Kiseleva 等[7]研究表明,重组病毒并不会具有更强的毒力或产生更强的损伤作用,这为 LAIV 的安全应用提供了额外的依据。此外,一些单价 LAIV 可对多种病毒亚型起作用,如有研究表明,H7N3 减毒流感疫苗亦可预防 H7N9 禽流感病毒的感染[8]。
3 基因工程疫苗
流感病毒基因工程疫苗即使用 DNA 重组技术,将天然或人工合成的病毒遗传物质定向插入细菌、酵母菌或哺乳动物细胞中,使之充分表达,再经纯化而制得的疫苗。由于病毒主要的免疫学结构为 HA,其含有大多数的抗原决定簇,所以采用基因工程的方法直接合成 HA 为制备流感疫苗提供了新思路。
长期以来,人们认为流感疫苗生产中血凝素分子必须在脊椎动物细胞中表达,以实现蛋白质分子的折叠、糖基化和分泌。但随着研究的深入,这种说法已经不是很准确。美国疾控中心的一个实验室通过敲除 HA 的 N 端糖基化位点制得的 DNA 疫苗,将其免疫小鼠,结果发现其免疫原性并没有明显的变化[8]。随后,另外两个团队在 Escherichia coli 中也成功表达出了流感病毒 HA[9]。
美国蛋白质科学公司通过昆虫细胞病毒载体(杆状病毒群)感染昆虫(粘虫、草地贪夜蛾)细胞,成功制得了流感血凝素—— FluBlok,使用昆虫细胞表达外源基因越来越得到了人们的认可。一种上市的人类乳头瘤融合蛋白病毒疫苗—— Cervarix®即是使用的这种表达系统。FluBlok 是一种新型的蛋白疫苗,其包含三种全长的重组 HA 蛋白,即甲型 H1N1 流感病毒 HA、甲型 H3N2 流感病毒 HA 和乙型流感病毒 HA。FluBlok 是首个采用 DNA 重组技术生产的三价流感疫苗,相比于传统的鸡胚生产模式,其具有可大量制备、纯度高等特性。临床试验显示这种疫苗具有良好的耐受性和免疫原性。2013 年 1 月 16 日,美国 FDA 批准FluBlok 上市,用于预防 18 ~ 49 岁人群的季节性流感[10]。
美国 Novavax 公司采取与 FluBlok 相似的方法,通过杆状病毒载体感染昆虫细胞得到了一种病毒样微粒(virus-like particles,VLPs)。该微粒含有 HA、NA 和流感病毒基质蛋白。基质蛋白可使 HA 和 NA 牢固地结合在其上,从而构成一个 VLPs。这种微粒的优点在于能够利用树突状细胞微粒识别机制来摄取该粒子。
美国弗劳恩霍夫分子生物技术中心使用烟草花叶病毒载体在烟叶中表达出了 HA。将植株反向放置在容器中,然后向其中缓慢加入载体病毒 DNA 溶液,直到淹没叶片为止。在真空的环境下,叶片底部的气孔打开,将 DNA 吸入其中,从而得到表达。这种疫苗在 I 期临床试验中显示出了免疫原性[11]。加拿大 Medicago 公司使用农杆菌作为载体也取得了成功[12]。
4 核酸疫苗
4.1 DNA 疫苗
DNA 疫苗即把一个或多个编码抗原蛋白的基因克隆到真核表达载体上,再将此重组载体导入机体内,从而表达得到抗原蛋白,激活机体的免疫反应。相对于普通疫苗,DNA 疫苗有以下优点:质粒 DNA 稳定性较高;生产工艺简单,成本低;相对于减毒活疫苗,不具有感染的风险;一个质粒 DNA 可编码多种抗原蛋白;可诱导体液免疫和细胞免疫双重反应[13]。
目前,DNA 疫苗的主要给药方式仍是肌肉注射,这使得疫苗很难穿过细胞膜,仅有少量到达抗原呈递细胞(APC)而引起免疫反应,这无疑限制了 DNA 疫苗的应用。Zhao等[14]使用乳化分散法,将猪流感病毒 DNA 疫苗封装于聚乳酸-羟基乙酸共聚物(PLGA)微球中,测定了其免疫应答强度,结果显示,微球具有较高的封装率和稳定性,表达出的抗原蛋白具有良好的生物活性且表达持续时间长,明显提高了 DNA 疫苗的免疫效率。随后,其使用复合凝聚法将猪流感病毒 DNA 疫苗封装于壳聚糖纳米粒子中,亦取得了良好的效果[13]。
4.2 mRNA 疫苗
mRNA 疫苗作用机制与 DNA 疫苗相似,mRNA 疫苗经接种后,不需要转运到细胞核中而可以直接被翻译,从而延长了其半衰期。相比于 DNA 疫苗,mRNA 疫苗具有更高的抗原蛋白表达量,给药量可以得到更精确的控制,且可以降低整合到宿主基因组的风险。Petsch 等[15]通过优化mRNA 疫苗的 GC 含量和 UTR 序列,再将其整合到核酸精蛋白上,从而使 mRNA 免受 RNase 的降解,提高了其稳定性。有研究表明,流感 mRNA 疫苗对流感病毒感染的小鼠、雪貂和猪模型均具有良好的免疫效果[16]。

表1 通用流感疫苗的病毒靶点
5 通用流感疫苗
通用流感疫苗所采用的抗原蛋白通常有 HA、M(M1 和 M2)、NP 和 NA 蛋白。各种抗原的靶向位点、靶向功能和可能的保护机制如表 1 所示。目前,研究最多的是基于 M2、NP 和 M1 的通用流感疫苗。
5.1 基于 M2 的通用流感疫苗
M2(M2e)是一种小膜本体蛋白质,起到 pH 依赖的质子通道作用,在 HA的成熟加工和病毒基因组释放到细胞质的过程中必不可少[17]。然而,基于 M2 蛋白的疫苗免疫原性较弱,因此人们采用了许多方法以克服此缺点,如将M2 肽段整合到免疫原性强的载体蛋白上,或通过杆状病毒或哺乳动物细胞表达的蛋白质而得的 VLPs 进行递送[18]。
5.2 基于 NP 和 M1 蛋白的通用流感疫苗
甲型流感病毒中 NP 和 M1 蛋白的氨基酸序列相对保守,因为这些蛋白未暴露在病毒表面,主要引起细胞免疫应答,尤其是 CTL 应答[19]。在小鼠中,除了 CD8+CTLs外,NP 抗体还参与了基于 ADCC 的病毒清除作用[20]。然而,在人体中,抗 NP 抗体水平变化多样且很少通过三价灭活疫苗而增加,因此,NP Ab 介导的 ADCC 在人体异源亚型免疫中的保护作用尚不明朗[21]。
目前,人们采用基于载体或基于直链肽段的抗原递送方法来诱发人体有效的 CTL 应答。临床 I 期和 II 期试验使用改良的安卡拉疫苗病毒(MVA)表达 NP 和 M1 蛋白,结果表明,尽管过高剂量仍会引起一些不适,如恶心、呕吐等反应,但总体上 MVA-NP+M1 疫苗安全性较高[4]。另有研究使用从甲型和乙型流感病毒中分离出的多种病毒蛋白(HA、NP、M1),制成含有多种线性表位的重组蛋白,这种疫苗即使在高剂量下亦具有良好的耐受性,其产生的抗体可诱导 ADCC 作用,具体机制尚不清楚[22]。
6 流感疫苗佐剂
佐剂是一种非特异性免疫增强剂,与抗原共同使用时可增强机体对抗原的免疫应答或改变免疫应答类型。
6.1 铝胶佐剂
铝胶佐剂是目前使用最广泛且历史最悠久的流感疫苗佐剂,主要有氧化铝、氢氧化铝和磷酸铝三种形式。其中氢氧化铝具有安全性较好、不良反应少等特点,最为常用。Thueng-in 等[23]采用磷酸铝佐剂制作了毒株 NIBRG-14 的全病毒灭活疫苗,用来预防甲型 H5N1 流感,试验表明安全性较好且只需接种一剂即可产生免疫。
随着纳米科技的发展,纳米 Al(OH)3佐剂慢慢引起了人们的关注,其具有粒径小、比表面积大等特点,在增强佐剂活性的同时,又大大降低了副作用,不失为一个崭新而有前景的研究方向。
6.2 表面活性剂
MF59 是一种水包油乳剂,瑞士诺华公司已将其应用于TIV 中,其疫苗的净剂量未增加,但免疫原性得到了大大提高。AS03 也是一种水包油型乳剂,英国葛兰素史克公司将其用于 H1N1 流感疫苗 PandemrixTM中。GLA-SE 是一种稳定的水包油型纳米乳,作为 Toll 样受体(TLR)激动剂,法国赛诺菲巴斯德将其用在 Fluzone®中,实验表明它可以有效增强机体的保护性免疫[24]。
流感病毒灭活疫苗即使不加铝胶佐剂亦具有效力。在许多 TLR7 敲除的小鼠中,流感病毒灭活疫苗具有更高的效力,表明这种现象依赖于 TLR7 的信号转导[25]。流感病毒灭活疫苗中残留的病毒 RNA 可通过 TLR7 信号转导起到佐剂的作用。然而,此作用对于其他单链 RNA 病毒仍有很大争议,因为 TLR7 和 TLR8 的多态性并不能影响麻疹死疫苗的免疫应答[26]。
7 小结与展望
流感病毒是目前研究得最透彻的病毒之一,但因其具有极强的变异性,尤其是甲型流感病毒,给科研和治疗带来了极大的困难,至今仍没有创造出可完全杜绝流感发生和流行的疫苗或方法。近年来流感疫苗的研究飞速发展,一些新型疫苗技术也在流感疫苗的生产中得到了成功应用。新的疫苗给药方式如微粒介导透皮输送(PMED)系统等也显示出了广阔的应用前景,各种优化的疫苗组合方式,如佐剂在通用疫苗和 DNA 疫苗中的联合应用,成为了未来研究的主要趋势。理想的流感疫苗应该具有较大的温度适用范围,剂型简单便于管理,单一剂量能保护多种亚型的流感和能够起长期保护作用等特性。在新的形势下我们需加快流感疫苗及相关技术的研发,以应对未来更加复杂的流感疫情。
[1]Amorij JP, Huckriede A, Wilschut J, et al. Development of stable influenza vaccine powder formulations: challenges and possibilities. Pharm Res, 2008, 25(6):1256-1273.
[2]World Health Organization. Pandemic (H1N1) 2009. [2015-03-01]. http://www.who.int/csr/disease/swineflu/en/.
[3]Yin JW, Jiao L, Zhen ZG, et al. Preparation of influenza vaccine with vero cells. Chin J Biologicals, 2009, 22(10):986-989. (in Chinese)
殷建文, 焦龙, 甄祖刚, 等. Vero细胞制备流感病毒疫苗. 中国生物制品学杂志, 2009, 22(10):986-989.
[4]Berthoud TK, Hamill M, Lillie PJ, et al. Potent CD8+ T-cell immunogenicity in humans of a novel heterosubtypic influenza A vaccine, MVA-NP+M1. Clin Infect Dis, 2011, 52(1):1-7.
[5]Lanthier PA, Huston GE, Moquin A, et al. Live attenuated influenza vaccine (LAIV) impacts innate and adaptive immune responses. Vaccine, 2011, 29(44):7849-7856.
[6]Esposito S, Montinaro V, Groppali E, et al. Live attenuated intranasal influenza vaccine. Hum Vaccin Immunother, 2012, 8(1):76-80.
[7]Kiseleva I, Dubrovina I, Bazhenova E, et al. Possible outcomes of reassortment in vivo between wild type and live attenuated influenza vaccine strains. Vaccine, 2012, 30(51):7395-7399.
[8]Rudenko L, Isakova-Sivak I, Donina S. H7N3 live attenuated influenza vaccine has a potential to protect against new H7N9 avian influenza virus. Vaccine, 2013, 31(42):4702-4705.
[9]Khurana S, Verma S, Verma N, et al. Bacterial HA1 vaccine against pandemic H5N1 influenza virus: evidence of oligomerization,hemagglutination, and cross-protective immunity in ferrets. J Virol,2011, 85(3):1246-1256.
[10]U.S. Food and Drug Administration. FDA approves new seasonal influenza vaccine made using novel technology. [2015-03-01]. http:// www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm3358 91.htm.
[11]Shoji Y, Farrance CE, Bautista J, et al. A plant-based system for rapid production of influenza vaccine antigens. Influenza Other Respir Viruses, 2012, 6(3):204-210.
[12]Landry N, Ward BJ, Trépanier S, et al. Preclinical and clinical development of plant-made virus-like particle vaccine against avian H5N1 influenza. PLoS One, 2010, 5(12):e15559.
[13]Zhao K, Shi X, Zhao Y, et al. Preparation and immunological effectiveness of a swine influenza DNA vaccine encapsulated in chitosan nanoparticles. Vaccine, 2011, 29(47):8549-8556.
[14]Zhao K, Li GX, Jin YY, et al. Preparation and immunological effectiveness of a Swine influenza DNA vaccine encapsulated in PLGA microspheres. J Microencapsul, 2010, 27(2):178-186.
[15]Petsch B, Schnee M, Vogel AB, et al. Protective efficacy of in vitro synthesized, specific mRNA vaccines against influenza A virus infection. Nat Biotechnol, 2012, 30(12):1210-1216.
[16]Wong SS, Webby RJ. An mRNA vaccine for influenza. Nat Biotechnol, 2012, 30(12):1202-1204.
[17]Alvarez P, Zylberman V, Ghersi G, et al. Tandem repeats of the extracellular domain of Matrix 2 influenza protein exposed in Brucella lumazine synthase decameric carrier molecule induce protection in mice. Vaccine, 2013, 31(5):806-812.
[18]Baidu Encyclopedias Web. VLPs. [2014-03-05]http://baike.baidu.com/ link?url=jr6wuAFE70_BbAkzj5avIqezqnQ2hvVCn3RYDw_aw3uhd Da13RlVzGPzR2ihXMu-iUHdxe1eanIUXoEm8omcJq. (in Chinese)百度百科网. VLPs. [2014-03-05]http://baike.baidu.com/link?url= jr6wuAFE70_BbAkzj5avIqezqnQ2hvVCn3RYDw_aw3uhdDa13RlVz GPzR2ihXMu-iUHdxe1eanIUXoEm8omcJq.
[19]Tan PT, Khan AM, August JT. Highly conserved influenza a sequences as T cell epitopes-based vaccine targets to address the viral variability. Hum Vaccin, 2011, 7(4):402-409.
[20]Lamere MW, Moquin A, Lee FE, et al. Regulation of antinucleoprotein IgG by systemic vaccination and its effect on influenza virus clearance. J Virol, 2011, 85(10):5027-5035.
[21]Alexander J, Bilsel P, del Guercio MF, et al. Universal influenza DNA vaccine encoding conserved CD4+ T cell epitopes protects against lethal viral challenge in HLA-DR transgenic mice. Vaccine, 2010,28(3):664-672.
[22]Atsmon J, Kate-Ilovitz E, Shaikevich D, et al. Safety and immunogenicity of multimeric-001--a novel universal influenza vaccine. J Clin Immunol, 2012, 32(3):595-603.
[23]Thueng-in K, Maneewatch S, Srimanotea P, et al. Heterosubtypic immunity to influenza mediated by liposome adjuvanted H5N1 recombinant protein vaccines. Vaccine, 2010, 28(41):6765-6777.
[24]Coler RN, Baldwin SL, Shaverdian N, et al. A synthetic adjuvant to enhance and expand immune responses to influenza vaccines. PLoS One, 2010, 5(10):e13677.
[25]Koyama S, Aoshi T, Tanimoto T, et al. Plasmacytoid dendritic cells delineate immunogenicity of influenza vaccine subtypes. Sci Transl Med, 2010, 2(25):25ra24.
[26]Clifford HD, Yerkovich ST, Khoo SK, et al. Toll-like receptor 7 and 8 polymorphisms: associations with functional effects and cellular and antibody responses to measles virus and vaccine. Immunogenetics,2012, 64(3):219-228.
10.3969/cmba.j.issn.1673-713X.2015.03.013
210009 南京,中国药科大学生命科学与技术学院
黄凤杰,Email:hfj@cpu.edu.cn;顾觉奋,Email:yqyan1@ 126.com
2015-03-10
