BMP-2表达上调剂的筛选及其抗骨质疏松活性研究
2015-11-25李雪虹宫世强韩小婉司书毅王艳宏
李雪虹,宫世强,韩小婉,司书毅,王艳宏
BMP-2表达上调剂的筛选及其抗骨质疏松活性研究
李雪虹*,宫世强*,韩小婉,司书毅,王艳宏
目的 筛选上调骨形态发生蛋白 2(BMP-2)表达的新型小分子活性化合物,为研发抗骨质疏松药物提供先导化合物。方法 应用国家新药(微生物)筛选实验室前期建立的BMP-2 表达上调剂的高通量筛选模型,对化合物库中10 000 余个化合物进行筛选,以染料木素作为阳性对照;应用实时定量 PCR 和 Western blot 方法检测活性化合物对 U-2OS 细胞 BMP-2 mRNA 和蛋白表达水平的影响。在mRNA 水平考察了活性化合物对 Runx2 表达的影响,Western blot 法检测活性化合物对 Smad1/5/8 蛋白磷酸化水平的影响;用 PNPP 法检测碱性磷酸酶活性,验证活性化合物体外促进成骨细胞分化的作用。
骨质疏松; 高通量筛选; 骨形态发生蛋白质 2
随着我国步入老龄化社会,骨质疏松的发病率越来越高[1],研究和开发更为安全有效的防治骨质疏松药物已成为当今的研究热点。骨质疏松发病的本质是骨代谢的失衡,骨代谢包括骨形成与骨吸收,前者由成骨细胞主导,后者由破骨细胞主导。当破骨功能强于成骨功能,将导致骨质疏松的发生[2]。近年来的大量研究证明,增强成骨细胞的作用,改善骨质形成代谢,促进骨质的形成是治疗骨质疏松新的且更为重要的途径。
骨形态发生蛋白 2(BMP-2)是骨形成蛋白家族成员之一,主要通过 Smads 通路来调控细胞成骨分化,在成骨细胞分化过程中有着非常重要的作用。BMP-2 可以直接促进成骨细胞的分化[3],同时能够增加成骨细胞标志基因 OPN、Runx2、BSP、ALP 等的表达[4-5]。BMP-2 作为骨形成诱导因子可以成为骨质疏松治疗的重要靶点。
国家新药(微生物)筛选实验室在前期工作中成功构建了表达小鼠 bmP2 上游调控序列-荧光素酶报告基因的稳定转染细胞模型,并且证明其可以用于抗骨质疏松药物的筛选。本研究在此基础上,以 BMP-2 为靶点,对国家新药(微生物)筛选实验室化合物样品库进行筛选并对筛出的活性化合物进行体外抗骨质疏松活性研究。
1 材料与方法
1.1 材料
1.1.1 细胞株 人骨肉瘤细胞株 U-2OS 购于中国医学科学院基础医学研究所细胞中心;C3H10T1/2细胞由中国医学科学院医药生物技术研究所王真老师馈赠;表达小鼠 bmP2 上游调控序列-荧光素酶报告基因的稳定转染细胞株 BMP2-Luc MC3T3细胞,命名为 PMB,由本实验室前期工作构建。
1.1.2 抗体 小鼠抗 BMP-2 单克隆抗体购于美国 Sigma 公司;兔抗 GAPDH 单克隆抗体、HRP标记山羊抗兔二抗和 HRP 标记山羊抗小鼠二抗均购于北京中杉金桥生物技术公司;兔抗 Smad1/5/8多克隆抗体购于美国 Santa Cruz 公司;兔抗磷酸化Smad1/5/8 单克隆抗体购于美国 CST 公司。
1.1.3 试剂盒 单荧光素酶检测试剂盒购于美国 Promega 公司;蛋白质浓度测定试剂盒购于美国 Thermo 公司;实时定量 PCR 试剂盒购于瑞士Roche 公司。
1.1.4 主要仪器 Envision 荧光读板仪购于美国Perkin Elmer 公司;Mx3000 型实时定量 PCR 仪购于美国 Agilent 公司;Trans-Blot semi-DRY Transfer Cell 半干式膜转印仪和 AL050123 型PCR 仪均购于美国 Bio-Rad 公司。
1.2 方法
1.2.1 细胞培养 McCoy's 5A 培养基加入 10%胎牛血清(FBS)用于 U-2OS 细胞的培养;DMEM培养基在加入 10% FBS 基础上添加终浓度为1000 μg/ml 的 G418,用于稳定转染细胞 PMB 的培养;MEM 培养基加入 10% FBS 用于 C3H10T1/2细胞的培养。不同细胞加入相应培养基中,在 37 ℃、5% CO2条件下孵育,当细胞生长至汇合度 80% ~90% 时,按所需比例进行传代。
1.2.2 活性化合物筛选 化合物高通量筛选方法参见文献[6-7]。首先消化对数生长期的模型细胞PMB,按 5 × 104个/孔的密度接种至 96 孔板中。待细胞充分贴壁后,吸弃原有培养基,用 PBS 轻轻漂洗细胞 1 次,每孔加入 198 μl 不含血清的DMEM 培养基和 2 μl 待测样品,使初筛化合物的终浓度为 0.1 mg/ml,以 12.5 μmol/L 的染料木素为阳性对照,以与待测样品相同浓度的 DMSO 为空白对照。作用 24 h 后移去培养基,使用荧光读板仪测定荧光素酶活性。按如下公式计算待测样品荧光素酶活性的上调倍数:
上调倍数 = 待测样品组细胞荧光素酶活性/空白对照组细胞荧光素酶活性
将上调倍数 ≥ 1.60 的化合物确定为初筛活性化合物。
1.2.3 活性化合物量效关系的测定 将各活性化合物从 100 μmol/L 开始,倍比稀释,按每孔 150 μl加入细胞中,以无化合物的培养基作为空白对照,12.50 μmol/L 的染料木素作为阳性对照。孵育 24 h后用按 Promega 单荧光素酶检测试剂盒说明书所述方法处理细胞并检测萤火虫荧光素酶表达活性,分析量效关系,得出 EC50。
1.2.4 实时定量 PCR 法考察化合物对 U-2OS细胞目的基因 mRNA 水平的影响 以不同浓度的化合物(0、0.75、3、12.5、50 μmol/L)处理 U-2OS细胞 24 h,采用 TRIzol 试剂法提取细胞内的总RNA,然后按照 TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix 试剂盒的说明操作合成 cDNA。采用 Primer 5.0 软件设计引物,BMP-2 引物序列:上游:5' CGGACTGCGGTCT CCTAA 3',下游:5' GGAAGCAGCAACGCTAGAA G 3';Runx2 引物序列:上游:5' TATTGGTCCTAAG GGAGACATC 3',下游:5' TAAAGCGAATGGGCAT GTT 3';GAPDH 引物设计:上游:5' ACTTTGTGAA GCTCATTTCCTGGTA 3',下游:5' TTGCTGGGGCT GGTGGTCCA 3'。利用 FastStart Universal SYBR Green PCR Master(Rox)试剂盒进行实时定量 PCR反应,采用公式 2-ΔΔCt进行相对定量分析。
1.2.5 化合物对 U-2OS 细胞目的基因蛋白表达水平影响的检测 收集不同浓度活性化合物(0、0.75、3、12.5、50 μmol/L)作用 U-2OS 细胞 24 h,用细胞裂解液裂解细胞,提取总蛋白,用 BCA 试剂盒测定总蛋白浓度,用一定量的 ddH2O 和 5 ×蛋白样品缓冲液制成蛋白样品,进行 SDS-PAGE电泳,恒流 0.2 A,将蛋白以半干法转印至 PVDF膜,以 5% 脱脂奶粉封闭,继而 4 ℃ 孵育一抗过夜,以 TBST 洗膜 3 次后孵育二抗 1 h,洗膜后曝光显色,用 Image J 软件扫描蛋白条带,从而定量分析蛋白表达水平的变化。
1.2.6 碱性磷酸酶(ALP)活性检测 收集不同浓度活性化合物处理 12 d 的 C3H10T1/2 细胞,超声裂解细胞,收集蛋白,用 PNPP 法测得单位蛋白浓度下碱性磷酸酶的活性。
2 结果
2.1 活性化合物的筛选及其在 BMP-2 表达上调剂模型上的量效关系
用 BMP-2 表达上调剂模型对国家新药(微生物)筛选实验室化合物库 10 000 多个化合物进行高通量筛选,经过初筛、复筛后得到能够明显上调BMP-2 表达的潜力化合物 E19773,其结构如图 1所示。
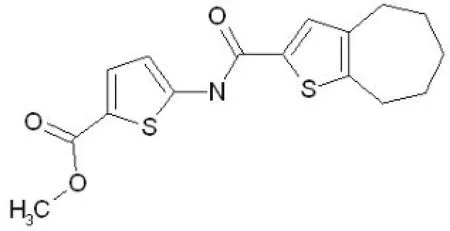
图1 化合物 E19773 的结构Figure 1 Structure of E19773
对 E19773 从 100 μmol/L 开始进行倍比稀释,作用 PMB 模型细胞,24 h 后检测各孔的荧光素酶表达活性,统计检测结果,用 GraphPad Prism 5.0 做出量效曲线图,并确定出化合物作用的最大上调倍数为 2.19 倍及半数有效浓度为 46.2 μmol/L(图 2)。

图2 化合物 E19773 在 PMB 模型上的量效关系Figure 2 Dose-response relation of compound E19773 on PMB model
2.2 活性化合物对 U-2OS 细胞 BMP-2 和 Runx2 mRNA 表达水平的影响
Runx2 是 BMP-2 通路下游中的重要转录因子,特异性表达于成骨细胞中。实时定量 PCR 实验在 mRNA 水平验证了化合物 E19773 对BMP-2 和 Runx2 表达的上调作用。在设定浓度下,E19773 处理的 U-2OS 细胞的 BMP-2 和Runx2 水平均有升高趋势,其中,50 μmol/L 浓度下上调的倍数最高,可分别上调 3.02 倍和 1.61倍(图 3 和图 4)。
2.3 活性化合物对 U-2OS 细胞 BMP-2、Runx2 蛋白表达水平的影响
用 Western blot 在蛋白水平验证了化合物E19773 对 BMP-2、Runx2 表达的上调作用。在设定浓度下,E19773 处理的 U-2OS 细胞 24 h 后BMP-2、Runx2 蛋白水平呈明显上升趋势,其中在12.5 和 50 μmol/L 浓度下上调最为明显,对BMP-2、Runx2 蛋白表达上调的最大倍数分别为3.77 倍和 2.88 倍(图5)。
2.4 活性化合物对 Smad1/5/8 蛋白磷酸化的影响
Smad1/5/8 蛋白是 BMPs 信号通路中一类重要的信号分子,当其接受 BMPs 信号时会被磷酸化激活,继而调控下游靶基因的表达。为了验证化合物 E19773 对 Runx2 的表达上调是否通过BMP-Smad 通路,本实验在蛋白水平验证了E19773 对 Smad1/5/8 蛋白磷酸化的作用。收集在设定浓度下 E19773 处理 1 h 的 U-2OS 细胞,用Western blot 方法对胞内蛋白进行检测,结果显示,E19773 对 Smad1/5/8 蛋白磷酸化具有一定的上调作用(P < 0.05)(图 6)。

图3 化合物 E19773 对 BMP-2 mRNA 表达水平的影响(*P < 0.05,**P < 0.01)Figure 3 Effects of E19773 on BMP-2 mRNA expression level in U-2OS (*P < 0.05,**P < 0.01)
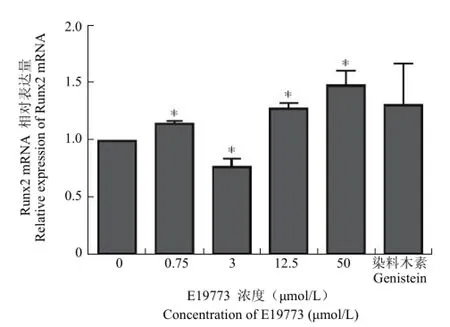
图4 化合物 E19773 对 Runx2 mRNA 表达水平的影响(*P < 0.05)Figure 4 Effects of E19773 on Runx2 mRNA expression level in U-2OS (*P < 0.05)
2.5 活性化合物对成骨细胞的促分化作用
碱性磷酸酶(ALP)活性增强是成骨细胞分化的重要标志之一。ALP 活性检测结果表明,化合物E19773 在设定浓度下能够上调 C3H10T1/2 细胞分泌的 ALP 水平,在 0.75 ~ 12.5 μmol/L 浓度范围内均表现上调作用,上调的最大倍数为 1.39 倍(图 7)。

图5 化合物 E19773 对 BMP-2 和 Runx2 蛋白表达水平的影响(A:Western blot;B:BMP-2;C:Runx2;*P < 0.05,**P < 0.01,***P < 0.001)Figure 5 Effects of E19773 on BMP-2 protein expression level in U-2OS (A: Western blot; B: BMP-2; C: Runx2;*P < 0.05,**P <0.01,***P < 0.001)
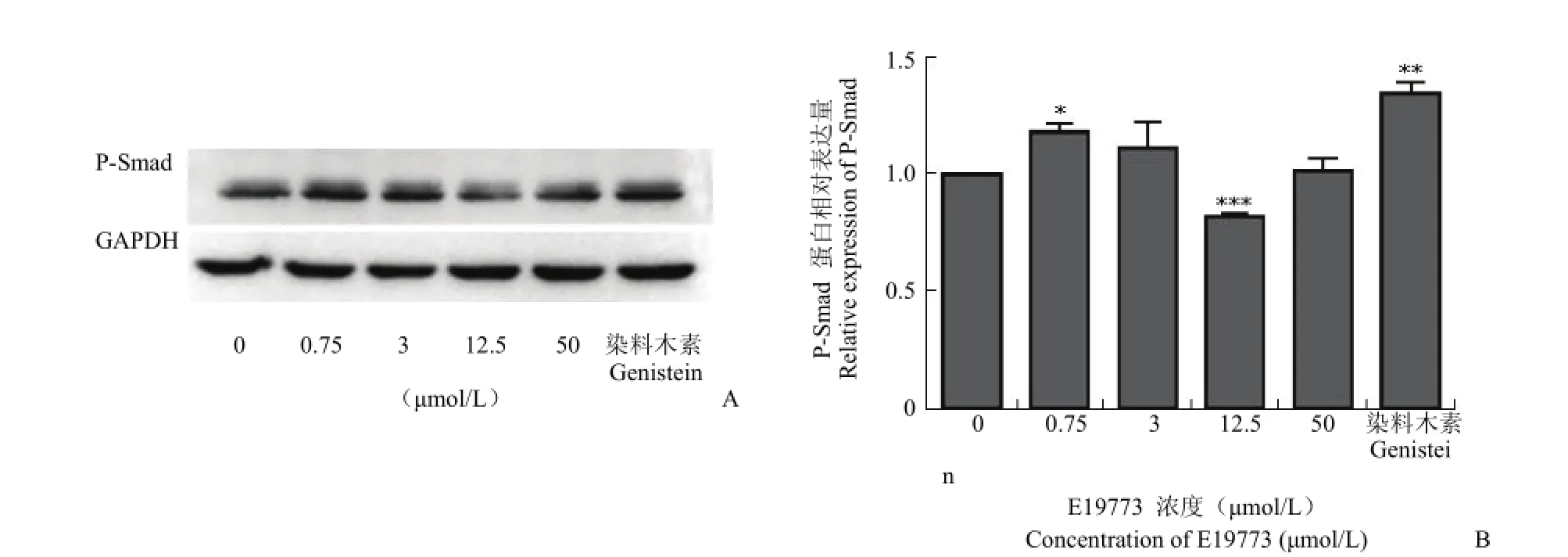
图6 化合物 E19773 对 Smad1/5/8 蛋白磷酸化水平的影响(A:Western blot;B:Smad1/5/8 蛋白磷酸化水平变化;*P < 0.05,**P < 0.01,***P < 0.001)Figure 6 Effects of E19773 on Smad1/5/8 phosphorylation level in U-2OS (A: Western blot; B: Change of Smad phosphorylation level;*P < 0.05,**P < 0.01,***P < 0.001)
3 讨论
BMPs 是一类具有高效诱骨活性的蛋白质,能够诱导未分化的间充质干细胞向骨细胞[8]和软骨细胞方向分化,进而分泌出骨质形成中所必需的各种蛋白(骨钙素、骨桥蛋白、胶原和 ALP 等)[9],促进钙盐的沉积和骨质的形成,在骨折和骨缺损的治疗中具有广泛的用途。其中,BMP-2 是 BMP 家族中成骨活性较强的一员,在成骨细胞分化过程中起着十分关键的作用。事实上,BMP-2 在骨质疏松领域中早已引起了广泛关注,但因其不能直接抑制破骨细胞的活性,同时采用基因工程的方法想得到大量的、接近天然活性、稳定的 BMP-2 蛋白仍有难度,并且患者长期接受注射治疗后有可能诱发机体的免疫排斥反应[10-12],因此促进人体内的BMP-2 表达上调成为治疗骨质疏松症的一个重要的研究方向。
Smads 蛋白是 BMP 通路中一类重要的胞内信号分子,负责传递 BMPs 信号的 Smad家族成员是 Smad1/5/8[13]。Runx2 是 BMP-Smad 通路中具有成骨分化标记作用的下游靶基因,当 Smad1/5/8接受 BMPs 信号时会发生磷酸化激活,继而调控下游靶基因的表达[14]。

图7 化合物 E19773 对 C3H10T1/2 细胞分泌 ALP 活性的影响(**P < 0.01,***P < 0.001)Figure 7 Effects of E19773 on ALP expression level in C3H10T1/2 (**P < 0.01,***P < 0.001)
本实验用 PMB 细胞模型对国家新药(微生物)筛选实验室的 10 000 多个化合物进行筛选,得到上调倍数较高的化合物 E19773。结构鉴定E19773 为 5-(5,6,7,8-四氢-4H-环庚[b]噻吩-2-酰胺)噻吩-2-羧酸甲酯类化合物,能够上调 BMP-2 mRNA 水平和蛋白水平的表达,并呈现一定的剂量依赖性。同时,化合物 E19773 能够促进Smad1/5/8 蛋白磷酸化,继而上调 Runx2 的表达,初步验证了 E19773 是通过 BMP-Smad 通路来调控细胞成骨分化。本研究得到的活性化合物E19773 具有成为新型抗骨质疏松药物先导物的潜力,其发现也为以 BMP-2 为靶点研发抗骨质疏松小分子药物奠定了重要的基础。
[1]Wang Q, Liu GJ, Xu SG. Clinical research progression on various drugs for treating osteoporosis. Prac J Med Pharm, 2010, 27(4):368-371. (in Chinese)
王谦, 刘光军, 许硕贵. 各类抗骨质疏松药物的临床研究进展. 实用医药杂志, 2010, 27(4):368-371.
[2]Liu ZT, Shang J. Signaling pathways in bone metabolism. Asia-Pac Traditional Med, 2012, 8(6):222-224. (in Chinese)
刘中天, 尚靖. 骨代谢分子信号通路研究进展. 亚太传统医药,2012, 8(6):222-224.
[3]Kannus P, Palvanen M, KaPrio J, et al. Genetic factors and osteoporotic fractures in elderly people: prospective 25 year follow up of a nationwide cohort of elder Finnish twins. BMJ, 1999, 319(7221):1334-1337.
[4]South-Paul JE. Osteoporosis: part1. Evaluation and assessment. Am Fam Physician, 2001, 63(5):897-904.
[5]Eisma JA. Genetics and osteoporosis. Endocr Rev, 1999, 20(6):788-804.
[6]Xu YN, Gao J, Xu Y, et al. Screening and identification of the upregulators of ATP-binding cassette transporter A1. Acta Pharm Sinica, 2012, 47(4):446-451. (in Chinese)
许艳妮, 高洁, 徐扬, 等. 人膜转运蛋白 ABCA1 表达上调剂的筛选与鉴定. 药学学报, 2012, 47(4):446-451.
[7]Xu Y, Xu YN, Wu YX, et al. Study of isolation, identification and biological activity of human high density lipoprotein receptor CLA-1 up-regulator 9179D. Chin J Antibiotics, 2012, 37(5):377-382. (in Chinese)
徐扬, 许艳妮, 巫晔翔, 等. 人高密度脂蛋白受体 CLA-1上调剂9179D的分离、结构鉴定和活性研究. 中国抗生素杂志, 2012, 37(5):377-382.
[8]Duan XJ, Yang L, Wang TX, et al. Effects of bone morphogenetic proteins on differentiation of human marrow stromal cells into osteoblasts in vitro. ACTA Acad Med Milit Tertiae, 2002,24(5):534-536. (in Chinese)
段小军, 杨柳, 王铁翔, 等. 骨形态发生蛋白对人骨髓基质细胞的体外成骨分化影响. 第三军医大学学报, 2002 , 24(5):534-536.
[9]Yan XR. Mechanism research of BMP2-induced osteogenic pathway in the calcification of craniopharyngioma and the establishment of human craniopharyngioma xenografts in chick chorioallantoic membrane. Guangzhou: Southern Medical University, 2013. (in Chinese)
颜小荣. BMP2介导的成骨通路在颅咽管瘤钙化中的机制研究及颅咽管瘤鸡胚绒毛尿囊膜移植瘤模型的建立. 广州: 南方医科大学,2013.
[10]Li X. Construction and application of new screening model with BMP-2 as a target in the anti-osteoporosis drug. Beijing: Peking Union Medical College, 2009. (in Chinese)
李雪. 以BMP-2为靶点的新型抗骨质疏松药物筛选模型的构建与应用研究. 北京: 北京协和医学院, 2009.
[11]Rizzoli R, Boniour JP, Ferrari SL. Osteoporosis, genetics and hormones. J Mol Endocrinol, 2001, 26:79-94.
[12]Chen D, Zhao M, Mundy GR. Bone morphogenetic proteins. Grows Factors, 2004, 22(4):233-241.
[13]Miyazono K. Signal transduction by bone morphogenetic protein receptors: functional roles of Smad proteins. Bone, 1999, 25(1):91-93.
[14]Yang K, Cao W, Hao X, et al. Metallofullerene nanoparticles promote osteogenic differentiation of bone marrow stromal cells through BMP signaling pathway. Nanoscale, 2013, 5(3):1205-1212.
Methods The process of screening was performed using a cell-based high-throughput screening model for BMP-2 with genistein as a positive control. Runx2 is a major osteogenic transcription factor in BMP-2-mediated pathway, and Smad1/5/8 is a very important signaling molecule in this pathway. The mRNA and protein expression levels of BMP-2, Runx2 and Smad1/5/8 phosphorylation were measured by real time PCR and Western blot, respectively. The activity of ALP was measured by the method of PNPP.
Results Compound E19773 with the activity of up-regulating the expression of BMP-2 was found by PMB models, and the EC50value of E19773 was 46.2 μmol/L. E19773 was found to significantly increase the mRNA expression levels of BMP-2 and Runx2, as well as increase the protein expression levels of BMP-2, Runx2 and Smad1/5/8 phosphorylation in U-2OS cells. In vitro results of ALP activity indicated that E19773 was able to promote osteoblast differentiation.
Conclusion Compound of E19773 can up-regulate the expression of BMP-2 through BMP-Smad pathway at the concentration of 0.75 - 50 μmol/L. Thus the compound can be regarded as a lead compound for the development of new drugs to prevent and treat osteoporosis in the future.
Identification and anti-osteoprosis activity research of up-regulators of bone morphogenetic protein-2
LI Xue-hong, GONG Shi-qiang, HAN Xiao-wan, SI Shu-yi, WANG Yan-hong
Objective To discover potential small-molecular compounds with the anti-osteoporosis functions by up-regulating the expression of bone morphogenetic protein-2 (BMP-2).
Osteoporosis; High-throughput screening; Bone morphogenetic protein 2
s: SI Shu-yi, Email:sisyimb@hotmail.com; WANG Yan-hong, Email: wang.yanhong@163.com
10.3969/cmba.j.issn.1673-713X.2015.03.008
150040 哈尔滨,黑龙江中医药大学药学院(李雪虹、王艳宏);100050 北京,中国医学科学院北京协和医学院医药生物技术研究所(李雪虹、宫世强、韩小婉、司书毅);100005 北京,中国医学科学院北京协和医学院基础医学研究所(宫世强)
司书毅,Email:sisyimb@hotmail.com;王艳宏,Email:wang.yanhong@163.com
2015-02-03
*同为第一作者
结果 在 BMP-2 表达上调剂模型细胞上筛选得到活性化合物 E19773,其在模型细胞上的 EC50为 46.2 μmol/L;实时定量 PCR 结果显示,化合物 E19773 能够提高 U-2OS细胞 BMP-2 和 Runx2 的 mRNA 表达水平;Western blot结果显示,Smad1/5/8 蛋白磷酸化水平明显升高;碱性磷酸酶结果表明 E19773 能够在体外促进成骨细胞的分化。
结论 化合物 E19773 在 0.75 ~ 50 μmol/L 浓度范围内能明显上调 BMP-2 的表达,主要通过 Smads 通路来调控细胞成骨分化,是活性较好的 BMP-2 上调剂。
www.cmbp.net.cn 中国医药生物技术, 2015, 10(3):236-241
Author Affiliations: College of Pharmacy, Heilongjiang University of Chinese Medicine, Harbin 150040, China (LI Xue-hong,WANG Yan-hong); Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College,Beijing 100050, China (LI Xue-hong, GONG Shi-qiang, HAN Xiao-wan, SI Shu-yi); Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100005, China (GONG Shi-qiang)
www.cmbp.net.cn Chin Med Biotechnol, 2015, 10(3):236-241
