呼吸道分离鲍曼不动杆菌生物被膜形成能力与耐药性关系的研究
2015-11-24赵玉杰冯雁京张立然
刘 原,柯 蕊,杨 妮,赵玉杰,2,和 平,冯雁京,张立然,耿 燕
(1.西安交通大学第二附属医院 呼吸内科;2.西安交通大学第二附属医院重症医学科;3.西安交通大学第二附属医院 检验科,陕西 西安710004)
随着抗生素的广泛使用,鲍曼不动杆菌的感染率逐年上升,其中80%的患者感染途径为呼吸道,科室分布也以呼吸内科为主,在患者机体免疫功能受损或抵抗力下降时引起肺部感染或合并肺部感染最为常见[1]。加强对呼吸系统鲍曼不动杆菌的耐药机制研究非常必要。既往研究发现鲍曼不动杆菌广泛以生物被膜(Biofilm,BF)的形式存在[2],但有关呼吸道分离的鲍曼不动杆菌生物被膜形成能力与细菌耐药性之间的关系尚无相关报道。本研究旨在探讨呼吸道分离鲍曼不动杆菌生物被膜形成能力与耐药性之间的关系。
1 材料与方法
1.1 材料
1.1.1 菌株来源 收集2014年3月至2014年12月西安市具有代表性的六所三级甲等综合医院临床痰标本中分离鉴定的非重复鲍曼不动杆菌178株。大肠埃希菌ATCC25922和铜绿假单胞菌ATCC27853为药敏试验质控菌株,鲍曼不动杆菌A601为生物被膜阳性对照株。
1.1.2 主要仪器 Vitek-2细菌全自动鉴定仪(法国梅里埃生物公司),96孔板酶标仪(德国BMG Lab Technologies公司)。
1.1.3 主要试剂 MH 琼脂粉,LB培养基,0.25%(v/v)结晶紫染液,分析纯无水乙醇。药敏纸片均购自英国Oxoid公司。
1.2 方法
1.2.1 药敏试验 采用K-B法测定14种抗生素的敏感性。用精度为1mm的游标卡尺测量并记录药敏平板的抑菌圈直径。结果按照(Clinical and Laboratory Standards Instltute,CLSI)2013年版标准进行操作和结果判断。
1.2.2 生物被膜形成时间测定 依据参考文献方法[3]略作改进:随机挑选18株临床菌株和生物被膜阳性株,制备浓度为1×109CFU/ml的过夜菌液,取20ml接种于聚乙烯96孔板(每孔含200ml LB培养基),每株菌做6个复孔,另设阴性对照,37℃静置培养,24小时换液,连续7天用酶标仪测定。测定前用无菌蒸馏轻洗3次,除去浮游菌,自然风干后加入0.25g/L结晶紫染液200ml,室温染色20 min,用蒸馏水洗去染液,自然风干后用95%乙醇萃取10min。用酶标仪测定其在590nm处的吸光度(OD)值,计算6个复孔的平均值,绘制生长曲线。重复测定3次。
1.2.3 生物被膜形成能力测定 按照上述方法,对收集的178株鲍曼不动杆菌生物被膜形成能力进行测定,每株菌做3个复孔,设阴性和阳性对照,24小时换液,于第5天测定其在590nm处的吸光度(OD)值,重复测定3次。结果判定参照文献[4]:空白对照OD值的均值±标准差定义为ODc,待测菌株的OD值与ODc比较,OD≤2*ODc为生物被膜形成阴性株;OD>2*ODc为生物被膜形成阳性株,其中,2*ODc<OD≤4*ODc为生物被膜形成能力弱菌株,OD>4*ODc为生物被膜形成能力强菌株。
2 结果
2.1 药敏结果
178株临床分离株体外药物敏感试验结果见表1。其中对头孢类二代、三代、四代耐药率均较高,均大于65%;单酰胺类氨曲南、喹诺酮类、磺胺等均有较高的耐药率;氨基糖甙类阿米卡星的耐药率较低;对加入酶抑制剂的头孢菌素类的耐药率亦低,对碳青霉烯类的耐药率最低。
2.2 生物被膜形成时间测定结果
对19株鲍曼不动杆菌生物被膜形成时间动态监测:按照生物被膜形成趋势分为三组,见图1,生物被膜形成能力较强的3株(包括生物被膜阳性对照株),形成能力较弱的有8株,无生物被膜形成能力的有8株。在培养48h内生物被膜生长缓慢,第3天时生物被膜形成速度最快,到第4、5天时生长速度减缓逐渐达到平台期,第6、7天时呈负增长趋势或涨幅速度变慢。选择生物被膜生长成熟的第5天为检测点。
2.3 生物被膜形成能力测定结果
对培养至第5天的178株鲍曼不动杆菌进行生物被膜形成能力的半定量测定:46.07%(82株)生物被膜形成阴性;53.93%(96株)生物被膜形成阳性,其中11.80%(21株)生物被膜形成能力强,42.13%(75株)生物被膜形成能力弱。
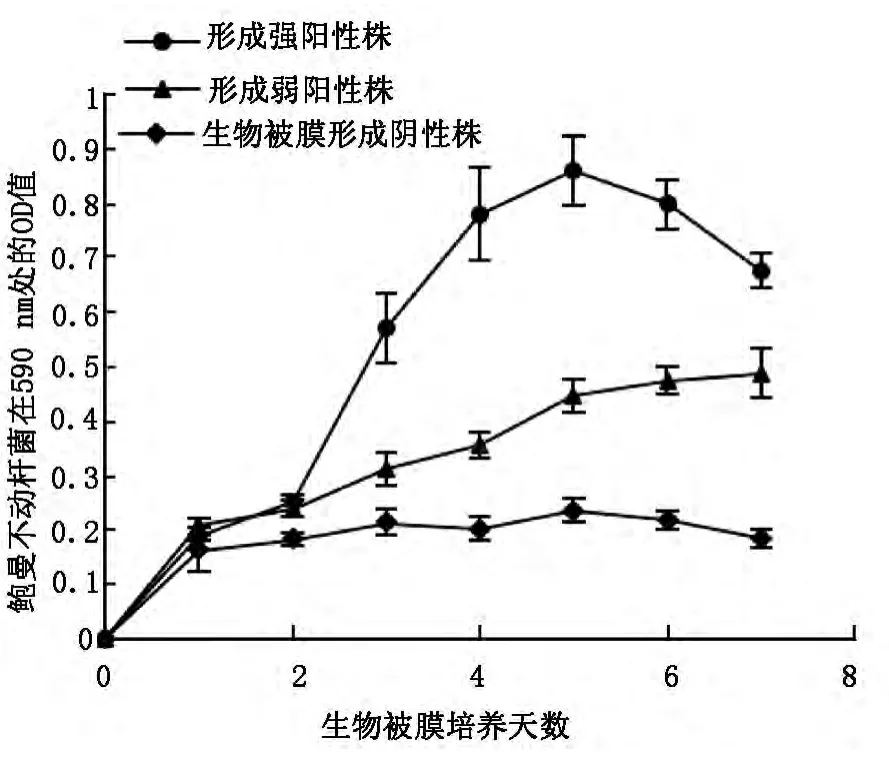
图1 鲍曼不动杆菌在590nm处的吸光度值(OD值)
2.4 生物被膜形成能力与耐药性之间的相关性分析
比较鲍曼不动杆菌生物被膜阳性株与生物被膜阴性株对常用抗菌药物的耐药率发现,除亚胺培南、美罗培南、头孢呋辛、头孢曲松、氨曲南外,生物被膜形成阴性株对其余九种抗生素的耐药率高于生物被膜阳性株。鲍曼不动杆菌生物被膜形成能力与耐药性密切相关。见表1。
3 讨论
细菌形成生物被膜后,由于生物被膜的物理屏障作用和膜内的特殊微环境,使其耐药性显著提高[5]。然而,细菌生物被膜的形成能力受环境及自身遗传特质的影响,调控机制非常复杂,目前关于细菌生物被膜形成能力与耐药性的关系尚无定论。Rao[6]发现鲍曼不动杆菌生物被膜阳性株对头孢肟、氨曲南、阿米卡星、环丙沙星的耐药率高于生物被膜阴性株;Rodriguez-Bano等[7]发现鲍曼不动杆菌生物被膜形成阳性株对亚胺培南及环丙沙星的耐药率低于生物被膜形成阴性菌株。然而Wroblewska等[8]研究提示鲍曼不动杆菌生物被膜形成能力与其对碳青霉烯类抗生素的耐药性无相关性。
本研究发现对于耐药率普遍较低的药物(如亚胺培南和美罗培南)及耐药率普遍较高的药物(如头孢呋辛、氨曲南),鲍曼不动杆菌生物被膜形成能力与耐药性之间无统计学差异,对其余九种抗生素生物被膜形成阴性株的耐药率高于生物被膜形成阳性株。与 Rodriguez-Bano[4]的研究部分一致,但与Rao[3]的报道相反,可能原因有:1)对于某些临床常用的或传统抗生素,几乎所有的鲍曼不动杆菌都对其耐药,如:头孢呋辛、头孢曲松。同样,对于某些使用频率较低或新型抗生素,大多数鲍曼不动杆菌都对其敏感,如亚胺培南、美罗培南。由于抗生素的使用习惯和频率的差异所造成的抗生素选择压力可能导致这一结果的出现;2)细菌在形成生物被膜后耐药性提高,但就细菌个体而言,由于生物被膜的屏障作用使生物被膜微环境中抗生素的浓度较低,而且由于生物被膜内细菌的紧密结合使抗生素的结合位点减少,生物被膜形成阳性菌株面对的抗生素压力较生物被膜形成阴性菌相对小,其个体适应能力或许低于浮游状态的菌株。相反,生物被膜阴性菌株多以浮游菌状态存在,在抗生素的选择压力下,其耐药基因的水平转移及耐药基因突变的积累可能较生物被膜形成阳性株更为活跃,使细菌个体获得较高的耐药性[9]。

表1 生物被膜形成能力不同的鲍曼不动杆菌对14种抗菌药物耐药性的比较
本研究还发现形成能力不同的菌株其动态生长曲线也不尽相同,但均能体现生物被膜形成的不同阶段。在培养48小时内生长曲线较平坦,对应为定植与不可逆结合阶段。培养至第3天时生长曲线涨幅速度最快,与生物被膜成熟前期相对应。生物被膜成熟期表现为到培养的第4、5天时生物被膜生长速度减缓。培养至第6、7天时生长曲线涨幅速度变慢或呈负增长趋势,对应于生物被膜成熟后期。在对鲍曼不动杆菌生物被膜形成能力的测定发现,53.93%的菌株生物被膜形成阳性,低于Rao[6]和王政[3]等的报道。上述实验结果的差异可能与实验室条件、操作以及细菌自身遗传因素的影响有关。
综上,呼吸道鲍曼不动杆菌多可形成生物被膜,提示生物被膜是呼吸道分离鲍曼不动杆菌提高其环境适应能力的方式之一。呼吸道分离的鲍曼不动杆菌生物被膜形成能力与耐药性呈负相关,可能与生物被膜产生的耐药屏障作用以及菌株个体耐药性的提高有关,但具体相关机制还需进一步研究。
[1]陈佰义,何礼贤,胡必杰,等.中国鲍曼不动杆菌感染诊治与防控专家共识[J].中华医学杂志,2012,92(2):76.
[2]Mcqueary C N,Actis L A.Acinetobacter baumannii Biofilms:Variations Among Strains and Correlations with Other Cell Properties[J].Journal of Microbiology,2011,49(2):243.
[3]王 政,刘 丁,黄冬梅,等.鲍曼不动杆菌临床分离株生物被膜形成能力与耐药性的研究[J].中国病原生物学杂志,2010,5(6):405.
[4]Stepanovic S,Vukovic D,Dakic I,et al.A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J].Journal of Microbiological Methods,2000,40(2):175.
[5]Ahya A,Saghar H,Parisa M,et al.Assessment of Biofilm Formation and Resistance to Imipenem and Ciprofloxacin among Clinical Isolates of Acinetobacter baumannii in Tehran[J].Jundishapur J Microbiol,2014,7(1):e8606.
[6]Rao R S,Karthika R U,Singh S P,et al.Correlation between biofilm production and multiple drug resistance in imipenem resistant clinical isolates of Acinetobacter baumannii[J].Indian Journal of Medical Microbiology,2008,26(4):333.
[7]Rodriguez-Bano J,Marti S,Soto S,et al.Biofilm formation in Acinetobacter baumannii:associated features and clinical implications[J].Clinical Microbiology and Infection,2008,14(3):276.
[8]Wroblewska M M,Sawicka-Grzelak A,Marchel H,et al.Biofilm production by clinical strains of Acinetobacter baumannii isolated from patients hospitalized in two tertiary care hospitals[J].FEMS Immunology and Medical Microbiology,2008,53(1):140.
[9]Abdi-Ali A,Hendiani S,Mohammadi P,et al.Assessment of Biofilm Formation and Resistance to Imipenem and Ciprofloxacin among Clinical Isolates of Acinetobacter baumannii in Tehran[J].Jundishapur J Microbio.,2014,7(1):e8606.
