利奈唑胺含量测定方法的选择
2015-11-23蒋萍萍张华玲
蒋萍萍,张华玲
(杭州华东医药集团生物工程研究所,浙江杭州310011)
分析测试
利奈唑胺含量测定方法的选择
蒋萍萍,张华玲
(杭州华东医药集团生物工程研究所,浙江杭州310011)
[目的]建立测定利奈唑胺的高效液相色谱方法。[方法]采用YMC ODS-AM(150×4.6 mm粒径5 μm)为色谱柱;流动相:0.1%三氟乙酸的水溶液:0.1%三氟乙酸的乙腈溶液=90:10梯度洗脱,柱温:25℃,流速:1 mL/min,检测波长:254 nm。[结果]本方法专属性强,操作方便,结果准确,可用于测定利奈唑胺的含量。
高效液相色谱法;利奈唑胺;YMC ODS-AM;含量测定
利奈唑胺是一种人工合成的唑烷酮类抗生素,为细菌蛋白质合成抑制剂。于2000年获得美国FDA批准,用于治疗革兰阳性(G+)球菌引起的感染。随后在澳大利亚、加拿大、英、法、韩、香港、日本等19个国家和地区上市;2006年9月在中国取得进口药品注册证;于2007年9月在中国上市。本品独特的作用机制,与其它类型的抗菌药无交叉耐药性,同时具有口服生物利用度高、药动学性质好及毒性小的特点,在治疗革兰阳性耐药菌引起的严重感染方面显示出较大的潜力。
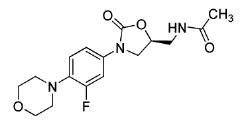
利奈唑胺化学结构式
本文优化了在YMC ODS-AM反向色谱柱上分离利奈唑胺的质量检测条件。
1 实验部分
1.1 仪器与试剂
Agilent 1260高效液相色谱输液泵,1260DAD型紫外检测器。
已腈(色谱纯ACS)、三氟乙酸、三乙胺(色谱纯,天津市科密欧化学试剂有限公司)、磷酸二氢钾(分析纯,湖州胡试化学试剂有限公司)。
1.2 色谱条件
色谱柱:YMC ODS-AM 150×4.6 mm 5 μm色谱柱;流动相:V(0.1%三氟乙酸的水溶液):V(0.1%三氟乙酸的乙腈溶液)=90:10梯度洗脱,流速为1 mL/min,检测波长:254 nm;柱温:25℃;进样量:10 μL。
1.3 不同因素对利奈唑胺检测结果的影响
1.3.1 色谱柱的选择
参照进口注册标准系统进行色谱柱的筛选,150×4.6 mm柱子流速为1.0 mL/min,250×4.6 mm柱子流速相应调整为1.67 mL/min,结果见表1。色谱图见附图1。
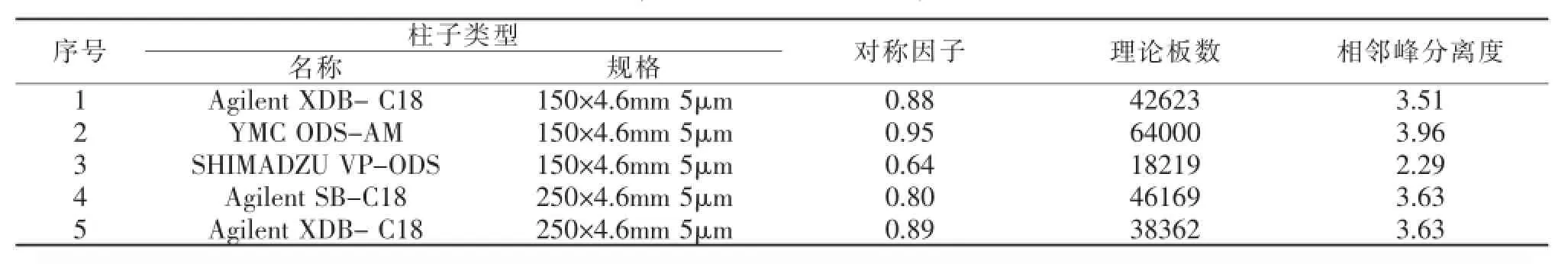
表1 色谱柱的选择

图1 不同色谱柱选择的HPLC图
从以上试验可见,使用YMC ODS-AM 150× 4.6 mm 5 μm色谱柱,主峰峰型最好,与杂质分离度最高,理论塔板数最高。故选择YMC ODS-AM 150×4.6 mm 5μm色谱柱。
1.3.2 流动相的选择
1.3.2.1 缓冲盐的选择
在初期选用的YMC ODS-AM 150×4.6 mm 5 μm的基础上,取粗品适量,用乙腈-水(1:9)稀释制成浓度约0.5 mg/mL的供试品,再加入专属性项下酸、碱、氧化降解后的样品适量,作为供试品,对流动相进行选择。结果见表2。
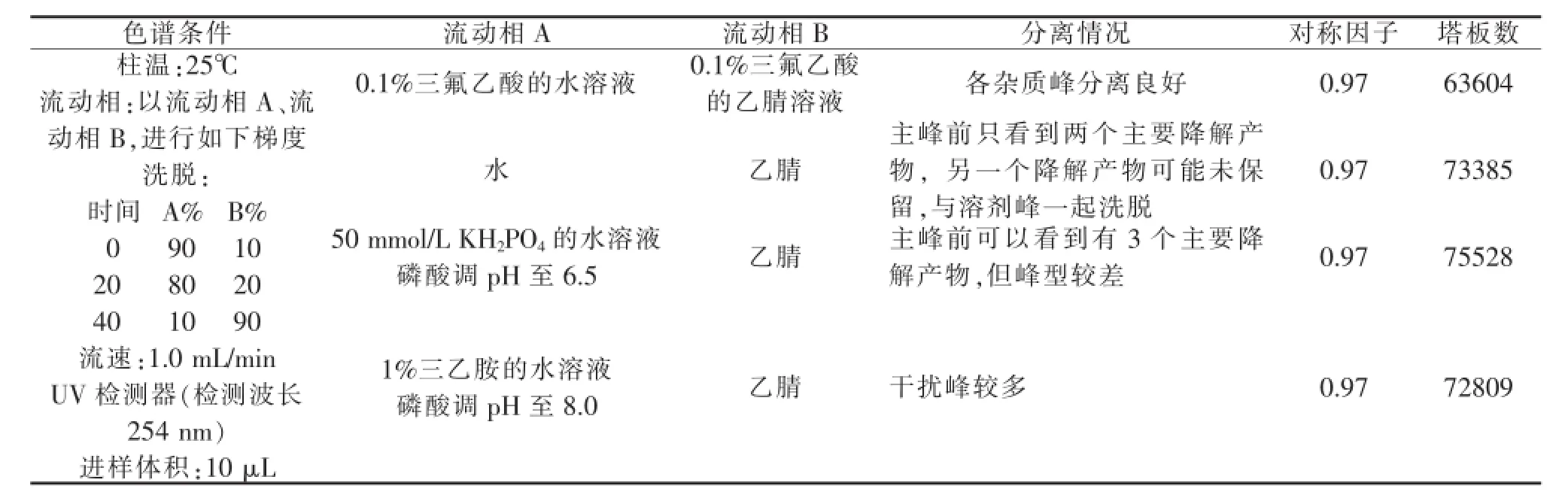
表2 缓冲盐的选择

图2 不同缓冲盐选择的HPLC图
从以上试验可见:流动相2对利奈唑胺的一种降解产物未起到保留作用,流动相3使降解产物的峰型变差,流动相4空白干扰严重。流动相1对各峰都有较为合适的保留能力,峰型较好,基线波动小,更利于杂质的检出。所以最终参考进口注册标准,选择流动相1,色谱图见附图2。
1.3.2.2 梯度时间选择
在其余色谱条件均一致的情况下,取粗品适量,用乙腈-水(1:9)稀释制成浓度约0.5 mg/mL的供试品,调试不同梯度洗脱速度,方法1参考进口注册标准(测定仪器延迟体积为1.1 mL),方法2、3、4为自调方法,结果见表3。色谱图见附图3。

表3 梯度时间的选择

图3 不同梯度时间选择的HPLC图
从以上结果看出,方法4整个梯度时间较长,且各杂质间相邻太近,故首先排除。方法1、2、3无论是对出峰时间、峰型、分离度、杂质检出个数都未见明显差别,说明梯度程序的略微变化对杂质的检出没有明显区别,故无需采用测量延时体积的方法,排除方法1。方法2因为在35 min从梯度洗脱变为等度洗脱,所以可能比方法3产生更多的空白峰,且方法3的洗脱能力比方法2更强,更有利于杂质的检测。故方法3为优选方法。因为在相对保留时间1.73的杂质之后就未见有其他杂质检出,且90%的乙腈2洗脱能力已经足够强,所以最终梯度程序调整为:

时间A%B% 0 9010 208020 401090
1.3.2.3 溶剂的选择
分别选择水、乙腈、水-乙腈(1:1)、水-乙腈(9:1)作为溶剂,按有关物质项下方法进样,结果见表4。色谱图见附图4。
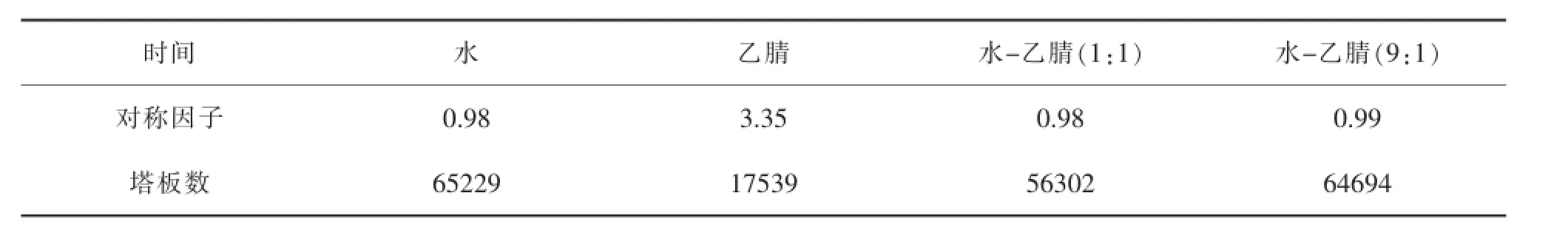
表4 溶剂的选择

图4 不同溶剂选择的HPLC图
结果表明,用水作为溶剂时利奈唑胺溶解稍慢,乙腈作为溶剂时溶剂效应明显,水-乙腈(1:1)作为溶剂时2 min处有溶剂峰,而水-乙腈(9:1)作为溶剂时以上问题都不存在,峰型较好,故选择作为溶剂。
1.3.2.4 柱温的选择
分别以柱温T=20℃、25℃、30℃、35℃、40℃试验,结果见表5,结果表明温度越高对称因子反而越低,且高温对色谱柱寿命有影响,故选择柱温为25℃。

表5 柱温的选择
1.3.2.5 流速的选择
在其他相同的条件下,分别以流速V=0.8、0.9、1.0、1.1、1.2 mL/min试验,结果见表6,结果表明:适当增加流速可加快出峰时间,但柱效有所降低,故仍选择常规流速1.0 mL/min作为测定流速。
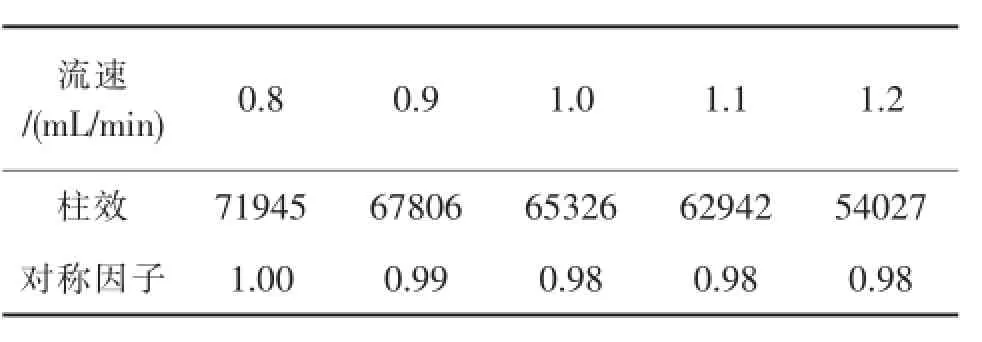
表6 流速的选择
2 结果与讨论
综上所述,最佳的色谱条件为:色谱柱:YMC ODS-AM 150×4.6mm 5μm色谱柱;流动相:V(0.1%三氟乙酸的水溶液):V(0.1%三氟乙酸的乙腈溶液)=90:10梯度洗脱,流速为1 mL/min,检测波长:254 nm;柱温:25℃。
3 方法评价
在最终优化的色谱条件下,对同一样品重复测定5次。取利奈唑胺对照品适量,用乙腈-水(1:9)溶解并定量稀释制成每1 mL中约含0.1 mg的对照品溶液两份,各取10 μL注入液相色谱仪,一份重复进样3次,一份重复进样2次,五针样品主峰峰面积与浓度的比值的相对标准偏差不大于2.0%,理论板数按利奈唑胺峰计算应不低于5000。
精密称取利奈唑胺对照品适量,加乙腈-水(1:9)溶解并稀释制成每1 mL中含0.5 mg溶液,精密量取上述溶液用乙腈-水(1:9)稀释制成0.17、0.5、2.5、5.0、7.5、10.0 μg/mL的溶液,分别精密量取10 μL,注入液相色谱仪,记录色谱图,以浓度为x轴,峰面积为y轴,进行线性回归,见表6和图6。

图6 利奈唑胺的线性

表6 线性回归结果
结果表明,利奈唑胺在0.17~10.06 μg/mL浓度范围内(相对浓度0.03%~2.0%)与峰面积线性良好。
在本方法条件下测定利奈唑胺化学纯度,可得到稳定可靠的数据,并可在生产过程中对其进行精确的质量控制。
[1]毛桂福.HPLC法测定水杨酸苯酚洗剂中苯酚和水杨酸的含量[J].药学实践杂志,2005,(4):226-227.
[2]刘晓云,公方美.HPLC法测定阿奇霉素分散片的含量[J].齐鲁药事,2005,(11):668-669.
[3]许妍,周国平,罗跃华,等.HPLC法测定高效风油精中盐酸达克罗宁含量[J].中国药品标准,2005,(2):15-16.
Selectivity of Linezolid's Determination Method
JIANG Ping-ping,ZHANG Hua-ling
(Hangzhou Huadong Medicine Group Pharmaceutical Research Institute Co.,Ltd.,Hangzhou,Zhejiang 310011,China)
[Objective]To establish a HPLC method for the determination of linezolid.[Methods]The separation was performed on YMC ODS-AM(150×4.6 mm,5 μm)column,the mobile phase consisted of water-acetonitrile(10∶90)with the flow rate of 1 mL/min,the detection wavelength was at 254 nm and column temperature was 25℃.[Results]The method is simple,quick and specific.
HPLC;linezolid;YMC ODS-AM;determination
1006-4184(2015)7-0045-06
2015-03-17
蒋萍萍(1986-),女,浙江绍兴人,助理工程师,理学学士,本科,从事药物分析工作。E-mail:sxjiangpingping@163.com。
