1,1,1-三氟-2-丁酮的合成与应用
2015-11-23金杭丹戴佳亮徐卫国
金杭丹,戴佳亮,徐卫国
(浙江省化工研究院有限公司,浙江杭州310023)
氟化工
1,1,1-三氟-2-丁酮的合成与应用
金杭丹,戴佳亮,徐卫国
(浙江省化工研究院有限公司,浙江杭州310023)
总结了1,1,1-三氟-2-丁酮的制备方法,及其在医药、农药等领域中的应用。
1,1,1-三氟-2-丁酮;制备;应用;医药;农药
0 前言
1,1,1-三氟-2-丁酮,英文名1,1,1-trifluoro-2-butanone,CAS号381-88-4,分子式C4H5F3O,分子量126.08,沸点50℃~51℃,密度0.929 g/mL(25℃)。以下简称三氟丁酮。三氟丁酮由于羰基的存在,使其具有较高的活性,可用于合成各类含三氟甲基的吡咯、吡唑、三唑、氨基酸等,在医药、农药和其它工业领域应用广泛。其结构如下所示:
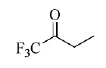
1 制备
1964年,英国伯明翰大学的Burdon等人[1]报道了一种制备1,1,1-三氟-2-丁酮的方法:将金属钠置于反应器中,加入三氟乙酸乙醋和丙酸乙醋,冷却后,加入乙醚稀释,回流48 h。除去溶剂,乙醚溶解,以15%硫酸洗涤,萃取、精馏得到γ,γ, γ-三氟甲基-α-甲基乙酸乙酸乙醋。加入30% H2SO4回流28 h(Scheme_1)。用二正丁基醚的水溶液萃取,精馏得到1,1,1-三氟-2-丁酮。
1995年,华中理工大学的龚跃法等人[2]在反应器中加入无水四氢呋喃、金属锂,滴加三氟乙酸,冷却后依次加入金属镁屑和溴乙烷,回流0.25 h,反应完毕,稀盐酸水溶液酸化,乙醚萃取,得到目标产物三氟丁酮(Scheme_2),收率为55%。
2008年,日本住友化学的Miyazaki等人[3]涉及的制备三氟丁酮的路线:在-78℃冷却下,向溴乙烷、镁和乙醚制备的乙基溴化镁溶液中滴加三氟乙酸乙醋。在此温度下搅拌1 h,升至室温,加入10%盐酸,乙醚萃取,得到三氟丁酮的乙醚溶液(Scheme_2)。
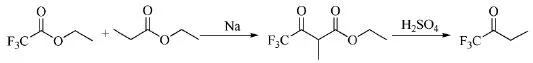
Scheme_1
2011年,旭硝子公司的Ogawa等人[4]报道了一种烷基酮的制备方法,制备三氟丁酮的路线参照Scheme_2。镁加入环戊基甲醚中,滴加溴乙烷的环戊基甲醚溶液,冷却后滴加三氟乙酸乙醋的环戊基甲醚溶液,待反应停止放热,滴加水和盐酸,萃取有机相,色谱分析,含三氟丁酮72%,精馏得到产品三氟丁酮,收率为55%。
2013年,巨化集团的胡正等人[5]公开了一种三氟丁酮的制备方法。将三氟乙酸钠、镁屑、溶剂2-甲基四氢呋喃加入反应器中,加热到40℃后,滴加溴乙烷和2-甲基四氢呋喃,滴加完毕,升温至50℃,反应2 h。盐酸酸化,萃取有机相,精馏得到三氟丁酮,收率为67%,纯度为99%(Scheme_2)。
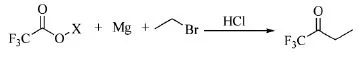
scheme_2
2013年,浙江大学的Cheng等人[6]涉及的制备三氟丁酮的方法为(反应路线见Scheme_3):N,O-二甲基经胺盐酸盐溶于二氯甲烷中,0℃下,加入三氟乙酸醉和吡陡,搅拌1 h,盐酸水洗,得2,2,2-三氟甲基-N-甲氧基-N-甲基乙酸胺,纯度为90%,收率为80%。2,2,2-三氟甲基-N-甲氧基-N-甲基乙酸胺,在THF中滴加溴乙烷的格氏试剂溶液。0℃下反应30 min,氯化铵水溶液淬灭,萃取浓缩得三氟丁酮纯度为95%,收率为70%。
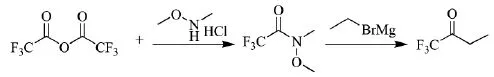
scheme_3
2 应用
2.1 制备医药中间体
2.1.1 制备呼吸系统药物
5-LO是生物体内一种重要的双加氧酶,可以将花生四烯酸两步催化氧化和脱水,并在5-脂肪氧化酶激活蛋白(FLAP)存在下生成重要的炎症介质白细胞三烯,其涉及诸多的生物作用,如平滑肌收缩、白细胞激活、细胞因子和粘液分泌等,在许多疾病中发挥着重要作用。
2004年,加拿大默克福罗斯特(Merck Frosst)制药公司的Gareau等人[7]以三氟丁酮合成噻唑硫代香豆素化合物(1),可抑制白三烯生物合成的5-LO抑制剂。二异丙基乙胺、正丁基锂、2-巯基噻唑的THF溶液中添加三氟丁酮,于-78℃下搅拌3 h,柱层析得目标产物(1a),再与香豆素衍生物在碳酸钾和NMP作用下得到具有5-LO抑制活性的噻唑硫代香豆素化合物(1),路线见Scheme_4。
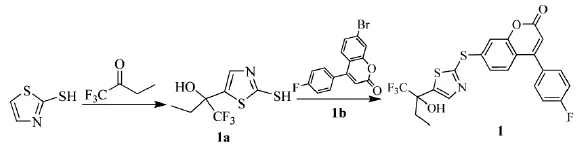
Scheme_4
为寻求治疗哮喘的药物,2012年,该公司的Ouellet等人[8]在先前Grimm等人[9]以三氟丁酮制备各类三唑衍生物(以三氟丁酮制备3-三氟甲基-3-经基-己炔再与叠氮基环合成三唑)的基础上,通过9步合成了具有5-LO抑制效果的化合物(2)。首先以2-甲基苯酚和3-氟苯甲酸为原料,以Pechmann缩合形成香豆素核心(2c)。最后的三唑基团则是通过特定选择的铜催化香豆素(2c)和手性炔烃(2b)[3+2]环加成得到产物(2),9步收率27%,其中手性炔烃(2b)是由三氟丁酮为原料合成,路线见Scheme_5。
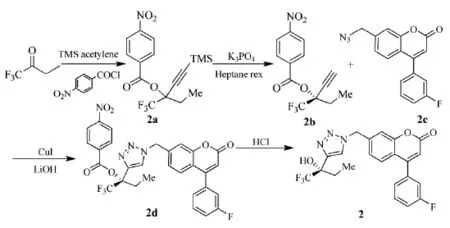
scheme_5
2007年,美国Amira Pharmaceuticals公司的Hutchinson等人[10]制备了含有三环的化合物,类似结构见(3),抑制5-脂肪氧合酶(5-LO)的活性,用于治疗白细胞三烯介导的呼吸系统和心血管疾病等。三氟丁酮可与噻唑-2-硫醇制备得到中间体(3a)。(3a)可与(3b)得到具有5-LO抑制活性的三环化合物(3),具体路线见Scheme_6(其中R1可为H或N,R2可为H或苯基)。
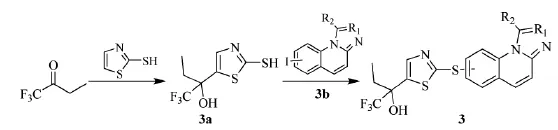
scheme_6
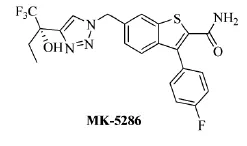
2010至2011年间,加拿大Merck Frosst制药公司的Li等人[11]和美国Amira Pharmaceuticals公司的Roppe等人[12-13]分别制备了类似的三唑衍生物,如以三氟丁酮为原料合成的三唑(4),可以抑制5-LO的活性,治疗呼吸系统、心血管疾病和其他白细胞三烯依赖及介导的疾病。三唑(4)的合成路线见Scheme_7,其中R可以为异丙基、环丙基、环戊基、吡陡基、含氟芳基等;腈基也可以水解为酸胺基,苯并噻吩基也可以为吲哚基。且Li等人经过广泛的SAR研究该系列三唑衍生物,发现R为对氟苯基,氰基为酸胺基时的三唑衍生物MK-5286(结构如下所示),对5-LO的选择性和抑制能力最优。
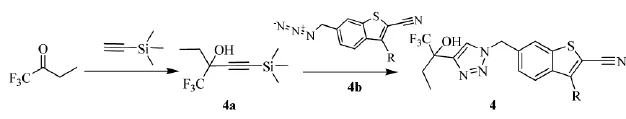
Scheme_7
2.1.2 制备神经系统药物
磷酸二醋酶9A(PDE9A)的抑制是寻找治疗CNS疾病(如阿尔茨海默病)或其它脑神经退化引起的认知障碍的可行途径之一。2011年,德国勃林格殷格翰公司的Dorner-Ciossek等人[14-15]制备了一种吡唑并[3,4-D]嘧陡酮衍生物,为PDE9A抑制剂,可治疗与直觉、注意力、学习力或记忆力不足等相关病症。三氟丁酮可用于合成该系列的吡唑并[3,4-D]嘧陡酮衍生物(5),路线见Scheme_8。
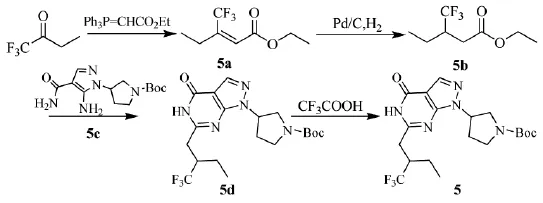
Scheme_8
2013年,美国默沙东的Bungard等人[16]发明了一类喹啉甲酸胺和喹啉甲腈衍生物,为促进谷氨酸受体2(mGluR2)调节剂。mGluR2在皮层和海马中普遍存在,并调节大脑的主要兴奋性神经递质谷氨酸在关键神经突触的释放。本类喹啉甲酸胺(腈)用作非竞争性的mGluR2拮抗剂或mGluR2的负变构调节剂,可治疗如阿尔茨海默氏病、认知损害、精神分裂症、睡眠障碍等多种常见神经变性疾病。三氟丁酮可合成喹啉甲腈(6c)和喹啉甲酸胺(6d),路线见Scheme_9。
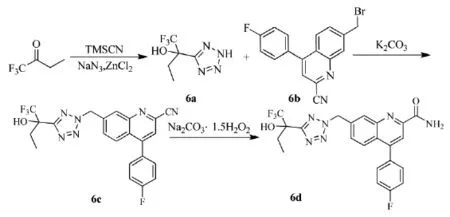
scheme_9
2.1.3 制备激素类药物
2005年,美国克必成公司的Turnbull等人[17]合成了一种苯胺氨基酸类化合物,属于非甾体类化合物,是雄激素、糖皮质激素、盐皮质激素的调节剂,可治疗或预防骨质疏松症、心血管疾病、乳腺癌、子宫癌、抑郁、主动脉平滑肌细胞增殖等相关疾病。Scheme_10是三氟丁酮合成其中一种苯胺氨基酸类化合物(7)的路线。首先在4-氨基-2-三氟甲基氰苯(7a)与氰基硼氢化钠中滴加三氟丁酮,反应41 h加入碳酸氢钠水溶液淬灭反应,重结晶得(7b)。(7b)可与烯丙基溴在NaH作用下生成(7c),再依次经OsO4、亚氯酸钠、氨水作用得到目标产物(7)。
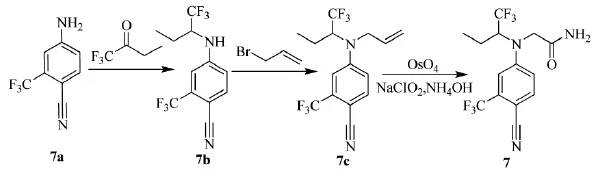
scheme_10
2006年,美国Ligand Pharm公司的Pedram等人[18]制备了一种吡咯异喹啉衍生物,可调节雄激素受体的活性,预防和治疗雄激素受体介导的疾病,如痤疮、消耗性疾病、多毛症、性腺功能减退症、骨质疏松等。三氟丁酮可合成吡咯异喹啉衍生物(8),具体路线见Scheme_11。原料(8a)是由6-氨基-4-氯喹啉-2-酮与亚硝酸钠在浓盐酸中制备得到。在(8a)的粗制品中再加入三氟丁酮,以乙醇为溶剂,回流2 h,冷却后过滤,再将沉淀以色谱法分离区域异构体得到目标产物吡咯异喹啉衍生物(8)。
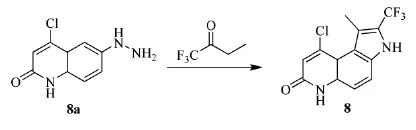
scheme_11
2.1.4 制备蛋白激酶抑制药物
2006年,英国Astex Therapeutics的Berdini等人[19]发明了一种吡唑和咪唑为核心的化合物(主要结构如9所示),抑制或调节细胞周期蛋白依赖激酶(CDK)、糖原合酶激酶(GSK)和极光激酶的活性,有效于治疗癌症、病毒感染、慢性炎性疾病等。三氟丁酮可用于合成(9),路线见Scheme_12。首先以三氟丁酮合成3,3-二溴丁酮,收率32%。3,3-二溴丁酮和9a在甲醇氨中生成(9b)。(9b)可经盐酸脱去BOC基后与羧酸(9d)酸胺化,得到具有蛋白激酶抑制活性的(9)。其中羧酸(9d)可更换为其余芳基、烷基羧酸,酸胺化后得到的产物同样具有蛋白激酶抑制活性。
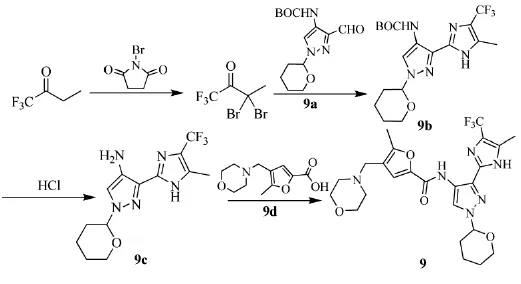
Scheme_12
2006年,加拿大Merck Frosst公司的Gauthier等人[20]制备了一组缩氨酸腈类化合物,可抑制组织蛋白酶K、L、S和B活性。特别可作为蛋白酶K抑制剂,降低骨吸收,治疗骨质疏松症、Paget's病、牙齿损害、骨折等。三氟丁酮可合成缩氨酸腈(10),路线见Scheme_13。
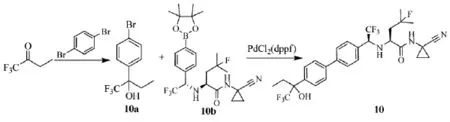
scheme_13
2.1.5 制备其他类型药物
2006年,上海大学的姜沪等人[21]制备了一种含氟米氏酸衍生物,米氏酸基本结构为1,3-二氧六环-4,6-二酮,在一定条件下可生成活泼的中间体和米氏酸负碳离子、米氏酸卡宾和各式烯酮等,可合成药物中间体,还可应用于染料和香料。Scheme_14为三氟丁酮合成米氏酸衍生物2-三氟甲基-2-乙基-1,3-二氧六环-4,6-二酮(11)的路线。
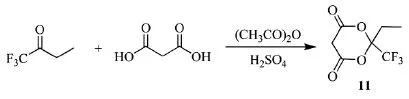
Scheme_14
2007年,美国雅培的Dart等人[22]制备了一类亚胺噻唑衍生物,作为大麻素受体的配体,可用于治疗疼痛,特别是伤害和神经病痛的新型CB2受体调节剂。研究表明,CB2受体配体具有免疫调节和抗炎症性能。三氟丁酮可合成该类亚胺噻唑衍生物(12),路线见Scheme_15。
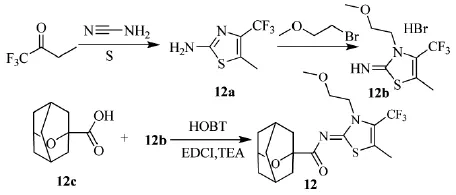
Scheme_15
2013年,新加坡南洋理工大学的Chen等人[23]以N-杂环碳烯(NHC)作为有机催化剂,合成了一种杂环醛,并含有吲哚、苯并呋喃或苯并噻吩等。首先以NHC催化活化2-甲基吲哚-3-甲醛,再与三氟甲基酮或吲哚酮经[4+2]环加成形成包含4元碳或螺环的多环内醋。此类化合物有着很好的生物活性,如抗HIV的依法韦仑,神经激肽1受体抑制剂CJ-17493和抗疟疾的NITD609。如三氟丁酮可在Cs2CO3、(13b)和(13c)的催化下,与2-甲基吲哚-3-甲醛(13a)环加成得到目标产物(13),见Scheme_16,收率为57%,ee 73%。
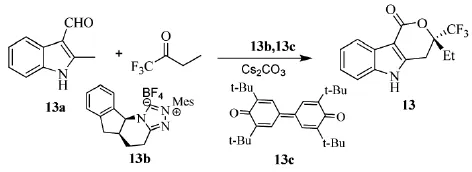
scheme_16
2014年,瑞士罗氏(Roche)公司的Buettelmann等人[24]发明了一类非环化的口恶二唑-噻吩酸胺化合物,类似结构见(14),可作为脂肪酸结合蛋白4和5(FABP 4/5)的抑制剂,治疗和预防Ⅱ型糖尿病、动脉粥样硬化、慢性肾病及癌症。三氟丁酮与(3-环丙基-1,2,4-口恶二唑-5-基)乙腈(14a)制备得到(14b),与1-环戊烯-1,2-二酸醉酸胺化得目标产物口恶二唑-噻吩酸胺(14)。路线见Scheme_17
2.2 制备农药中间体
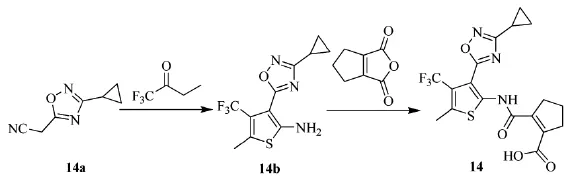
scheme_17
2008年,日本住友化学的Miyazaki等人[3]发明了一种含氟有机硫化合物,对有害节肢动物具有优良防治效果,可用于作物植被,而不会对作物造成药物伤害。三氟丁酮可合成含氟硫化合物(15),具体路线见Scheme_18。膦酸基乙酸三乙醋和三氟丁酮得到3-三氟甲基-2-戊烯酸乙醋(15a)。(15a)于Pd/C催化下加氢后,经H4AlLi还原醋基形成3-三氟甲基-1-戊醇(15b),与对甲基苯磺酸氯反应得到对甲苯磺酸(3-三氟甲基-1-戊)醋(15c)。可依次与三氟丙基磺酸基乙酸甲醋、N-氯代琥珀酸亚胺反应得到具有杀虫药效的含氟硫化合物(15)。其中含氟硫化合物(15)的酸胺基也可脱水成氰基,同样具有除虫药效。
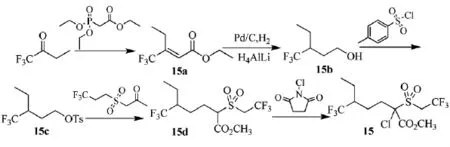
scheme_18
2011年,日本Nihon Nohyaku公司Shigenari等人[25]提供了一种制备1,3-口恶嗪-2-酮衍生物(如16结构)的方法,其可作为除草剂的有效成分,三氟丁酮为原料合成1,3-口恶嗪-2-酮衍生物(16)的具体合成路线见Scheme_19。
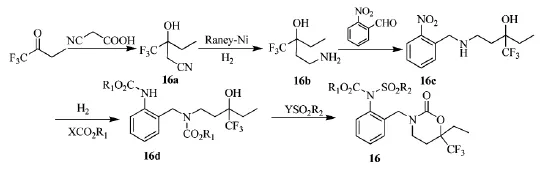
scheme_19
2.3 其他应用
2005年,德国亚琛工业大学的Enders等人[26]合成了各类3-取代基的4,4,4-三氟-2-甲酸氨基-2-丁烯酸乙醋,可用于合成脱氢氨基酸前体:β-三氟甲基取代氨基酸的合成。三氟丁酮可合成3-乙基-4,4,4-三氟-2-甲酸氨基-2-丁烯酸乙醋(17),收率为89%,如Scheme_20所示。
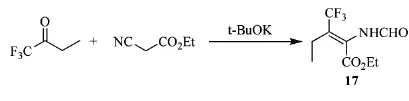
scheme_20
氟化氨基酸与其碳氢结构相比有着更高的疏水性,可用作药物输送产生稳定的脂质体或设计活性强的药物分子。2003年,加州理工学院的Wang等人[27]合成了一类三氟甲基异亮氨酸,能替代异亮氨酸缺陷的大肠杆菌中大部分亮氨酸片段。三氟丁酮可合成D,L-2-氨基-3-三氟甲基戊酸(18),路线见Scheme_21。乙氧甲酸基亚甲基三苯基膦和三氟丁酮得到3-三氟甲基-2-戊酸(18a),收率70%。再在叠氮化钠下生成(18b),加氢将叠氮基还原成氨基,水解得到目标产物D,L-2-氨基-3-三氟甲基戊酸(18)。
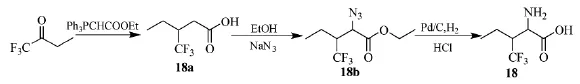
Scheme_21
3 展望
三氟丁酮应用广泛,可合成各类含三氟甲基的吡咯、吡唑、三唑、氨基酸等,用于合成呼吸系统疾病药物、神经系统疾病药物、激素调节剂、蛋白激酶抑制剂等,还可合成杀虫剂、除草剂等农药,在医药、农药、生物和其它工业化学品合成中有着广泛的应用。
[1]Burdon J,McLoughlin V C R.The sodium-promoted Claisen ester condensations of ethyl perfluoroalkanecarboxylates[J]. Tetrahedron,1964,20(10):2163-2166.
[2]龚跃法,徐绍芳.三氟甲基酮化合物的简便合成[J].化学试剂,1995,17(5):313-313.
[3]Miyazaki H.Organic sulfur compound and its use for controlling harmful arthropod:WO,2008143332[P].2008-11-27.
[4]Ogawa H,Asai T.Method for preparation of(trifluoromethyl)alkyl ketone:JP,2011190216 A[P].2011-09-29.
[5]胡正,周强,耿为利.一种三氟甲基酮的制备方法:CN,103224447[P].2013-07-31.
[6]Cheng G,Xia B,Wu Q,et al.Chemoenzymatic dynamic kinetic resolution of α-trifluoromethylated amines:influenceof substitutions on the reversed stereoselectivity[J].RSC Advances,2013,3(25):9820-9828.
[7]Gareau Y,Juteau H,Mackay B D,et al.7-(1,3-Thiazol-2-yl)thio-coumarinderivativesandtheiruseas leukotriene biosynthesis inhibitors:WO,2004108720[P]. 2004-12-16.
[8]Ouellet S G,Gauvreau D,Cameron M,et al.Convergent,fit-for-purpose,kilogram-scale synthesis of a 5-lipoxygenase inhibitor[J].Org.Process.Res.Dev.,2012,16(2): 214-219.
[9]Grimm E L,Ducharme Y,Frenette R,et al.Novel pharmaceutical compounds:US 20080188521[P].2008-08-07.
[10]Hutchinson J H,Seiders T J,Stearns B A,et al.Tricyclic inhibitors of 5-lipoxygenase:US 20070173508[P].2007-07-26.
[11]Li L,Berthelette C,Chateauneuf A,et al.Potent and selective 5-LO inhibitor bearing benzothiophene pharmacophore:Discovery of MK-5286[J].Bioorg.Med.Chem. Lett.,2010,20(24):7440-7443.
[12]Roppe J R,Parr T,Stearns B A,et al.Indolizine inhibitors of 5-lipoxygenase:WO,2011038097[P].2011-03-31.
[13]Hutchinson J H,Roppe J R,Parr T A.et al.Inhibitors of 5-lipoxygenase:WO,2011109679[P].2011-09-09.
[14]Fuchs K,Dorner-Ciossek C,Eickmeier C,et al.Pyrazolopyrimidinones and their use for the treatment of CNS disorders:WO,2010026214[P].2010-03-11.
[15]Giovannini R,Dorner-Ciossek C,Eickmeier C,et al.New compoundsforthetreatmentofCNSdisorders:US,20110082137[P].2011-04-07.
[16]Bungard C J,Converso A,De Leon P,et al.Quinoline carboxamideandquinolinecarbonitrilederivativesas mGluR2-negative allosteric modulators,compositions,and their use:WO,2013066736[P].2013-05-10.
[17]Turnbull P S,Cadilla R,Cowan D J,et al.Aniline derivatives as selective androgen receptor modulators:WO,2005085185[P].2005-09-15.
[18]Pedram B,Van Oeveren C A,Zhi L,et al.Androgen receptor modulator compound and methods:WO,2006138347[P].2006-12-28.
[19]Berdini V,O'Brien M A,Navarro E F,et al.Pyrazole derivativeshavingkinasemodulatingactivity:WO,2006070202[P].2006-07-06.
[20]Gauthier J Y,Li C S,Mellon C,et al.Cathepsin cysteine protease inhibitors:US,20060111440[P].2006-07-06.
[21]姜沪,章建民,杜蔚琼.含氟米氏酸衍生物及其制备方法:CN,1775773[P].2006-05-24.
[22]Dart M J,Carroll W A,Florjancic A S,et al.Novel compounds as cannabinoid receptor ligands and uses thereof: WO,2007140439[P].2007-12-06.
[23]Chen X,Yang S,Song B-A,et al.Functionalization of benzylic C(sp3)-H bonds of heteroaryl aldehydes through N-heterocyclic carbene organocatalysis[J].Angew.Chem. Int.Ed.,2013,52(42):11134-11137.
[24]Buettelmann B,Ceccarelli S M,Kuehne H,et al.Non-annulated thienyl amides as inhibitors of fatty acid binding protein(FABP)4 and/or 5:WO,2014040938[P].2014-03-20.
[25]Shigenari T,Mori M,Hino T,et al.Method of producing 1,3-oxazin-2-one derivatives:JP,2011195490[P].2011-10-06.
[26]Enders D,Chen Z X,Raabe G,et al.Stereoselective synthesis of 3-substituted ethyl(Z)-4,4,4-trifluoro-2-formylamino-2-butenoates[J].Synthesis,2005,(2):306-310.
[27]Wang P,Tang Y,Tirrell D A,et al.Incorporation of trifluoroisoleucine into proteins in vivo[J].J.Am.Chem.Soc.,2003,125(23):6900-6906.
Synthesis and Application of 1,1,1-Trifluoro-2-butanone
JIN Hang-dan,DAI Jia-liang,XU Wei-guo
(Zhejiang Chemical Industry Research Institute Co.,Ltd.,Hangzhou,Zhejiang 310023,China)
It was basically summarized the synthesis of 1,1,1-trifluoro-2-butanone,and its application in medication,pesticide and other spheres.
1,1,1-trifluoro-2-butanone;preparation;application;medication;pesticide
1006-4184(2015)7-0001-09
2015-05-13
金杭丹(1990-),女,浙江人,助理工程师,学士学位,从事含氟精细化学品的研究开发工作。E-mail:jinhangdan@sinochem.com。
