肿瘤间质比及肿瘤浸润性淋巴细胞对晚期结直肠癌的预后价值
2015-11-23张溪胡柏来吕震马广贞陈丽荣
张溪胡柏来吕震马广贞陈丽荣
·临床研究与应用·
肿瘤间质比及肿瘤浸润性淋巴细胞对晚期结直肠癌的预后价值
张溪①胡柏来①吕震②马广贞③陈丽荣①
目的:研究结直肠癌肿瘤间质比(tumor-stroma ratio,TSR)及肿瘤浸润性淋巴细胞(tumor-infiltrating lymphocytes,TIL)与结直肠癌患者的预后相关性。方法:收集浙江大学医学院附属第二医院病理科2007年1月至2009年12月手术切除的原发性Ⅱ、Ⅲ期结直肠癌218例病理资料进行回顾性分析,通过HE染色评估肿瘤组织中间质成分所占比例及淋巴细胞浸润情况,并分析不同分组对患者预后生存的影响。结果:218例Ⅱ、Ⅲ期结直肠癌患者中低TSR组总体生存率明显高于高间质组(P<0.05)。TSR与各项临床特征及病理指标,如性别、年龄等无关(P>0.05)。TSR及TIL均为Ⅱ、Ⅲ期结直肠癌患者的独立预后因子。高淋巴细胞浸润组患者总体生存率明显高于低淋巴细胞浸润组患者,在低间质组中高淋巴细胞浸润组的患者总体生存率高于低淋巴细胞浸润组患者(P<0.05)。结论:肿瘤间质比及肿瘤浸润性淋巴细胞对结直肠癌预后均相关,在常规病理诊断中通过对这两项指标的综合评估,可作为辅助指标对结直肠癌患者的预后预测、临床治疗选择提供依据。
结直肠癌 肿瘤间质比 肿瘤浸润性淋巴细胞 预后
1Department of Pathology,the Second Affiliated Hospital of Zhejiang University School of Medicine,Hangzhou 310009,China;
2Division of Hepatobiliary and Pancreatic Surgery,Department of Surgery,the First Affiliated Hospital of Zhejiang University School of Medicine,Hangzhou 310009,China;
3Department of Pathology,the Second People's Hospital of Liaocheng Affiliatedto Taishan Medical College,Liaocheng 252601,China
随着经济的发展、人们生活方式的转变,结直肠癌的发病率逐年增多,目前其发病率已在恶性肿瘤中居第三位,死亡率第五位[1]。目前,国内外仍采用TNM分期对大肠癌的浸润程度、淋巴结转移、远处转移情况作出评估,指导临床治疗手段。然而事实上,相同分期的患者临床预后也可能极大不同,病理特征可能是造成这种差别的重要原因之一。
癌细胞周围的肿瘤间质成分起着支持和营养肿瘤实质的作用,为肿瘤生长所必须,在肿瘤的生物学行为中发挥着重要作用。肿瘤间质微环境可直接影响肿瘤细胞的黏附、迁移、增殖、分化、侵袭等生物学行为,与此同时,肿瘤间质又直接或间接受到肿瘤细胞的影响与调节[2]。近年来肿瘤间质比(tumor-stroma ratio,TSR)在结直肠癌、乳腺癌等多种恶性肿瘤中
的预后作用逐渐受到关注和证实[3-4]。肿瘤浸润性淋巴细胞(tumor-infiltrating lymphocytes,TIL)是肿瘤微环境中一类重要细胞,国内外已有大量文献报道了肿瘤浸润性淋巴细胞的抗肿瘤作用。本研究重点分析肿瘤间质比及淋巴细胞浸润情况与Ⅱ、Ⅲ期结直肠癌患者预后之间的关系。
1 材料与方法
1.1一般资料
收集浙江大学医学院附属第二医院病理科2007年1月至2009年12月手术切除的原发性Ⅱ、Ⅲ期结直肠癌标本218例,其中男性145例,女性73例;男女比例1.9:1。患者年龄平均62.1(25~86)岁。按照UICC分期委员会提出的TNM分期标准,分为Ⅱ期107例(49.1%),Ⅲ期111例(50.9%)。所有病例均未进行术前放化疗(表1)。本研究排除多发性肿瘤、复发性肿瘤、非肿瘤性死亡病例、生存时间<3个月的病例、微乳头状癌、锯齿状腺癌等少见类型结直肠癌病例。

表1 Ⅱ、Ⅲ期结直肠癌TSR与临床病理特征的关系Table 1Correlations between TSR and clinicopathologic features in stagesⅡandⅢcolorectal cancer
1.2方法
1.2.1肿瘤间质比判定采用双盲法由2名未知患者信息的病理医生对实验结果根据Mesker等[5]提出的方法进行判定:将原发肿瘤浸润最多的部位切取制作成5 μm常规HE病理切片。在低倍镜下(×40)选取肿瘤浸润最明显的区域,然后在高倍镜下(×100)判定单视野内肿瘤所占该视野的百分比(carcinoma percentage,CP),而该视野范围四周均应有肿瘤细胞浸润。每个视野的肿瘤比例以10%为区间值(如10%、20%、30%等),尽量避开坏死或黏液区域。通过评估视野内肿瘤所占比,可以得出该视野内间质所占百分比(stroma percentage,SP)(如某一视野内CP值为30%,则该视野内SP值为70%)。选取至少2个视野进行评估,取SP最高值作为终值。肿瘤组织中SP≤50%为低间质组,SP>50%为高间质组(图1)。对于初步评估SP介于40%~60%的样本,通过对比相邻腺管间间质距离与腺管的宽度进行评估:若腺管间间质距离大于腺管宽度,则为高间质;若腺管间间质距离小于腺管宽度,则为低间质。
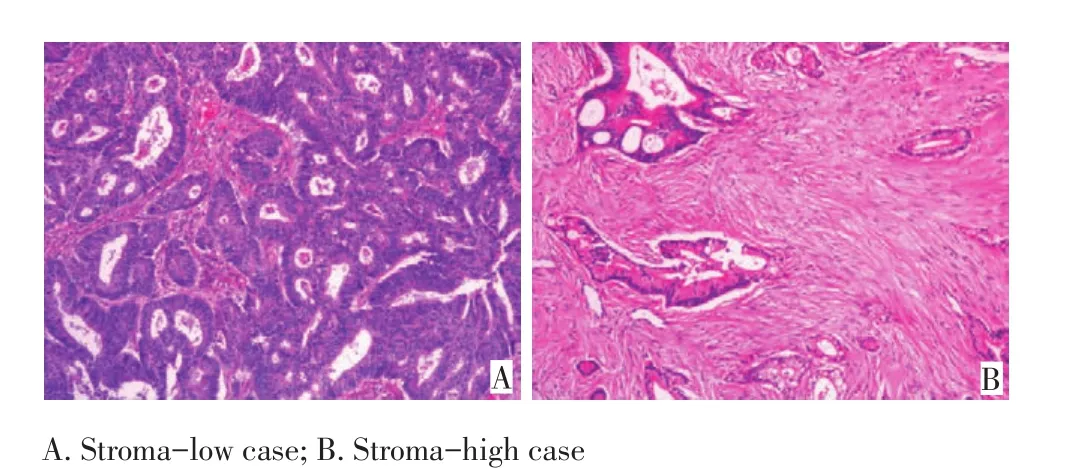
图1 结直肠癌不同肿瘤间质比(H&E×100)Figure 1Different TSR of colorectal cancer(H&E×100)
1.2.2淋巴细胞浸润情况判定实验结果采用Huh等[6]的判定方法:在显微镜下观察HE病理切片,在肿瘤浸润最明显的区域将TIL按浸润程度分为4级:0级:无淋巴细胞反应;1级:可观察到散在淋巴细胞;2级:可观察到中度淋巴细胞反应或淋巴细胞带状浸润;3级:大量淋巴细胞浸润,破坏肿瘤细胞的连续性。然后根据浸润情况的不同将病例分为低TIL组(0~1级)和高TIL组(2~3级)(图2)。
1.2.3随访部分病例由浙江大学医学院肿瘤研究所提供完整临床随访资料,其余病例通过查阅病案室档案或电话的方式获得患者的预后资料,随访至2014年2月28日或患者死亡,随访率为85.7%。

图2 结直肠癌中肿瘤浸润性淋巴细胞(H&E×100)Figure 2Tumor-infiltrating lymphocytes in colorectal cancer(H&E×100)
1.3统计学方法
应用SPSS 20.0统计分析软件,计数资料用Pearson卡方检验,患者预后分析采用Cox比例风险模型单因素和多因素分析,生存曲线采用Kaplan-Meier法绘制,组间差异采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1患者基本病理特征
218例结直肠癌中高间质组58例(26.6%),低间质组160例(73.4%)。TSR在性别、年龄、肿块部位、肿块大小、淋巴细胞浸润、T分期、淋巴结转移、脉管浸润、神经侵犯、临床分期间差异无统计学意义(P>0.05,表1)。根据对淋巴细胞浸润情况的判定结果,218例结直肠癌中168例(77.1%)为低TIL组,50例(22.9%)为高TIL组。
2.2TSR、TIL与结直肠癌预后关系
对218例结直肠癌患者随访至2014年2月28日或患者死亡,高间质组28例死亡(48.3%),中位生存时间为54.0个月;低间质组46例死亡(28.8%),中位生存时间为60.5个月。Kaplan-Meier生存分析显示,两组结直肠癌患者的总体生存时间有显著性异(χ2=9.730,P=0.002,图3)。低TIL组与高TIL组患者的中位生存时间分别为60.8、75.3个月,两组结直肠癌患者的总体生存时间间有显著性差异(χ2=6.772,P=0.009,图4)。Cox单因素分析显示,TSR、TIL、淋巴结转移、临床分期为肠癌患者的生存相关因素(表2)。Cox多因素分析显示,TSR、TIL与淋巴结转移为结直肠癌患者的独立预后因素,而性别、年龄、肿块部位、肿块大小、T分期、脉管浸润、神经侵犯并非结直肠癌独立预后因素(表3)。

图3 不同TSR患者的Kaplan-Meier生存分析Figure 3Kaplan-Meier survival curves of OS of stroma-high versus stroma-low in colorectal cancer
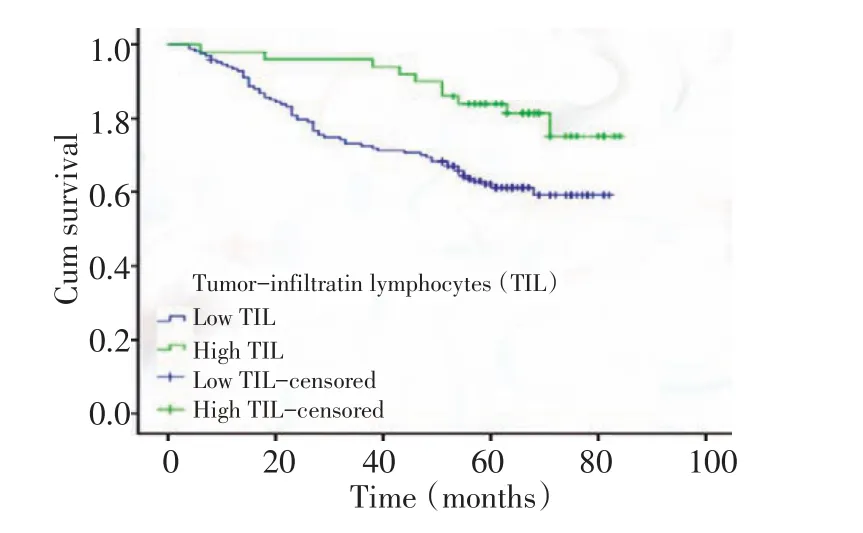
图4 不同TIL浸润的患者Kaplan-Meier生存分析Figure 4Kaplan-Meier survival curves of OS of different tumor-infiltrating lymphocytes groups in colorectal cancer
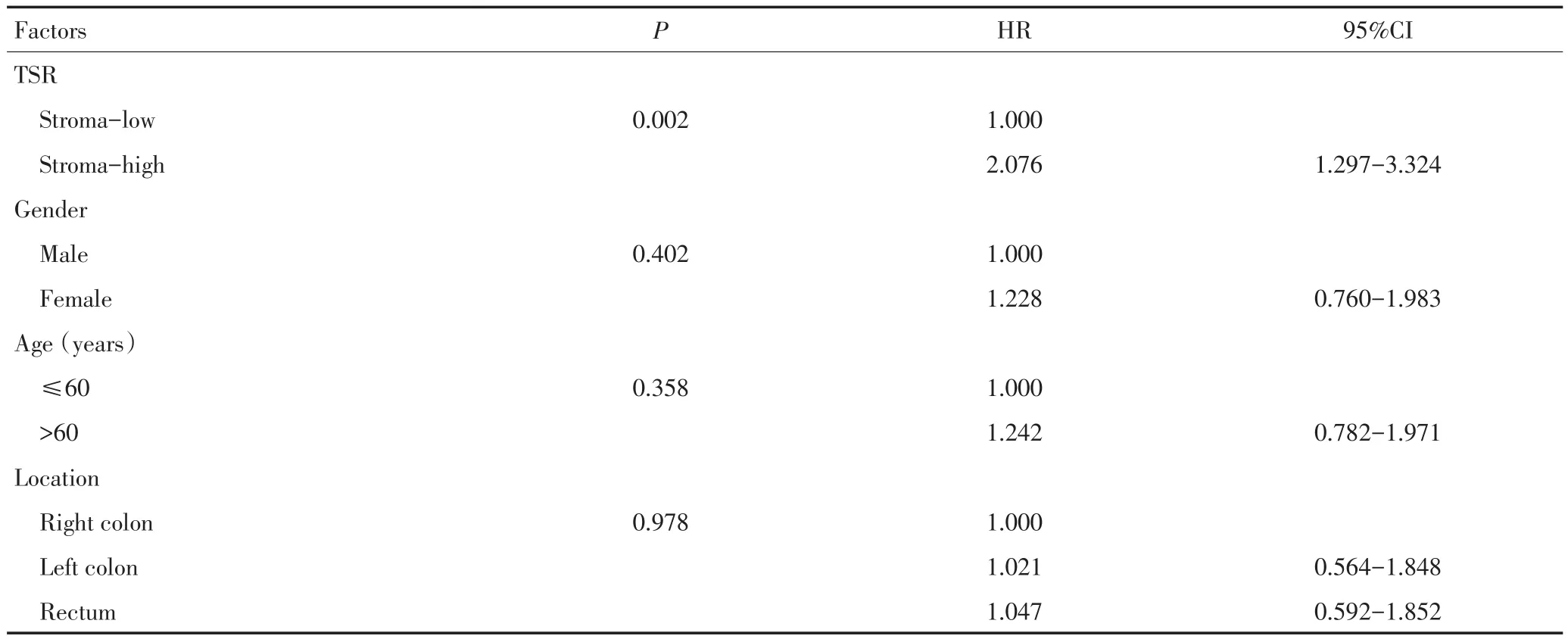
表2 Ⅱ、Ⅲ期结直肠癌患者预后Cox单因素分析Table 2Univariate Cox regression analysis of prognostic factors in stagesⅡandⅢcolorectal cancer
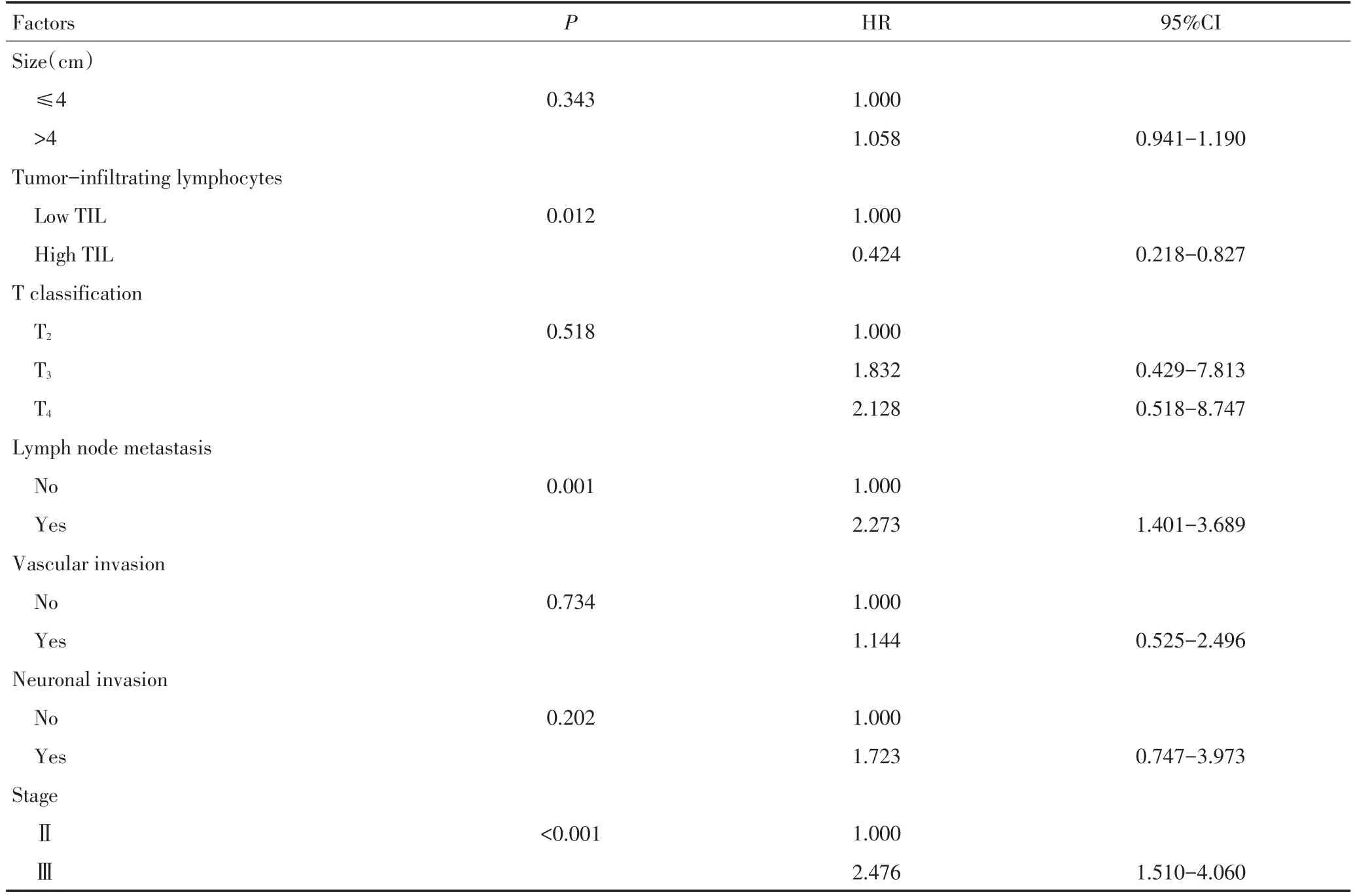
表2 Ⅱ、Ⅲ期结直肠癌患者预后Cox单因素分析(续表2)Table 2Univariate Cox regression analysis of prognostic factors in stagesⅡandⅢcolorectal cancer

表3 Ⅱ、Ⅲ期结直肠癌患者预后Cox多因素分析Table 3Multivariate Cox regression analysis of prognostic factors in stagesⅡandⅢcolorectal cancer
2.3TSR与TIL对结直肠癌的预后作用
将218例结直肠癌患者分为3组:高危组:全部高间质组病例;中间组:同时属于低间质组和低TIL组的病例;低危组:同时属于低间质组和高TIL组的病例(表4)。3组中位生存时间分别为53.2、64.8、77.7个月。Kaplan-Meier生存分析显示,各危险组结直肠癌患者的总体生存时间之间有显著性差异(χ2=13.656,P=0.001,图5)。
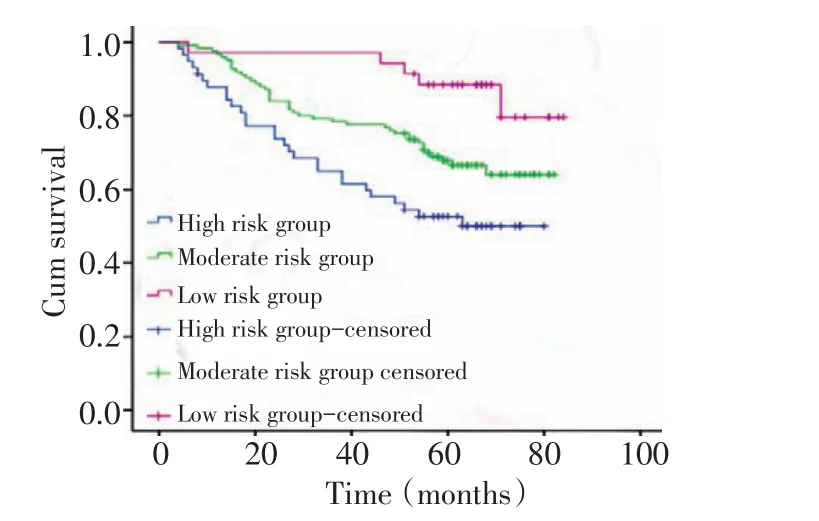
图5 不同风险组(TSR+TIL)的患者Kaplan-Meier生存分析Figure 5 Kaplan-Meier survival curves of OS in different risk groups in colorectal cancer
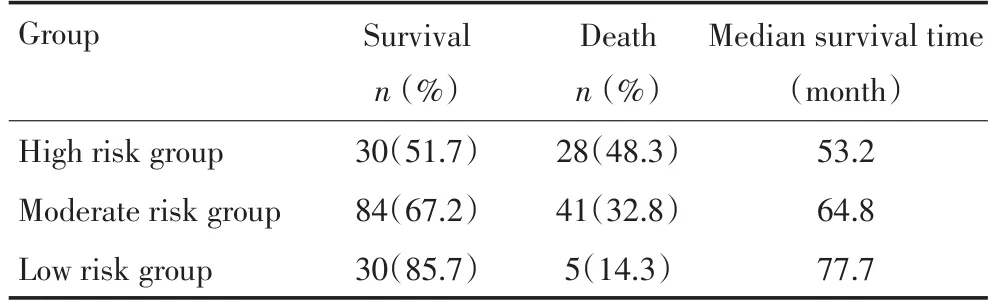
表4 基于TSR与TIL的风险分组对结直肠癌的预后影响Table 4Risk grouping based on TSR and TIL for the prognosis of colorectal cancer
3 讨论
肿瘤微环境中的细胞由肿瘤细胞、原有的以及浸润的非肿瘤细胞构成,肿瘤细胞与非肿瘤细胞通过多种细胞因子、信号通路等相互作用,建立复杂的调控机制[7]。在这一过程中,包括淋巴细胞在内的多种免疫细胞也发挥着重要的作用[8]。
近年来国内外对肿瘤间质在肿瘤的发生、侵袭、转移过程中所发挥的作用,以及肿瘤间质与患者临床预后的关系不断有了新的认识。Mesker等[3,5]回顾性观察分析了肿瘤组织中肿瘤成分所占比(carcinoma percentage,CP)及间质成分所占比(stroma percentage,SP)与结直肠癌的预后关系,并以50%为CP的cut-off值,结果显示低CP患者的总体生存率和无病生存率均低与高CP患者,首先提出TSR为结直肠癌的独立预后因子。Huijbers等[9]通过对710例原发性结直肠癌进行分析,同样以50%为界将所有病例分为高间质(stroma high)及低间质(stroma low)两组,结果显示高间质患者的总体生存率及无病生存率较低间质患者明显降低。此研究710例结直肠癌患者中433例高危患者接受过术前化疗(chemotherapy treatment,CT),通过对CT亚组的分析进而发现对于接受过术前化疗的高危患者,高间质同样与患者的不良预后相关,总体生存率及无病生存率明显降低(P<0.05)。West等[10]通过数字切片技术分析结直肠癌中TSR与患者预后的关系,也得出类似的结论。在随后的文献研究结果显示TSR不仅与结直肠癌患者的预后密切相关,对乳腺癌、宫颈癌、食管腺癌等多种实体肿瘤同样具有预后作用[4,11-12]。本研究通过对218例Ⅱ、Ⅲ期结直肠癌患者手术标本HE切片观察分析,结果显示高间质组患者总体生存率明显低于低间质组,TSR可以作为结直肠癌的独立预后因子,与以往的研究结果相一致。
肿瘤间质是由一系列细胞,包括成纤维细胞/肌成纤维细胞、免疫细胞、胶质细胞、上皮细胞、肥大细胞等与细胞外基质(EMC)及细胞外分子所组成。这些非肿瘤细胞间的相互作用、直接或间接与肿瘤细胞间相互作用激活各种分子信号通路,不仅使其自身获得异常表型或功能转化,同时也使肿瘤间质发生功能改变,从而促进肿瘤的发生发展[8]。肿瘤相关纤维母细胞(cancer associated fibroblasts,CAFs)是肿瘤间质的重要成分,参与肿瘤细胞外基质合成,并可以通过多种细胞因子、生长因子、炎症介质促进上皮细胞增殖,调节肿瘤细胞的生物活性,在肿瘤的发生、侵袭、转移中发挥重要作用[13-14]。已在多种肿瘤组织中被证实,肿瘤纤维母细胞表型与正常纤维母细胞相比CD34表达缺失而α-SMA表达升高。有研究显示纤维母细胞的突变早于上皮细胞突变而获得致瘤性,促进上皮细胞恶性转化,而肿瘤的发生又能够反过来刺激周围正常纤维母细胞发生表型改变,最终二者共同促进肿瘤发生发展[15-16]。研究发现CAFs不仅可以刺激肿瘤细胞增殖,还可以通过HGF、TGF-β等生长因子参与肿瘤血管生成,增强肿瘤侵袭浸润能力[17]。以上研究结果提示肿瘤间质可以通过CAFs参与肿瘤的侵袭转移过程,这可能是高间质结直肠癌预后不良的重要原因之一。
本研究对肿瘤组织淋巴细胞浸润情况进行分析,结果显示高TIL患者的总体生存率明显高于低TIL患者,提示TIL是Ⅱ、Ⅲ期结直肠癌患者的良好预后因子。将本研究低间质组的患者根据TIL的不同分为低危组(低间质+高TIL)及中间组(低间质+低TIL)与高危组(高间质)患者共同进行生存分析,结果显示低危组患者的总体生存率最高,中间组次之,高危组最低。生存曲线显示在低间质组患者中,高TIL组的患者的总体生存率明显高于低TIL组患者,提示低间质患者的预后差异可能是由淋巴细胞浸润情况不同所引起的。
肿瘤的发生发展也是肿瘤细胞与宿主相互平衡、相互适应的过程。肿瘤细胞通过分泌各种细胞因子如TSP-1、TGF-β、MMP等,可以直接或间接产生免疫耐受和免疫抑制以促进肿瘤的侵袭、转移过程[18]。而在肿瘤组织中及肿瘤浸润边缘出现的炎细胞反应被认为是一种宿主抵抗癌细胞的免疫反应[19],肿瘤间质中的TIL可以识别肿瘤细胞,产生较强的抗肿瘤效应,往往与患者的较高生存率相关[20]。早在1987年肿瘤浸润性免疫细胞已被提出可作为结直肠癌的独立预后因子[21],近年来大量文献报道了肿瘤浸润性免疫细胞在其他肿瘤如乳腺癌、卵巢癌中的预后作用[22-23]。有研究显示CD3+、CD8+T细胞在肿瘤免疫调节中发挥着重要作用,TIL细胞杀伤肿瘤细胞主要通过CTL细胞的激活[24-25]。也有国内外研究认为TIL凭借其抗肿瘤作用有可能成为免疫治疗中新的高效抗瘤效应细胞[26-27]。
综上TSR、TIL均为结直肠癌的独立预后因子,两项参数的综合分析对结直肠癌患者有较强的预后指导作用。肿瘤间质中各种成分间的相互作用与制衡形成了复杂的调控网络,目前对TSR与TIL之间的具体作用仍未完全清楚,若将其作为一项结直肠癌病理诊断的常规辅助参数,可为临床治疗方案制定、预后判断提供更加完善、更加准确的依据。
1You WC,Jin F,Devesa S,et al.Rapid increase in colorectal cancer rates in urban Shanghai,1972-97,in relation to dietary changes[J].
J Cancer Epidemiol Prev,2002,7(3):143-146.
2Takayama T,Miyanishi K,Hayashi T,et al.Colorectal cancer:genetics of development and metastasis[J].J Gastroenterol,2006,41(3):185-192.
3Mesker WE,Junggeburt JM,Szuhai K,et al.The carcinoma-stromal ratio of colon carcinoma is an independent factor for survival compared to lymph node status and tumor stage[J].Cell Oncol,2007,29(5):387-398.
4EF,SV JK G”.”WB O/FT+(”W BOEF 7 FM EF”+”FUBM?5 V NPS?T U SPNB ratio in the primary tumor is a prognostic factor in early breast cancer patients,especially in triple-negative carcinoma patients[J]. Breast Cancer Res Treat,2011,125(3):687-696.
5Mesker WE,Liefers GJ,Junggeburt JM,et al.Presence of a high amount of stroma and downregulation of SMAD4 predict for worse survival for stage I-II colon cancer patients[J].Cell Oncol,2009,31(3):169-178.
6Huh JW,Lee JH,Kim HR.Prognostic Significance of tumor-infiltrating lymphocytes for patients with colorectal cancer[J].Arch Surg,2012,147(4):366-71.
7Witz IP.Yin-yang activities and vicious cycles in the tumor microenvironment[J].Cancer Res,2008,68(1):9-13.
8Li HC,Fan XL,Houghton J.Tumor microenvironment:The role of the tumor stroma in cancer[J].J Cell Biochem,2007,101(4): 805-815.
9)V JK CF ST"”5 PM M FO BBS 3"”W1FM U(8”FUBM?5 I F Q SPQ PSU JPOPGU V-mor-stroma as a strong prognosticator for stage II and III colon cancer patients:validation in the VICTOR trial[J].Ann Oncol,2013,24(1):179-185.
10 West NP,Dattani M,McShane P,et al.The proportion of tumour cells is an independent predictor for survival in colorectal cancer patients[J].Br J Cancer,2010,102(10):1519-1523.
11 Liu J,Liu J,Li JS,et al.Tumor-stroma ratio is an independent predictor for survival in early cervical carcinoma[J].Gynecol Oncol,2014,132(1):81-86.
12 Staal E,Wouters M,van Sandick JW,et al.The stromal part of adenocarcinomas of the oesophagus:Does it conceal targets for therapy[J].Eur J Cancer,2010,46(4):720-728.
13 De Wever O,Demetter P,Mareel M,et al.Stromal myofibroblasts are drivers of invasive cancer growth[J].Int J Cancer,2008,123(10): 2229-2238.
14 Powell DW,Mifflin RC,Valentich JD,et al.Myofibroblasts.I.Paracrine cells important in health and disease[J].Am J Physiol,1999,277(1):C1-C9.
15 Kuperwasser C,Chavarria T,Wu M,et al.Reconstruction of functionally normal and malignant human breast tissues in mice[J].Proc Natl Acad Sci U S A,2004,101(14):4966-4971.
16 Bhowmick NA,Neilson EG,Moses HL.Stromal fibroblasts in cancer initiation and progression[J].Nature,2004,432(7015):332-337.
17 Koyama H,Kobayashi N,Harada M,et al.Significance of tumor-associated stroma in promotion of intratumoral lymphangiogenesis-Pivotal role of a hyaluronan-rich tumor microenvironment[J].Am J Pathol,2008,172(1):179-193.
18 Silzle T,Randolph GJ,Kreutz M,et al.The fibroblast:Sentinel cell and local immune modulator in tumor tissue[J].Int J Cancer,2004,108(2):173-180.
19 Hung K,Hayashi R,Lafond-Walker A,et al.The central role of CD4(+)T cells in the antitumor immune response[J].J Exp Med,1998,188(12):2357-2368.
20 Ropponen KM,Eskelinen MJ,Lipponen PK,et al.Prognostic value of tumour-infiltrating lymphocytes(TILs)in colorectal cancer[J].J Pathol,1997,182(3):318-324.
21 Jass JR.Lymphocytic Infiltration and survival in rectal-cancer[J].J Clin Pathol,1986,39(6):585-589.
22 Mahmoud SMA,Paish EC,Powe DG,et al.Tumor-infiltrating CD8(+)lymphocytes predict clinical outcome in breast cancer[J].J Clin Oncol,2011,29(15):1949-1955.
23 Tomsova M,Melichar B,Sedlakova I,et al.Prognostic significance of CD3+tumor-infiltrating lymphocytes in ovarian carcinoma[J]. Gynecol Oncol,2008,108(2):415-420.
24 Nelson BH.The impact of T-cell immunity on ovarian cancer outcomes[J].Immunol Rev,2008,222:101-116.
25 Sato E,Olson SH,Ahn J,et al.Intraepithelial CD8(+)tumor-infiltrating lymphocytes and a high CD8(+)/regulatory T cell ratio are associated with favorable prognosis in ovarian cancer[J].Proc Natl Acad Sci U S A,2005,102(51):18538-18543.
26 Rosenberg SA,Restifo NP,Yang JC,et al.Adoptive cell transfer:a clinical path to effective cancer immunotherapy[J].Nat Rev Cancer,2008,8(4):299-308.
27 Rosenberg SA,Dudley ME.Adoptive cell therapy for the treatment of patients with metastatic melanoma[J].Curr Opin Immunol,2009,21(2):233-240.
(2014-12-25收稿)
(2015-01-20修回)
(编辑:郑莉)
Prognostic values of tumor-stroma ratio and tumor-infiltrating lymphocytes in stagesⅡandⅢcolorectal cancer
Xi ZHANG1,Bailai HU1,Zhen LV2,Guangzhen MA3,Lirong CHEN1
Lirong CHEN;E-mail:chenlr999@163.com
Objective:To investigate the prognostic values of tumor-stroma ratio and tumor-infiltrating lymphocytes in colorectal cancer.Methods:A total of 218 stageⅡorⅢprimary colorectal cancer patients were analyzed for the tumor-stroma ratio(TSR) and tumor-infiltrating lymphocytes(TIL)by using HE stained histological sections.The relationship between TSR and clinicopathologic variables and the difference in clinical outcomes of different groups were also analyzed.Results:Overall survival rates for the stroma-low group were significantly higher than the stroma-high group in stagesⅡandⅢcolorectal cancer(P<0.05).However,the differences in TSR were not correlated with clinicopathologic features such as gender and age(P>0.05).Overall survival rates of patients with high TIL were significantly higher than patients with low TIL(P<0.05).Patients with high TIL had notable better prognosis than patients with low TIL(P<0.05)in the stroma-low group.Conclusion:TSR and TIL are independent prognostic factors for stagesⅡandⅢcolorectal cancer.The combined estimates of TSR and TIL in routine pathology diagnoses may provide more evidence to predict the prognosis of stagesⅡandⅢcolorectal cancer.
colorectal cancer,TSR,TIL,prognosis

10.3969/j.issn.1000-8179.20142129
①浙江大学医学院附属第二医院病理科(杭州市310009);②浙江大学医学院附属第一医院肝胆胰外科;③泰山医学院附属聊城市第二人民医院病理科
陈丽荣chenlr999@163.com
张溪专业方向为大肠癌的分子机制、早期诊断及个体化治疗。
E-mail:[K V YJ BPYJ”126.com
