产nisin基因工程菌的构建与应用
2015-11-20陈小龙胡永恒周斌
陈小龙,胡永恒,周斌
(1.浙江工业大学发酵工程研究所,浙江杭州310014;2.浙江新银象生物工程有限公司,浙江天台317200)
产nisin基因工程菌的构建与应用
陈小龙1,胡永恒1,周斌2
(1.浙江工业大学发酵工程研究所,浙江杭州310014;2.浙江新银象生物工程有限公司,浙江天台317200)
首先根据nisA与nisI基因序列设计引物,以乳酸乳球菌的基因组为模板通过PCR技术手段获取nisA基因与nisI基因。然后将nisA基因与酶切后的载体pMG36e进行连接,获得了含有nisA基因的环状质粒pMG36e-nisA。pMG36e-nisA-nisI采用相同的方法在pMG36enisA的基础上构建完成,最后再将构建好的质粒导入到乳酸乳球菌中,得到一株阳性转化子AI。发酵产nisin实验结果表明,AI的nisin产量比出发菌株提高了20.07%,因此,AI是一株稳定高产nisin的基因工程菌。
nisin;基因工程;产量
引言
乳链菌肽(nisin)又称乳酸链球菌素,是乳酸乳球菌乳酸亚种某些菌株产生的抗菌肽。nisin对革兰氏阳性菌具有抗菌作用,可抑制一些能够引起食品腐败的细菌和芽孢,因此可用于肉类、酒类、乳类等的防腐。乳酸链球菌素是纯天然防腐剂,采用乳酸菌发酵法生产,进入人体即被酶分解为多种氨基酸,无残留,不产生抗药性,不影响人体内的益生菌,具有广阔的市场效益和经济价值。但是其生产水平较低,成本偏高导致nisin价格始终高于市售的其他防腐剂,这限制了nisin的推广应用[1]。近年来由于分子生物学及其相关技术的发展,国内外学者逐渐开始将目光投向生物技术领域,尝试通过基因工程的方法手段来提高nisin的产量。国内胡红梅、蒋立科等人[2]将nisI基因与强启动子P59一起插入质粒pHMI后电击转化乳酸乳球菌L.lactis NZ9800获取阳性转化子L. lactis NZ9800/pHMI,L.lactis NZ9800/pHMI发酵12 h后对比出发菌株的nisin产量提高了5%。国外有报道通过向nisin Z生产菌L.lactis A164中导入多拷贝基因nisRK、nisFEG来提高nisin Z的产量,结果发现nisRK及nisFEG拷贝数的增加虽在一定程度上影响了菌体的生长,但nisin Z的产量却提高了56%[3]。
乳酸乳球菌本身也是一种革兰氏阳性菌,但因其存在具有对nisin产生免疫的抗性基因nisI和nisFEG,使乳酸乳球菌可防御nisin对自身的毒害作用。前体基因nisA负责合成前乳链菌肽,经过加工修饰,再切除前导肽从而形成成熟的乳链菌肽分子[4]。本研究通过基因工程的手段将nisA与nisI导入nisin生产菌中,以增加nisin前体肽的合成量与其自身抗性水平,从而提高nisin的产量。
1 材料与方法
1.1材料
1.1.1菌种与质粒
E.coli DH5α与质粒pMG36e[5]由本实验室保存;L.lactis与Micrococcus flavus由浙江新银象生物工程有限公司馈赠。
1.1.2培养基与培养条件
E.coli:LB培养基,37℃振荡培养[6]。
L.lactis种子培养基:蛋白胨10.00 g,酵母粉5.00 g,牛肉膏5.00 g,蔗糖15.00 g,K2HPO4· 12H2O 20.00 g,无水硫酸镁0.25 g,加蒸馏水定容至1 000 mL,30℃静置培养。
L.lactis发酵产nisin培养基:蛋白胨25.00 g,酵母粉7.00 g,牛肉膏7.00 g,蔗糖30.00 g,维生素C 0.50 g,Na2HPO4·12H2O 20.00 g,无水硫酸镁0.30 g,加蒸馏水定容至1 000 mL,30℃静置培养。
GM17液体培养基:细菌蛋白胨5.00 g,大豆蛋白胨5.00 g,牛肉膏5.00 g,酵母提取物2.50 g,葡萄糖5.00 g,β-甘油磷酸二钠19.00 g,维生素C 0.50 g,无水硫酸镁0.25 g,30℃静置培养。
M.flavus:S1培养基,30℃静置培养[7]。
1.1.3工具酶和化学试剂
限制性内切酶、Taq酶、T4 DNA连接酶、pMD19-T Simple Vector、琼脂糖凝胶回收试剂盒均购自TaKaRa生物工程公司;nisin标准品由浙江新银象生物工程有限公司馈赠。
1.2DNA操作
1.2.1乳酸乳球菌基因组DNA的小量提取
菌种接种于5 mL种子培养基中,30℃摇床(100 r/min)培养过夜。取1.5~3 mL培养至指数生长后期的培养液,室温5 000 r/min离心5 min,弃上清,用500 μL TE缓冲液洗涤菌体一次,沉淀重新悬浮于50 μL TE中。加入溶菌酶至终浓度10 mg/mL,37℃水浴1 h。加蛋白酶K至终浓度50 μg/mL,混匀后加10%SDS至终浓度为1%,37℃水浴2 h。补充300 μL TE缓冲液,加等体积的酚-氯仿-异戊醇混合液(酚∶氯仿∶异戊醇= 25∶24∶1),混匀,室温放置5~10 min。10 000 r/min离心15 min。取上清液转入另一离心管中,如此2~3次即可。加2倍体积的冷的无水乙醇和1/10体积的3 mol/L NaAc,轻柔颠倒离心管数次混匀,出现絮状沉淀,室温放置5 min。10 000 r/min离心5 min,收集DNA。沉淀用75%的乙醇洗涤两次。室温干燥5~10 min。加入50 μL TE或双蒸水溶解DNA。用终浓度为50 μg/mL的RNaseA 37℃水浴30 min,即得基因组DNA粗提取液,-20℃保藏[8]。
1.2.2碱裂解法提取大肠杆菌质粒
离心收集1.5 mL过夜培养的含目标质粒的大肠杆菌,用100 μL冰预冷的碱裂解液I重悬菌体,剧烈振荡1 min,冰上放置5 min。每管菌悬液中加入200 μL新配制的碱裂解液Ⅱ,快速颠倒混匀,冰置5 min。加入150 μL用冰预冷的碱裂解液III,反复颠倒使溶液III在细菌裂解物中均匀分散,之后冰置10~15 min。4℃,12 000 r/min离心5 min,将上清液转移至新离心管中。加入等体积的酚-氯仿-异戊醇混合液(酚∶氯仿∶异戊醇= 25∶24∶1),振荡混匀,4℃,12 000 r/min离心5 min,将上清液转移至新的离心管中。加2倍体积的无水乙醇,振荡混合,室温放置30 min沉淀核酸。4℃,14 000 r/min离心10 min,收集沉淀的核酸,吸去上清液,用一次性吸头除去管壁上的液滴。沉淀加入1 mL 70%乙醇并将盖紧的离心管颠倒数次,4℃,12 000 r/min离心5 min,除去所有的上清。室温挥发酒精5~10 min。用50 μL TE重新溶解核酸,贮存于-20℃条件下[9]。
1.2.3乳酸乳球菌质粒DNA的提取
取过夜培养基因工程菌菌液1.5 mL,2 000 r/ min离心5 min收集菌体。加入400 μL冷冻的丙酮溶液悬浮清洗菌体,离心收集菌体。加200 μL溶液I,37℃水浴15 min,缓慢颠倒几次使匀质化。加入300 μL溶液II,轻轻混匀后室温放置3 min加入170 μL预冷溶液III,缓慢颠倒混匀后室温放置3 min,间隔翻转混匀。加入500 μL新鲜的苯酚,缓慢颠倒混匀,10 000 r/min离心5 min,收集上清液至一新离心管中。加入600 μL酚-氯仿-异戊醇混合液(酚∶氯仿∶异戊醇=25∶24∶1)混合液,混匀,10 000 r/min离心5 min,收集上清液至一新离心管中。加入600 μL异戊醇,混匀,冰浴15 min,10 000 r/min离心15 min。用70%酒精清洗沉淀两次后,干燥沉淀,将沉淀溶于20 μL蒸馏水中[10-11]。
1.2.4大肠杆菌感受态细胞的制备
从新鲜的平板上挑取E.coli DH5α单菌落,接种于10 mL LB液体培养基中,37℃下摇床180 r/min过夜培养(12~14 h)。取过夜菌液2.5 mL接种于50 mL LB液体培养基中。37℃下摇床培养1~1.5 h,当OD600达到0.35~0.40时,迅速冰浴10 min,使菌液冷却至0℃。取1.5 mL菌液,4℃,5 000 r/min离心5 min,弃去上清液,收集菌体。加入500 μL冰预冷的0.1 mol/L CaCl2溶液,轻吹成悬液,冰浴30 min。4℃,5 000 r/min离心5 min,弃去上清。加100 μL冰预冷的0.1 mol/L CaCl2溶液,轻轻悬浮沉淀,放置在冰上于4℃冰箱中放置2~24 h效果最好,转化效率最高。
1.2.5乳酸乳球菌感受态细胞的制备
从新鲜的平板上挑取乳酸乳球菌单菌落,接种于GM17液体培养基中,30℃静置培养过夜。取过夜菌接入含有1.5%~3.0%甘氨酸并预热的GM17液体培养基中(甘氨酸单独灭菌,然后采用无菌操作与灭菌后的GM17混合)稀释50~100倍。30℃静置培养至OD600达到0.20~0.70时,取出培养物,迅速冰浴15~30 min,期间缓慢均匀摇动以保证培养物充分冷却。培养液转移至冰上预冷的离心管中。4℃,5 000 r/min离心10 min,收集菌体。加入等体积预冷的洗液I,轻吹成悬液,冰浴30 min。4℃,5 000 r/min离心15 min,弃去上清。加等体积预冷的洗液II,悬浮沉淀,4℃,5 000 r/min离心15 min,弃上清。再加入等体积预冷的洗液I,轻吹成悬液清洗,4℃,5 000 r/min离心15 min,弃去上清。将沉淀重悬于1%培养液体积的洗液I中。冷冻贮存:每份60~80 μL分装,-80℃贮存备用[12]。
1.2.6乳链菌肽前体结构基因nisA与免疫基因nisI的克隆
根据nisA与nisI的基因序列结合pMG36e的开放阅读框MCS处的酶切位点进行引物设计[13],引物与PCR反应参数如下:
上游引物nisA-F:5′-TCCCCCGGGATGAGTACAAAAGATTTTAAC-3′
下游引物nisA-R:5′-GCTCTAGATTATTTGCTTACGTGAATAC-3′
PCR反应参数:94℃,2 min;94℃,45 s;55℃,30 s;72℃,15 s;35个循环,72℃,10 min。
上游引物nisI-F:5′-ACGCGTCGACATGAGAAGATATTTAATAC-3′
下游引物nisI-R:5′-AACTGCAGCTAGTTTCCTACCTTCGTTGC-3′
PCR反应参数:94℃,2 min;94℃,45 s;55℃,30 s;72℃,55 s;35个循环,72℃,10 min。
1.2.7重组共表达载体pMG36e-nisA-nisI的构建
将nisA基因与T载体连接,对连接成功的含有目的片段的T载体进行双酶切以暴露目的基因的粘性末端,同时对质粒pMG36e采用相同的限制性内切酶双酶切以暴露与目的基因互补的粘性末端。将目的基因与酶切后的载体进行连接,即可获得含有目的基因的环状质粒pMG36e-nisA。pMG36e-nisA-nisI采用相同的方法在pMG36enisA的基础上构建完成,构建流程见图1。
1.2.8电击转化
取1 μL质粒DNA与40 μL的感受态细胞悬浮液混合,移入电转化杯中,冰浴10 min,设置电击参数(电场强度10 kV/cm,电阻400 Ω),然后将转化杯置于电击槽中电击。电击完毕后立即向杯中加入960 μL的种子培养基,冰上放置5min,30℃静置培养2 h,涂布于含有红霉素的抗性平板上,30℃下培养36~48 h。

图1 pMG36e-nisA-nisI重组载体的构建
1.3重组菌及对照菌株生长曲线的测定
由于高产菌株细胞内有外源基因的表达,其生长规律会发生改变,为了了解其生长规律,必须测定生长曲线,具体操作如下:菌株在平板上培养30 h,挑取单菌落到种子培养基,30℃静置培养12 h。以1%的接种量转接到两组平行的发酵培养基中30℃静置培养。每1 h取一次样,在600 nm处测OD值,取两个OD值的平均值,记为A600 nm[13]。
1.4重组菌与对照菌对nisin的抗性水平测定
吸取培养至对数生长期的乳酸乳球菌菌悬液100 μL,涂布在含有不同浓度梯度nisin的固体培养基上,30℃培养,观察菌体生长情况[14]。梯度变化的nisin浓度为:9 000、9 500、10 000、10 500、11 000 IU/mL。
1.5重组菌与对照菌发酵液中nisin效价的测定
从平板上挑取单个菌株至装有50 mL种子培养基的摇瓶中,30℃培养12 h后吸取1.5 mL至另一瓶50 mL发酵培养基内,30℃发酵16 h。发酵6 h的时候用5 mol/L的NaOH将发酵液pH调至6.5,随后每2 h一次调pH至6.5,直到发酵结束。发酵结束后用6 mol/L HCl溶液将发酵液pH调至2.0,沸水中煮10 min,离心取上清。通过琼脂扩散法测定上清中的nisin效价,具体方法参见中华人民共和国轻工行业标准QB 2397-2007。
2 结果与讨论
2.1Nisin前体基因nisA与抗性基因nisI的扩增
以乳酸乳球菌基因组为模板,进行PCR扩增,得到的扩增产物大小在200 bp与750 bp左右,和预期的大小一致(nisA的序列为174 bp,nisI的序列为738 bp)。

图2 PCR扩增得到的nisA、nisI片段
2.2重组质粒pMD19-nisA与pMD19-nisI的鉴定
将PCR片段分别进行切胶回收,经胶回收试剂盒纯化处理后与载体pMD19-T simple vector连接热激转化至E.coli DH5a。培养16 h后挑取白色菌落进行PCR鉴定。根据菌落PCR鉴定结果挑取菌落置于含氨苄青霉素终浓度为150 μg/ mL的液体LB中过夜培养。提取质粒进行双酶切鉴定,结果如图3。从图3中可以看出,对阳性菌质粒进行双酶切后在200 bp与750 bp处出现了目的条带。这说明nisA、nisI已插入到T载体pMD19-T simple vector中,将两个重组子分别命名为pMD19-nisA与pMD19-nisI,并送交华大基因公司测序,测序结果与NCBI数据库进行比对分析结果匹配率为100%。

图3 pMD19-nisA、pMD19-nisI双酶切电泳结果图
2.3重组质粒pMG36e-nisA与pMG36enisA-nisI的构建
对测序正确的pMD19-nisA用SmaI+XbaI进行双酶切,将nisA片段切胶回收试剂盒纯化处理后与经相同处理的pMG36e质粒过夜连接。连接液热激转化至感受态E.coli JM109中,涂布在含有终质量浓度为250 μg/mL红霉素的LB平板上培养16 h,挑取单克隆转化子经培养后提取质粒进行酶切鉴定,将阳性重组质粒命名为pMG36enisA。酶切鉴定结果见图4。
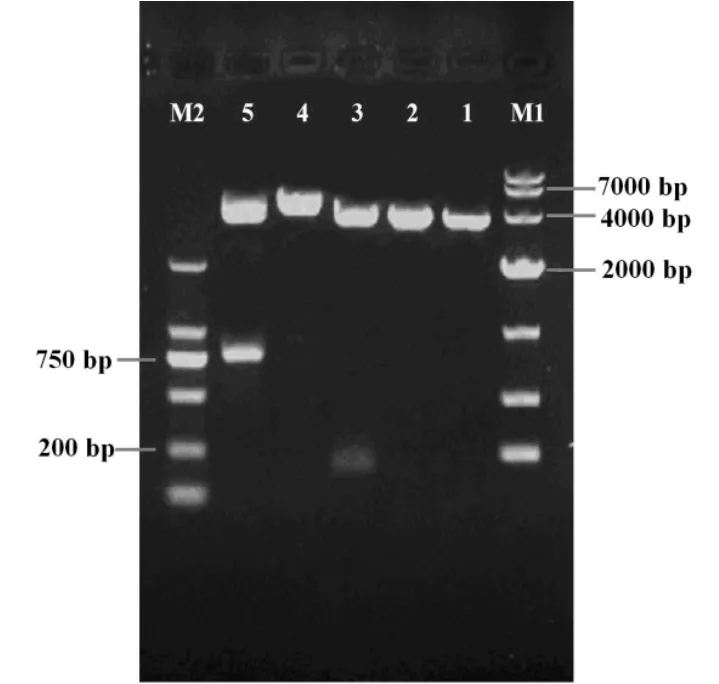
图4 质粒pMG36e、pMG36e-nisA、pMG36e-nisA-nisI单、双酶切电泳图
对测序正确的pMD19-nisI用SalI+PstI进行双酶切,将nisI片段切胶回收试剂盒纯化处理后与经相同处理的pMG36e-nisA质粒过夜连接。连接液热激转化至感受态E.coli JM109中,涂布在含有终质量浓度为250 μg/mL红霉素的LB平板上培养16 h,挑取单克隆转化子经培养后提取质粒进行酶切鉴定,将阳性重组质粒命名为pMG36e-nisA-nisI。酶切鉴定结果见图4。
挑取多个阳性重组子送华大基因公司测序,测序结果与NCBI数据库进行分析比对。
2.4乳酸乳球菌中重组质粒pMG36e-nisA-nisI的提取及酶切鉴定
将1~2 μL质粒pMG36e-nisA-nisI与40 μL乳酸乳球菌感受态细胞置于预冷的电击杯中10 min进行电转化。然后30°C复苏培养2 h后将其涂布在含有终浓度为5 μg/mL红霉素的GM17平板上培养72 h左右。挑取单克隆至含终浓度为5 μg/mL的红霉素的GM17液体培养基中提取质粒酶切鉴定,发现pMG36e-nisA-nisI成功导入了乳酸乳球菌,并赋予了宿主菌对红霉素的抗性。将重组菌命名为AI。
2.5出发菌株与AI的生长曲线对比

图5 出发菌株与AI的生长曲线
从图上可以看出出发菌株与转化子AI都是从6 h开始进入对数期,而出发菌株从9 h开始进入稳定期,AI则是10 h开始进入稳定期,进入稳定期后AI的生物量要明显高于出发菌株。
分析原因可能是因为质粒的导入导致AI生长过程中有了额外的负担,从而生长速度略低于出发菌株。而进入稳定期后,nisin有了一定的累积,而这个时候AI由于nisI的多克隆表达对nisin的自身免疫能力明显高于出发菌株,从而解释了其生物量高于出发菌株的原因。
2.6nisin抗性水平测定结果
由上一步生长曲线的结果分析可以侧面推断出质粒的成功表达,但是没有直接的证据证明导入共表达质粒的基因工程菌nisin抗性能力的提高。这里我们就以出发菌株为对照,考察基因工程菌在不同浓度的nisin抗性平板上的生长情况。结果见表1。

表1 不同nisin抗性浓度下的菌株生长情况
由上表结果可以看出,在10 000 IU/mL nisin抗性的平板上,野生菌株没有长出来,而基因工程菌AI在10 500 IU/mL nisin抗性平板上仍有生长,从而直观地看出基因工程菌由于抗性基因的导入使其对nisin的免疫能力有所提高。
2.7重组菌与对照菌发酵液中nisin效价的测定结果

表2 出发菌株与基因工程菌发酵产nisin效价汇总IU/mL
从三次发酵结果来看,转化子AI的nisin产量对比出发菌株有所提高,提高幅度为20.07%。应该是携带前体基因nisA与自身免疫基因nisI的外源质粒在宿主内成功表达的结果。
3 小结
从结果来看,虽然nisin产量有所提高,对比国内胡红梅、蒋立科等人的提高幅度(基因工程菌对比出发菌株的nisin产量提高了5%)有所增加,但是在国外研究成果的对比下还存在一定的差距。可能是由于nisin前体到成熟的nisin分子过程中负责修饰作用的基因表达量的限制,或者调节基因表达量太少,后期可以考虑从调节基因nisRK着手,以期达到更高的nisin产量。
[1]KUIPERS O P,ROLLEMA H S,BEERTHUYZEN M M,et,al. Protein engineering and biosynthesis of nisin and regulation of transcription of the structural nisA gene[J].International Dairy Journal,1995,5(8):785-795.
[2]胡红梅,蒋立科,林宇恒,等.乳链菌肽自身免疫基因nisI的表达对乳链菌肽产量的影响[J].微生物学报,2010,50(10):1341-1346.
[3]CHEIGH C I,PARK H,CHOI H J,et,al.Enhanced nisin production by increasing genes involved in nisin Z biosynthesis in Lactococcus lactis subsp.lactis A164[J].Biotechnology Letters,2005,27(3):155-160.
[4]RA S R,QIAO M Q,IMMONEN T,et,al.Genes responsible for nisin synthesis,regulation and immunity form a regulation of two operons and are induced by nisin in Lactococcus lactis N8[J]. Microbiology,1996,142:1281-1288.
[5]丁寅寅,马会勤,左芳雷,等.乳酸菌载体pMG36e的应用现状[J].中国生物工程杂志,2009,29(11):106-111.
[6]还连栋,陈秀珠,才迎,等.乳链菌肽产生菌的定向筛选及发酵产物的鉴定[J].微生物学报,1997,37(4):292-300.
[7]陈秀珠,何松.乳链菌肽高产菌株AL2的发酵条件研究[J].微生物学通报,1995,22(4):215-218.
[8]ANDERSON D G,MCKAY L L.Simple and rapid method for isolating large plasmid DNA from Lactic streptococci[J].Applied and Environmental Microbiology,1983,46(3):549-552.
[9]SAMBROOK J,RUSSELL D W.Molecular cloning:a laboratory manual[M].3rdedition.Cold Spring Harbor N Y:Cold Spring Harbor Laboratory Press,2001.
[10]OSULLIVAN D J,KLAENHAMMER T R.Rapid mini-prep isolation of high-quality plasmid DNA from Lactococcus and Lactobacillus spp.[J].Applied and Environmental Microbiology,1993,59(8):2730-2733.
[11]FELD L,BIELAK E,HAMMER K,et al.Characterization of a small erythromycin resistance plasmid pLFE1 from the foodisolate Lactobacillus plantarum M345[J].Plasmid,2009,61(3):159-170.
[12]WELLS J M,WILSON P W,LEPAGE R W F.Improved cloning vectors and transformation procedure for Lactococcus lactis[J].Journal of Applied Bacteriology,1993,74(6):629-636.
[13]TAKALA T M,SARIS P E J.C terminus of NisI provides specificity to nisin[J].Microbiology,2006,152:3543-3549.
[14]LUBELSKI J,KHUSAINOV R,KUIPERS O P.Directionality and coordination of dehydration and ring formation during biosynthesis of the lantibiotic nisin[J].Journal of Biological Chemistry,2009,284(38):25962-25972.
(责任编辑:朱小惠)
Construction and application of genetically engineered strain producing nisin
CHEN Xiaolong1,HU Yongheng1,ZHOU Bin2
(1.Institute of Fermentation Engineering,Zhejiang University of Technology,Hangzhou 310014,China;2.Zhejiang Silver-Elephant Bio-Engineering Co.,Ltd.,Tiantai 317200,China)
The nisA and nisI gene were amplified through PCR technique using genomic DNA from Lactococcus lactis as template.The nisA gene was ligated to pMG36e vector and the circular plasmid pMG36e-nisA containing nisA gene was constructed.The nisI gene was later ligated to pMG36e-nisA plasmid to obtain the recombinant plasmid of pMG36e-nisA-nisI.The recombinant plasmid pMG36e-nisA-nisI was then transformed to L.lactis and a positive colony AI was successfully obtained.The result of nisin fermentation by the genetically engineered strain AI indicated that its yield increased by 20.07%compared with the original strain.AI was confirmed as a stable,high-yield nisin producing strain.
nisin;gene engineering;yield
Q789
A
1674-2214(2015)03-0006-06
2015-05-12
陈小龙(1970—),男,浙江仙居人,教授,主要从事抗生素的发酵与结构修饰,E-mail:Richard_chen@zjut.edu. cn.通信作者:周斌,高级工程师,E-mail:zhoub1968@163.com.
