ApoC-Ⅲ联系血管功能异常和动脉粥样硬化
2015-11-20河北医科大学基础医学院生物化学与分子生物学教研室河北石家庄00020
高 敏 韩 梅 (河北医科大学基础医学院生物化学与分子生物学教研室,河北 石家庄 00020)
血浆中载脂蛋白(Apo)C-Ⅲ的水平可以预测冠心病,并且与代谢综合征如2型糖尿病及高脂血症有相关性。这些疾病有一个特征就是糖和脂代谢异常,这就增加了患者大血管和微血管并发症的风险。尽管使用他汀类药物可以降低2型糖尿病患者心血管病的发病率和死亡率,但是这些患者仍然有心血管病的高危因素,这部分归因于典型的动脉粥样硬化脂蛋白谱(ALP)即高甘油三酯(TG)血症和胆固醇中高密度脂蛋白(HDL)水平低。ApoC-Ⅲ通过抑制分解和清除富含TG的Apo引起高TG血症,ApoCⅢ引起冠心病通常也与此有关;然而在血管细胞中ApoC-Ⅲ及Apo家族直接影响动脉粥样硬化的机制还未经证实。富含ApoC-Ⅲ的极低密度脂蛋白(VLDL)增加了单核细胞在血管内皮细胞的黏附性。ApoC-Ⅲ也可以增加单核细胞对血管内皮细胞的黏附性。富含ApoC-Ⅲ的HDL不能减少单核细胞对血管内皮细胞的黏附性,然而没有ApoC-Ⅲ的HDL可以减少单核细胞对血管内皮细胞的黏附,这表明ApoC-Ⅲ抵消了 HDL中的抗炎作用。ApoC-Ⅲ和富含 ApoC-Ⅲ的VLDL可以通过活化核因子(NF)-κB激活血管内皮细胞,并诱导血管内皮细胞上单核细胞的募集。此外,ApoC-Ⅲ在血管内皮细胞诱导胰岛素抵抗(IR)引起内皮功能障碍。这些发现表明在富含TG的Apo中ApoC-Ⅲ不仅调节代谢而且通过激活血管细胞的促炎信号通路影响动脉粥样硬化。ApoC-Ⅲ是联系血脂异常和动脉粥样硬化的链接分子。
人类ApoC-Ⅲ的基因在肝脏和肠中表达,包含一个基因族ApoAⅠ和ApoAⅣ的基因在11号染色体的长臂〔1〕。在肝脏和肠中最初合成的ApoC-Ⅲ是一个含有99个氨基酸的肽链。经内质网剪切掉20个氨基酸,成熟的ApoC-Ⅲ包含79个氨基酸残基,分子量为 8.8 kD〔1〕。
多个途径可以调控ApoC-Ⅲ基因的表达。胰岛素通过干扰素效应元件(IRE)的启动子减少ApoC-Ⅲ的转录。在IR〔2〕时ApoC-Ⅲ的表达和分泌是增加的。实际上,在与体重指数和IR相关的代谢综合征、2型糖尿病中,血浆中的ApoC-Ⅲ水平升高〔3〕。过氧化物增殖物激活受体(PPARs)特别是PPARα可以下调ApoC-Ⅲ的转录。相反,活化的NF-κB可以上调 ApoC-Ⅲ的表达〔1〕。
ApoC-Ⅲ分布范围较广,如在乳糜微粒(CM)、VLDL、中密度脂蛋白(IDL)和LDL中。也分布于比HDL稍大一点的微粒中。在禁食状态,ApoC-Ⅲ主要与HDL结合,在进餐后,ApoC-Ⅲ优先分布于CM和VLDL中。在TG正常的患者中,大约1/2~2/3的VLDL和IDL中有ApoC-Ⅲ。相反,在TG异常的患者中,仅有10%的LDL中含有ApoC-Ⅲ。
1 ApoC-Ⅲ引起高TG血症
在TG和胆固醇中富含带有ApoC-Ⅲ的ApoB,高TG血症患者选择性的升高ApoB。血浆中总的ApoC-Ⅲ的浓度及ApoB中ApoC-Ⅲ的浓度和血浆中的 TG的浓度有因果关系〔4〕。ApoC-Ⅲ通过一些机制引起高TG血症。ApoC-Ⅲ抑制富含TG的脂蛋白(TRLs)的分解和清除。无论是在体内还是在体外,CM和VLDL中ApoC-Ⅲ可以抑制肝细胞对CM和VLDL的摄取。ApoC-Ⅲ抑制脂蛋白ApoB和肝细胞上的ApoB或ApoE受体的结合。ApoC-Ⅲ的这种抑制作用是由于ApoC-Ⅲ对ApoB或者ApoE的受体区域的掩盖。ApoC-Ⅲ也可以抑制脂蛋白酶(LPL)的活性,并且在高TG血症的患者中,ApoC-Ⅲ也是LPL的一个明确的抑制剂。缺乏ApoC-Ⅲ的受试对象TRL水平较低,来自这些受试对象的血清可以激活人奶中的LPL,但是正常的血清可以有效地抑制LPL的活性。这些发现表明ApoC-Ⅲ是通过抑制LPL介导的TRLs的脂解作用导致高TG血症的发展。最近有研究表明,在培养的肝细胞中ApoC-Ⅲ可以刺激VLDL 的合成〔1〕。
用放射性核素示踪剂的一些研究表明,在有代谢综合征和高TG血症的受试对象中,ApoC-Ⅲ浓度升高与增加VLDL的分泌和降低VLDL的分解代谢有关〔5〕。通过转基因和基因敲除小鼠模型的研究验证了ApoC-Ⅲ在影响TRLs代谢中的作用。过表达人类ApoC-Ⅲ野生型小鼠或者在LDL受体敲除的小鼠,不仅可以诱导高TG血症也可以促进动脉粥样硬化的发展〔6〕。在这些模型中,ApoC-Ⅲ浓度升高与增加肝细胞中VLDL的生成率和降低VLDL及其残余微粒的分解率有关。相反,ApoC-Ⅲ敲除的小鼠表现出了对TRLs和高TG的迅速分解〔7〕。
ApoC-Ⅲ基因多态性的研究也受到广泛关注,现流行病学表明在汉族人群中ApoC-Ⅲ启动子区的多态性对高脂血症有影响。与TG正常的人群相比,-455CC或-482TT的变异在高脂血症患者中增高。与大多数正常基因相比-455CC或-482TT的变异型明显的增加了高脂血症的风险〔8〕。
2 ApoC-Ⅲ预测冠心病的风险
在代谢综合征和2型糖尿病中ApoC-Ⅲ水平升高,是冠心病的主要危险因素,ApoC-Ⅲ可以调节脂蛋白ApoB的代谢,这些让我们有理由认为在临床研究中ApoC-Ⅲ可以影响ApoB和冠心病风险的关系。Alaupovic等〔9〕报道表明含有ApoC-Ⅲ的脂蛋白ApoB的浓度是冠状动脉粥样硬化进程最强的脂蛋白预测因子,即使是在服用降低LDL胆固醇他汀类药物的患者中亦是如此。也有其他的冠状动脉粥样硬化的研究报道在脂蛋白ApoB上的ApoC-Ⅲ和冠心病风险的有相关性〔10〕。在对冠心病患者大量的前瞻性研究中总是将ApoC-Ⅲ和ApoE对冠心病的预测作用进行对比,如果不考虑他汀类药物的影响,在VLDL和LDL中的ApoC-Ⅲ增加了冠心病的风险〔11〕。调整其他的脂质风险因素不会影响ApoC-Ⅲ的结果,ApoC-Ⅲ是一个比TG更明确的促动脉粥样硬化的标志物。流行病学研究表明,在冠心病进程中,血浆中ApoC-Ⅲ的水平以及ApoC-Ⅲ在血浆脂蛋白中的分布表现出了重要作用,而低水平的ApoC-Ⅲ可能与减低冠心病风险有关〔12〕。
一些用单因素分析研究表明在HDL中的ApoC-Ⅲ与冠心病同样是有相关性的,HDL中的ApoC-Ⅲ和其他风险因素如VLDL和TG一样和冠心病发病的风险呈正相关〔13〕。ApoC-Ⅲ存在着促动脉粥样硬化的作用,这已经超过了ApoC-Ⅲ对脂蛋白ApoB代谢的影响。
3 ApoC-Ⅲ对血管细胞的直接作用
ApoC-Ⅲ和冠心病的因果关系归因于ApoC-Ⅲ抑制TRLs的分解、清除及延长了促动脉粥样硬化的TRLs在血浆中的停留时间。然而这一理论仍然有争议,最近有报道认为富含ApoC-Ⅲ的VLDL并没有比不含ApoC-Ⅲ的VLDL的停留时间长〔14〕,因为富含ApoC-Ⅲ的VLDL快速脂解成LDL可以平衡这种清除延迟。血浆中带有ApoC-Ⅲ的ApoB比不带ApoC-Ⅲ的水平低。因此带有ApoC-Ⅲ的脂蛋白ApoB增加冠心病的风险与其在血浆中的浓度不成比例,这表明ApoC-Ⅲ与冠心病风险的关系一部分归因于ApoC-Ⅲ直接参与促动脉粥样硬化的过程中,然而带有ApoC-Ⅲ的脂蛋白ApoB及ApoC-Ⅲ本身对血管细胞的直接作用还没有检测出来。假设含有ApoC-Ⅲ的脂蛋白比不含ApoC-Ⅲ的脂蛋白促动脉粥样硬化的作用强,可以通过检测外周血中单核细胞和血管内皮细胞(ECs)来检测ApoC-Ⅲ的直接作用。
4 ApoC-Ⅲ活化人类外周血的单核细胞
循环中单核细胞对血管内皮细胞的黏附可以促进动脉粥样硬化的炎症反应。富含ApoC-Ⅲ的VLDL可以增加单核细胞在血管内皮的黏附,不含ApoC-Ⅲ的VLDL无此作用;ApoC-Ⅲ本身引起这种作用〔15〕,并且呈浓度依赖性。含有ApoC-Ⅲ的脂蛋白的促黏附浓度,ApoB 50~100 μg/ml,恰好也是禁食血浆的浓度范围,例如血脂正常的个体ApoB 50 μg/ml,在TG血症或者有冠心病的患者ApoB>100 μg/ml,这些都支持它们的临床联系。HDL可以抑制整合素的表达及单核细胞在白细胞和血管内皮细胞的黏附〔16〕,因此HDL有抗动脉粥样硬化的特性。研究检测富含ApoC-Ⅲ的HDL对单核细胞黏附的作用,发现不含有ApoC-Ⅲ的HDL可以减少单核细胞对血管内皮细胞黏附并且呈浓度依赖性〔15〕,但是富含 ApoC-Ⅲ的HDL无此作用。ApoC-Ⅲ可能抵消其他HDL复合物的促动脉粥样硬化的作用。目前表明ApoC-Ⅲ可以诱导HDL的功能紊乱。
含有ApoC-Ⅲ的脂蛋白也含有其他的 Apo,如 ApoC-Ⅰ、ApoC-Ⅱ和ApoE还有其他多种脂质;然而从含有ApoC-Ⅲ的VLDL提取出其他的Apo和脂类不能增加单核细胞的黏附。抗ApoC-Ⅲ的抗体不能抗ApoC-Ⅰ、ApoC-Ⅱ或者ApoE,它可以减少促黏附效应。因此ApoC-Ⅲ本身而非其他Apo常常可以聚集ApoC-Ⅲ到脂蛋白ApoB上或者其他脂蛋白上而增强单核细胞黏附与血管内皮细胞;然而需要进一步的研究证明伴随ApoC-Ⅲ的ApoC-Ⅰ、ApoC-Ⅱ或者ApoE是否在ApoC-Ⅲ对单核细胞的黏附效应中起修饰作用。
ApoC-Ⅲ及含有ApoC-Ⅲ的VLDL可以活化单核细胞中的β1整合素。蛋白激酶C(PKC)在促动脉粥样硬化的多个过程中起着非常重要的作用,包括单核细胞与内皮的相互作用〔17〕。PKCs中,PKCα在通过VLDL CⅢ或者ApoC-Ⅲ活化单核细胞中的β1整合素起着非常重要的作用。在单核细胞中PTX敏感的G蛋白耦联受体和PC-PLC在活化PKCα、NF-κB和β1整合素起着关键作用(图 1)〔18,19〕。以上发现为 ApoC-Ⅲ作为一个独立因素通过单核细胞活化促进炎症和动脉粥样硬化提供证据。
5 ApoC-Ⅲ活化血管内皮细胞
血管内皮细胞黏附因子(VCAM)的诱导和循环中单核细胞的募集可以促进动脉粥样硬化和血小板不稳定的炎症事件。我们证明了ApoC-Ⅲ可以活化PKCβ而不是PKCα,可以在未活化的内皮细胞增加VCAM-1的表达,因此可以募集单核细胞〔19〕。此外,VLDL CⅢ+而不是VLDL CⅢ-可以活化内皮细胞的PKCβ,抗ApoC-Ⅲ的抗体通过VLDL CⅢ+抑制PKCβ的活化,这表明在这个过程中ApoC-Ⅲ起着很重要的作用(图1)。作为连接分子的NF-κB连接了ApoC-Ⅲ诱导的PKCβ的活化和增加VCAM-1的表达。因此TLRs通常是含有ApoC-Ⅲ,证明了TLRs活化血管内皮细胞是不依赖于这些微粒中的一部分脂质和他们的氧化。
6 在内皮细胞ApoC-Ⅲ诱导IR并引起内皮功能异常
内皮功能异常是冠心病发生的重要过程,它的特征是一氧化氮(NO)利用度降低,NO可以促进血管舒张并有抗动脉粥样硬化的特性。在内皮细胞胰岛素活化NO合成酶并刺激NO生成,血管内皮细胞的IR可以导致其功能异常。IR和内皮功能障碍在糖尿病、肥胖症和血脂异常的患者中比较常见,并且也是冠心病的主要危险因素,在这些情况下血浆中ApoC-Ⅲ的水平是升高的。因为在内皮细胞中PKCβ可以抑制胰岛素信号通路,ApoC-Ⅲ可以活化内皮细胞中的PKCβ,需要检测ApoC-Ⅲ在内皮胰岛素信号通路的效应〔20〕。VLDL中的ApoC-Ⅲ抑制胰岛素活化eNOS途径并抑制血管内皮NO的产生。ApoC-Ⅲ同样也损害内膜依赖的小鼠主动脉的舒张。PKCβⅡ可以介导ApoC-Ⅲ抑制胰岛素受体底物(IRS)-1功能的这种副作用(图2)。
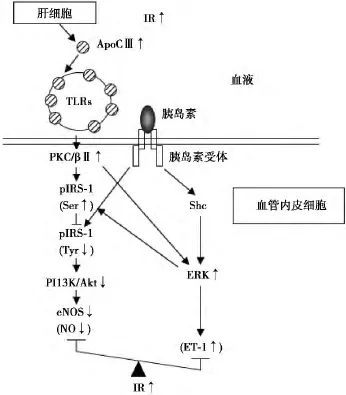
图2 血管内皮细胞ApoC-Ⅲ引起IR的机制〔19〕
与高TG血症相关的IR和内膜功能异常是由于TRLs中的游离脂肪酸和一部分脂质;然而TRLs中的ApoC-Ⅲ在血管内皮细胞损坏胰岛素信号通路是一个新的发现,这表明ApoC-Ⅲ可以将血脂异常和内皮功能异常联系起来。
7 残余制蛋白和ApoC-Ⅲ
ApoE、TG和胆固醇中也富含VLDL CⅢ+和LDL CⅢ+微粒,这些微粒和残余脂蛋白微粒(RLPs)同样都有促动脉粥样硬化的特性。血浆中的TRL,特别是那些RLPs都和动脉粥样硬化有联系〔21〕。RLPs由异质TRL微粒组成,一些RLPs中含有较多的ApoC-Ⅲ和ApoE。富含ApoC-Ⅲ的 VLDL和 LDL微粒可能是RLP或者其他前体的组成成分。研究已经发现了很多关于RLPs直接促进动脉粥样硬化的机制〔22〕,RLPs可以刺激单核细胞的黏附〔23〕,诱导平滑肌细胞的增殖〔24〕,促进泡沫细胞的形成。ApoC-Ⅲ可能不仅仅参与到RLPs的形成和累积,在炎症诱导构成中对动脉粥样硬化起很重要的作用。
8结语
数据已经证明是ApoC-Ⅲ的抗体而不是ApoB/E受体,但是富含ApoC-Ⅲ的脂蛋白活化PKCs和NF-κB的确切机制需要进一步的证明。含有ApoC-Ⅲ的脂蛋白动力学及在其他种类的细胞中促动脉粥样硬化的作用需深入研究,这有助于理解TRLs的促动脉粥样硬化的作用。很多研究关注一些脂蛋白的作用,如促动脉粥样硬化脂蛋白的氧化脂质。ApoC-Ⅲ在炎症和动脉粥样硬化的过程中起着直接和明显的作用。ApoC-Ⅲ可能成为一个新的靶点,特别是在IR、代谢综合征和2型糖尿病的受试对象中,因为降低ApoC-Ⅲ的水平,不仅可以增加TRLs受损的代谢,也可能会直接预防动脉粥样硬化。
1 Ooi EM,Barrett PH,Chan DC,et al.Apolipoprotein C-Ⅲ:understanding an emerging cardiovascular risk factor〔J〕.Clin Sci,2008;114:611-24.
2 Altomonte J,Cong L,Harbaran S,et al.Foxo1 mediates insulin action on apoC-Ⅲ and triglyceride metabolism〔J〕.J Clin Invest,2004;114:1493-503.
3 Olivieri O,Bassi A,Stranieri C,et al.Apolipoprotein C-Ⅲ,metabolic syndrome,and risk of coronary artery disease〔J〕.J Lipid Res,2003;44:2374-81.
4 Lee SJ,Moye LA,Campos H,et al.Hypertriglyceridemia but not diabetes status is associated with VLDL containing apolipoprotein CⅢin patients with coronary heart disease〔J〕.Atherosclerosis,2003;167:293-302.
5 Batal R,Tremblay M,Barrett PH,et al.Plasma kinetics of apoC-Ⅲ and apoE in normolipidemic and hypertriglyceridemic subjects〔J〕.J Lipid Res,2000;41:706-18.
6 Masucci-Magoulas L,Goldberg IJ,Bisgaier CL,et al.A mouse model with features of familial combined hyperlipidemia〔J〕.Science,1997;275:391-4.
7 Maeda N,Li H,Lee D,et al.Targeted disruption of the apolipoprotein C-Ⅲgene in mice results in hypotriglyceridemia and protection from postprandial hypertriglyceridemia〔J〕.J Biol Chem,1994;269:23610-6.
8 Yu J,Wang HM,Yang SM,et al.The effect of APOC3 promoter polymorphisms on the risk of hypertriglyceridemia in Chinese han population with or without type 2 diabetes mellitus〔J〕.Science,2010;45:35-9.
9 Alaupovic P,Mack WJ,Knight-Gibson C,et al.The role of triglyceriderich lipoprotein families in the progression of atherosclerotic lesions as determined by sequential coronary angiography from a controlled clinical trial〔J〕.Arterioscler Thromb Vasc Biol,1997;17:715-22.
10 Hodis HN.Triglyceride-rich lipoprotein remnant particles and risk of atherosclerosis〔J〕.Circulation,1999;99:2852-4.
11 Lee SJ,Campos H,Moye LA,et al.LDL containing apolipoprotein CⅢis an independent risk factor for coronary events in diabetic patients〔J〕.Arterioscler Thromb Vasc Biol,2003;23:853-8.
12 Pollin TI,Damcott CM,Shen H,et al.A null mutation in human APOC3 confers a favorable plasma lipid profile and apparent cardioprotection〔J〕.Science,2008;322:1702-5.
13 Onat A,Hergenç G,Sansoy V,et al.Apolipoprotein C-Ⅲ,a strong dis-criminant of coronary risk in men and a determinant of the metabolic syndrome in both genders〔J〕.Atherosclerosis,2003;168:81-9.
14 Zheng C,Khoo C,Ikewaki K,et al.Rapid turnover of apolipoprotein C-Ⅲcontaining triglyceride-rich lipoproteins contributing to the formation of LDL subfractions〔J〕.J Lipid Res,2007;48:1190-203.
15 Kawakami A,Aikawa M,Libby P,et al.Apolipoprotein CⅢ in apolipoprotein B lipoproteins enhances the adhesion of human monocytic cells to endothelial cells〔J〕.Circulation,2006;113:691-700.
16 Barter PJ,Nicholls S,Rye KA,et al.Antiinflammatory properties of HDL〔J〕.Circ Res,2004;95:764-72.
17 Rask-Madsen C,King GL.Proatherosclerotic mechanisms involving protein kinase C in diabetes and insulin resistance〔J〕.Arterioscler Thromb Vasc Biol,2005;25:487-96.
18 Kawakami A,Aikawa M,Nitta N,et al.Apolipoprotein CⅢ-induced THP-1 cell adhesion to endothelial cells involves pertussis toxin-sensitive G-protein-and protein kinase C alpha-mediated nuclear factor-kappaB activation〔J〕.Arterioscler Thromb Vasc Biol,2007;27:219-25.
19 Kawakami A,Yoshida M.Apolipoprotein CⅢ links dyslipidemia with Atherosclerosis〔J〕.J Atheroscler Thromb,2009;16:6-11.
20 Kawakami A,Osaka M,Tani M,et al.Apolipoprotein CⅢ links hyperlipidemia with vascular endothelial cell dysfunction〔J〕.Circulation,2008;118:731-42.
21 Nakada Y,Kurosawa H,Tohyama J,et al.Increased remnant lipoprotein in patients with coronary artery disease-evaluation utilizing a newly developed remnant assay,remnant lipoproteins cholesterol homogenous assay(RemL-C)〔J〕.J Atheroscler Thromb,2007;14:56-64.
22 Kawakami A,Yoshida M.Remnant lipoproteins and atherogenesis〔J〕.J Atheroscler Thromb,2005;12:73-6.
23 Kawakami A,Tanaka A,Nakajima K,et al.Atorvastatin attenuates remnant lipoprotein-induced monocyte adhesion to vascular endothelium under flow conditions〔J〕.Circ Res,2002;91:263-71.
24 Kawakami A,Tanaka A,Chiba T,et al.Remnant lipoprotein-induced smooth muscle cell proliferation involves epidermal growth factor receptor transactivation〔J〕.Circulation,2003;108:2679-88.
