利用图示法分析金属与盐溶液反应的过程
2015-11-19叶茂
叶茂
摘要:根据金属与盐溶液反应的两种类型(一种金属和混合盐溶液反应;两种混合金属粉末和一种盐溶液反应),利用图示法分析金属与盐溶液的反应过程,让学生能理清解题思路,较好地掌握反应的原理与反应顺序,从而有利于掌握解题方法,提高学生将书本知识转化为解决实际问题的能力。
关键词:图示法;金属;混合盐溶液;推断题解析;解题技巧
文章编号:1005–6629(2015)10–0085–03 中图分类号:G633.8 文献标识码:B
目前中学教材使用的金属活动性顺序表是:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au,这个顺序表对于研究常见金属的某些性质比周期表要方便得多[1]。而金属活动性顺序相关知识一直是初中学生学习化学的一大难点,很多习题解决起来也相对复杂,特别是金属与盐溶液反应的过程,以及反应后生成的滤液、滤渣问题,很多学生往往无从下手,在做题过程中出错率相当高。如何使学生较好地掌握反应的原理与反应顺序,也一直是教师感到棘手的问题。较多的方法是在用文字描述反应过程的基础上加以逻辑推理[2,3],但学生理解和具体做题操作起来还是很困难。通过实际教学,笔者发现若将此类问题转化成形象的图示,使学生能更加直观地理解反应过程,掌握解题方法也会轻松一些,出错率将大大降低。
金属与盐溶液反应类型一般有如下两种类型。
1 第一种反应类型:一种金属和混合盐溶液反应
已知:金属活动性顺序为A>B>C,将A金属放入B、C混合盐溶液中。我们先按一般思路分析,假如金属A与B的盐溶液反应生成金属单质B,但由于B的活泼性比C强,故B会与C的盐溶液反应生成金属单质C。所以反应的实质是A将C从其盐溶液中首先置换出来。当C的盐溶液全部与A反应完全后,若A还有剩余才与B的盐溶液反应生成金属单质B。
如图1所示,活泼性相差越大越先反应,左边固体表示未反应的固体,中间液体表示盐溶液,右边固体表示生成的金属固体。若进行过滤操作则液体为滤液,固体都可以算滤渣[4]。
(1)~(6)顺序代表金属粉末A由少到多的加入过程。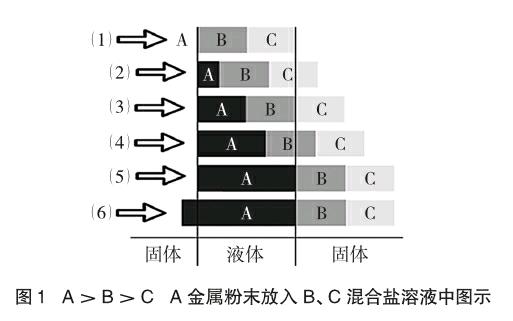
通过分析我们不难看出,一旦发生反应产生的滤渣是最不活泼金属单质,滤液是最活泼金属的盐溶液。图1中(5)代表反应刚好结束,若再加入金属A反应也无法进行,说明金属A粉末过多。在具体问题中,我们可以利用该图示法具体分析看反应进行到哪一步,再来做出判断。
例1 (2011·宜昌模拟)为了从硝酸亚铁和硝酸银的混合溶液中,提取并回收银,小燕设计了如下的实验方案(见图2):
(1)若溶液乙为无色溶液,则固体甲一定含有的物质是 ,可能含有的物质是 。写出一个在步骤①中肯定发生的反应的化学方程式 。
(2)若溶液乙为浅绿色溶液,则溶液乙中溶质的组成可能是 或 (填物质的名称或化学式)。
[分析]若不清楚反应顺序此题很容易出错,但是若仅凭逻辑推理也容易得分不全,特别是最后两空很多学生估计只会写两种物质的化学式而已,没有注意到前面的“组成可能是 ”。故首先按照金属活动性顺序表将Fe、Zn、Ag的金属活动性顺序排列准确,即Zn>Fe>Ag。而此题恰好是最活泼金属放入两种金属盐溶液中即类型一的题目,A>B>C依次对应Zn、Fe、Ag,画出本题图示如图3。
若题目中涉及到有色,一般需要思考的是铁元素和铜元素形成的盐溶液,而本题只有铁与颜色有关。故若溶液无色则反应进行到图1中的从第(5)步开始即B(Fe)已经不在溶液中了,故(5)(6)步均满足要求。由题意,若溶液乙为无色溶液,如图3,铁一定被置换出来成为固体单质,则固体甲一定含有的物质是Fe和Ag,可能含有的物质是Zn。肯定发生反应的化学方程式为Zn+ 2AgNO3=Zn(NO3)2+2Ag。若溶液乙为浅绿色则图1中的步骤(2)~(4)均符合要求,组合也只有两种,即Zn(NO3)2、Fe(NO3)2和Zn(NO3)2、Fe(NO3)2、AgNO3。
[答案](1)Fe和Ag Zn Zn+2AgNO3= Zn(NO3)2+2Ag
(2)Zn(NO3)2、Fe(NO3)2和Zn(NO3)2、Fe(NO3)2、AgNO3或硝酸锌、硝酸亚铁和硝酸锌、硝酸亚铁、硝酸银
2 第二种反应类型:两种混合金属粉末和一种盐溶液反应
已知:金属活动性顺序为A>B>C,将A、B金属粉末放入C的盐溶液中,见图4。在类型一中提到了活泼性相差越大越先反应。而本类型也是金属A先与C的盐溶液反应,当A粉末反应完全,B粉末才能反应。若A粉末有剩余,B反应了生成B的盐溶液,A也会与B的盐溶液反应置换出B单质,故该类型如图4所示。
例2 (2012·武汉)向AgNO3溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法:①向滤渣中加入稀盐酸,一定有气泡产生。②向滤液中加入稀盐酸,一定有沉淀产生。③滤渣中一定含有Ag。④滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Al(NO3)3。
以上说法正确的个数为
A.0个 B.1个 C.2个 D.3个
[分析]此题是两种金属放入一种金属盐溶液的问题,即类型二。先将金属Ag、Al、Fe按金属活动性排序,即Al>Fe>Ag,然后画出该类型对应图示,如图5。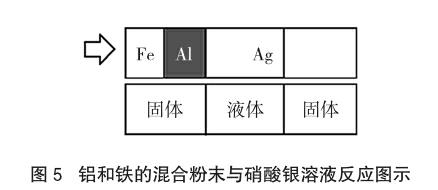
图5中金属活动性顺序Al>Fe>Ag,金属Al先与Ag的盐溶液反应,当Al完全反应后Fe再与硝酸银溶液反应。由题意,溶液为浅绿色则Al肯定反应完全,且Fe也参加反应生成硝酸亚铁盐的溶液,即图4(4)、(5)符合要求。①向滤渣中加入稀盐酸,一定有气泡产生。若Fe恰好用完或Fe不足则无气泡。②向滤液中加入稀盐酸,一定有沉淀产生。若硝酸银中银已经完全被置换成银单质,即图4第(5)步,则无白色沉淀。③滤渣中一定含有Ag。一旦反应Ag肯定存在,正确。④滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Al(NO3)3。由图4(4)、(5)可以看出一定含有Fe(NO3)2,可能含有AgNO3,一定含有Al(NO3)3,故正确个数只有一个。
[答案] B
当遇到看似更加复杂的金属与盐溶液反应时一定要找准反应的实质,去伪存真,找准题型类型画好图示,很多问题就会迎刃而解了。
例3 将铁粉和铜粉的混合物,投入到硝酸银和硝酸锌的混合液中,充分反应后,过滤,在滤渣中滴入盐酸,有气体产生,则滤渣中一定含有,滤液中一定含有 。
[分析]首先要除去此题中的“伪”,硝酸锌在此题中肯定是不反应的。这样一来,该题就变成了两种混合金属粉末与某金属盐溶液反应的问题,即类型二的问题。由题意,滴加盐酸有气泡,铁没有反应完,铜肯定还没开始反应,故滤渣一定含有生成的银,未反应的铁和铜。硝酸锌虽然未参加反应但填写滤液时不要忘记。反应一旦进行必定会生成硝酸亚铁,故滤液肯定含有硝酸亚铁。值得注意的是,学生在答题过程中往往注重了图示法的应用规律,但最后呈现答案时滤液忘记了加上相应的酸根,比如本题滤液学生可能会答成滤液一定含有铁和锌,这是错误的,也是最容易失分的,必须改为硝酸亚铁和硝酸锌。
[答案]铁、铜、银;硝酸亚铁和硝酸锌
[练习]某溶液中仅含有AgNO3和Cu(NO3)2两种溶质,某校课外活动小组的同学将溶液分为A、B、C三份,各加入一定量的铁粉,充分反应后过滤、洗涤,分别得到滤渣和滤液。
(1)若将A得到的滤渣加入到稀盐酸中有气泡产生,则其滤液中的溶质是 ;
(2)若将B得到的滤渣加入到稀盐酸中没有气泡产生,则此滤渣中一定有 ;
(3)若向C得到的滤液中滴加稀盐酸,有白色沉淀生成,则此滤液中含有的溶质是 。
[答案](1)Fe(NO3)2 (2)Ag (3)AgNO3、Cu(NO3)2、Fe(NO3)2
综上所述,利用图示法分析金属与盐溶液反应的过程,让学生在教师演示指导下,将反应的具体过程以图示法表示出来,能更加直观、形象地分析题意,加快了学生对该知识点的掌握能力。但值得注意的是,在教学过程中教师要充分利用学生已有的经验和认知规律,教会学生如何根据题意正确地绘制图示,以及利用图示如何解题,这是非常必要的。此外,在使用图示法解题时也一定要提醒学生读清题意,按题目要求的内容作答才能真正提高得分率。
参考文献:
[1]刘学忠,李桃春.金属活动性顺序表在中学阶段的应用[J].化学教学,1988,(2):44.
[2]黄六仔.浅谈金属和多种盐溶液反应的技巧解法[J].理化解题研究·初中版,2013,(2):60.
[3]马艳军.金属与盐溶液推断题解析[J].中学教与学,2005,(5):21~22.
[4]毛振芳.关于滤液、滤渣成分推断题的解题思路[J].中学教与学,2009,(12):7~8.
