采后乙醇处理对蓝莓果实酚类物质含量及抗氧化能力的影响
2015-11-19黄晓杰冯叙桥赵宏侠王娜
黄晓杰,冯叙桥,赵宏侠,王娜
(沈阳农业大学 食品学院,辽宁沈阳,110866)
蓝莓(Vaccinium corymbosumL.)又称越橘,杜鹃花科越橘属,其果味酸甜,风味独特,果实中含有大量的多酚、花色苷、维生素等活性物质,有较高的抗氧化活性,研究表明蓝莓具有预防癌症、防止脑神经衰老、保护毛细血管、消除眼疲劳、增进视力等作用[1]。蓝莓果实中天然抗氧化物质对人类健康的作用正日益受到人们的重视,抗氧化活性已成为衡量蓝莓果实采后品质的一个重要指标,维持和提高果实采后抗氧化能力已成为果实采后贮运保鲜研究中的热点[2]。近年来,有关果实采后抗氧化水平变化的报道逐渐增多。
本研究以蓝莓为试材,探讨乙醇处理对蓝莓果实采后品质、酚类物质含量和抗氧化能力的影响。
1 材料与方法
1.1 材料与处理
试验用“北陆”蓝莓(Berkeley×(Lowbush×Pioneer),‘Hokuriku’),采自辽宁省丹东市东港天丰蓝莓基地,采后当天冷藏车运回实验室,剔除残次、病虫害及机械损伤果实,在(1±1)℃下预冷24 h后,挑选成熟度、颜色、大小基本一致的果实做为实验试材。
将挑选出的果实随机分为2组,每组果实2 kg,分别放入封闭的熏蒸室,一组500 μL/L乙醇处理果实12 h,乙醇气体来自预饱和处理滤纸(泰州奥克,20.0 cm×20.0 cm),熏蒸温度为20℃;对照组(CK不添加任何物质置于熏蒸室。熏蒸处理完毕后,果实取出通风冷却1 h后用商用塑料盒(上海星勤贸易公司)分装,每盒120 g左右,贮藏于(1±1)℃,相对湿度90% ~95%的环境下贮藏28 d,分别在果实处理前(0 d)和贮藏期间每隔7 d测定果实品质指标,每个指标重复测定3次。
1.2 试剂和仪器
矢车菊素-3-半乳糖苷,Sigma公司;甲醇、甲酸(色谱纯),迪马(中国)有限公司;无水乙醇,国药试剂有限公司。
5804R高速冷冻离心机,德国Eppendorf公司;ML104电子天平,瑞士梅特勒公司;UV-2700紫外可见分光光度计,日本岛津公司;PAL-3阿贝折光仪,日本ATAGO公司;DELTA320酸度计,梅特勒-托利多公司;C18 Sep-Pak萃取小柱,迪马(中国)科技有限公司;Agilent 1260高效液相色谱仪配VWD可变波长紫外检测器,安捷伦科技有限公司;Agilent 1100 LCTrap SL高校液相色谱-质谱仪,安捷伦科技有限公司。
1.3 测定指标
1.3.1 腐烂指数的测定
分别取3 g马铃薯脆片样品放入电子鼻专用顶空瓶内,采用手动顶空进样法对苹果脆片挥发性物质进行测定[15]。以干燥空气为载气,流速为300 mL/min,样品采样时间60 s,清洗时间60 s,采样间隔时间5 s,自动调零时间10 s。
腐烂指数以蓝莓果实表面发生汁液外漏、软化或腐烂现象作为判别依据,共分为4级:0级,无明显表观变化;1级,果实有明显软化;2级果实软化严重,有汁液外漏现象;3级,果实出现霉点、腐烂。按下式计算腐烂指数。
腐烂指数/%=∑[(腐烂级别×该级果实数)/(最高腐烂级别×总果实数)]×100
1.3.2 可滴定酸(TA)含量和可溶性固形物(TSS)的测定[10]
采用酸碱滴定法测定果实TA值;采用PAL-3阿贝折光仪直接测定果实TSS值。
1.3.3 维生素C含量的测定
参照国标GB 6195-1986[11]改进方法二甲苯一二氯靛酚比色法。
1.3.4 总花色苷、总酚含量和DPPH自由基清除率的测定
蓝莓果置于预冷的研钵中,低温(4℃)研磨成浆,快速准确称取2.5 g匀浆,加入25 mL预冷的1%盐酸酸化的80%乙醇,4℃浸提12 h,15 000×g低温离心10 min,收集上清液,残渣用预冷的酸化乙醇洗涤2次,离心后合并上清液定容至100 mL,用于测定总花色苷、总酚含量、DPPH自由基清除率。
采用Lako等[12]pH示差法测定总花色苷含量,526 nm处测定吸光度值,结果以等价矢车菊素-3-葡萄糖苷表示(mg C3G/100g FW);采用Folin-Ciocalteu`s法[13]测定总酚含量,765 nm处测定吸光度值,结果以等价没食子酸表示(g gallic acid/kg FW);参照Larrauri等[14]方法测定DPPH自由基清除率,结果以清除百分率表示。
1.3.5 蓝莓花色苷单体分析
参照Bao等[15]的液相色谱法进行,略有改进。准确称取5 g果肉加50 mL酸化甲醇匀浆,4℃避光浸提12 h,9 000 r/min冷冻离心10 min,取上清液35℃真空蒸干去除甲醇。残渣用25 mL酸化水溶解,漩涡振荡混匀后过预先活化的C18Sep-Pak萃取小柱,取1 mL净化花色苷35℃真空蒸干后,2 mL甲醇/体积分数3%甲酸溶解,过0.45 μm滤膜后进样。进样量 10 μL,色谱柱:Zorbax Eclipse plus C18柱(150 mm×4.6 mm,5 μm),柱温 20℃,流动相由 3%甲酸溶液和甲醇(色谱纯)组成,梯度洗脱25 min,流速为1 mL/min,检测波长:520nm。以矢车菊素-3-半乳糖苷为标准物质,外标法测定各单体和总花色苷含量,结果以mg/100g FW表示。
质谱条件正离子扫描(ESI+,m/z 100~1 000);干燥气流流速10 L/min;毛细管电压:3 500 V;帘气:30 psi;干燥气温350℃,CID电压1.0 V。
1.4 数据处理
采用SPSS19.0进行数据处理分析,用Duncan’s进行差异显著性分析,5%为显著水平。
2 结果与分析
2.1 乙醇处理对蓝莓果实低温贮藏期间品质的影响
2.1.1 乙醇处理对蓝莓果实腐烂指数的影响
腐烂指数是评价蓝莓果实保鲜效果的重要指标,研究表明,乙醇可直接杀死果实表面的大部分腐败菌,延缓果实采后腐烂的发生。如图1所示,贮藏期间乙醇处理显著抑制(P<0.05)了果实采后的腐烂,这与前人的研究一致[3-6]。同时,乙醇能够抑制内源乙烯的产生,抑制果实采后细胞膜系统的破坏和丙二醛的积累,延缓果实的成熟衰老过程,维持果实自身抗性,从而减少了采后果实腐烂的发生[6]。
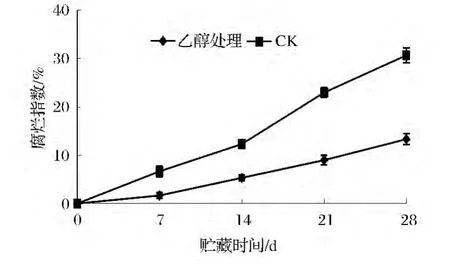
图1 乙醇处理对蓝莓果实腐烂指数的影响Fig.1 Effect of treatment with ethanol on decay rate of blueberry fruits
2.1.2 乙醇处理对蓝莓果实TA和TSS的影响
TA和TSS是形成蓝莓果实特有风味的重要物质,同时,TA和TSS的变化也反映采后蓝莓果实的衰老过程。如图2所示,随着贮藏时间的延长,蓝莓果实TA和TSS在冷藏期间呈逐渐下降趋势。乙醇处理显著抑制果实TA下降,贮藏28 d后,乙醇处理果实的TA值是对照果实的1.52倍(图2-A)。贮藏7 d后,乙醇处理果实TSS的下降速度明显高于对照组,但贮藏28 d时,乙醇处理组TSS略有上升,这可能是贮藏末期乙醇处理诱导果实花色苷的积累,从而使果实中固形物增加(图2-B)。
2.1.3 乙醇处理对蓝莓果实VC的影响
由于果蔬本身含有促使VC氧化的酶,采后Vc会逐渐被氧化减少。如图3所示,蓝莓果实贮藏期间Vc含量持续下降,乙醇处理可以显著抑制(P<0.05)Vc含量的下降,贮藏28 d,乙醇处理果实的Vc值是对照果实的1.61倍。

图2 乙醇处理对蓝莓果实TA(A)和TSS(B)的影响Fig.2 Effect of treatment with ethanol on TA(A)and TSS(B)changes of blueberry fruits

图3 乙醇处理对蓝莓果实Vc含量的影响Fig.3 Effect of treatment with ethanol on Vcchange of blueberry fruits
2.2 乙醇处理对蓝莓果实总酚和总花色苷含量的影响
蓝莓果实鲜样总酚和总花色苷含量分别为1.45 mg/g和117.38 mg/100 g。蓝莓中酚类物质,尤其是花色苷含量丰富,因此,维持或提高贮藏期间蓝莓酚类物质和花色苷含量,具有重要的营养学意义。如图4-A所示,随着贮藏时间的延长,蓝莓果实中总酚含量呈逐渐下降趋势,这是多酚氧化酶、过氧化物酶等酚酶与多酚类物质发生了酶促褐变的原因。贮藏前14 d,由于花色苷的合成,乙醇处理组总酚含量变化很小,而后逐渐下降,乙醇处理果实总酚含量显著(P<0.05)高于对照果实。
随着贮藏时间的延长,总花色苷含量呈先上升后下降的趋势(图4-B)。对照果实在贮藏第7天总花色苷含量达到最大值,此时总花色苷含量为121.51 mg/100 g,之后由于果实衰老造成花色苷氧化,总花色苷含量逐渐下降。本研究验证了低温条件有利于贮藏期花色苷的进一步合成[16]。乙醇处理果实在贮藏第14天总花色苷含量达到最大值,为140.35 mg/100 g,说明乙醇处理可以促进采后果实花色苷的合成,这与杨梅[5]、草莓[8]和树莓[9]的研究结果一致。在整个冷藏期间乙醇处理的果实总花色苷含量显著(P<0.05)高于对照果实,贮藏28d乙醇处理组总花色苷含量是对照组的1.25倍。

图4 乙醇处理对蓝莓果实总酚(A)和总花色苷(B)含量的影响Fig.4 Effect of treatment with ethanol on content changes of total phenolic(A)and total anthocyanin(B)of blueberry fruits
2.3 乙醇处理对蓝莓果实花色苷单体物质的影响
图5为“北陆”蓝莓果实花色苷的HPLC图谱,HPLC分离得到13种花色苷单体,根据表1质谱图的保留时间和质谱数据,结合资料分析[17-18],确定“北陆”蓝莓花色苷的单体种类(见表1)。“北陆”蓝莓鲜果主要花色苷单体中,牵牛花色素-3-阿拉伯糖苷含量最高(22.82 mg/100g)、锦葵色素-3-半乳糖苷次之(15.17 mg/100g)、随后是飞燕草色素-3-半乳糖苷(13.9 mg/100g)、矢车菊素-3-阿拉伯糖苷(10.23 mg/100g)等。
表2为乙醇处理对蓝莓果实花色苷10种主要单体含量的影响。从表2可以看出,随着贮藏时间延长,乙醇处理组中锦葵色素-3-葡萄糖苷、乙醇处理组和对照组中矢车菊素-3-阿拉伯苷含量均呈逐渐下降趋势,其余各组果实花色苷单体呈现出与总花色苷含量相同的变化趋势,即乙醇处理组在贮藏14d出现最大值,对照组在贮藏7d出现最大值,而后均逐渐下降。贮藏14d后,乙醇处理果实主要花色苷单体中,牵牛花色素-3-阿拉伯糖苷含量增加了21.4%(达27.7 mg/100g)、飞燕草色素-3-半乳糖苷增加了69.9%(达23.61 mg/100g)、锦葵色素-3-半乳糖苷增加了32.4%(达20.08 mg/100g),飞燕草色素-3-葡萄糖苷增加了高达174.9%(达17.10 mg/100g)。在整个贮藏期间,乙醇处理组花色苷单体含量均显著(P<0.05)高于对照组。
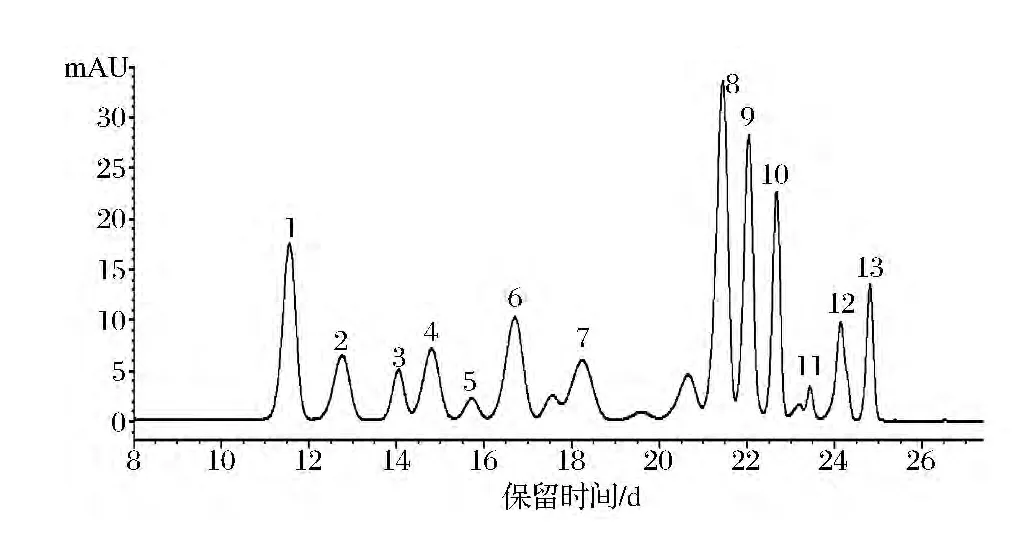
图5 蓝莓果实花色苷的HPLC图谱Fig.5 HPLC chromatogram of anthocyanins identified in‘Hokuriku’blueberry fruits
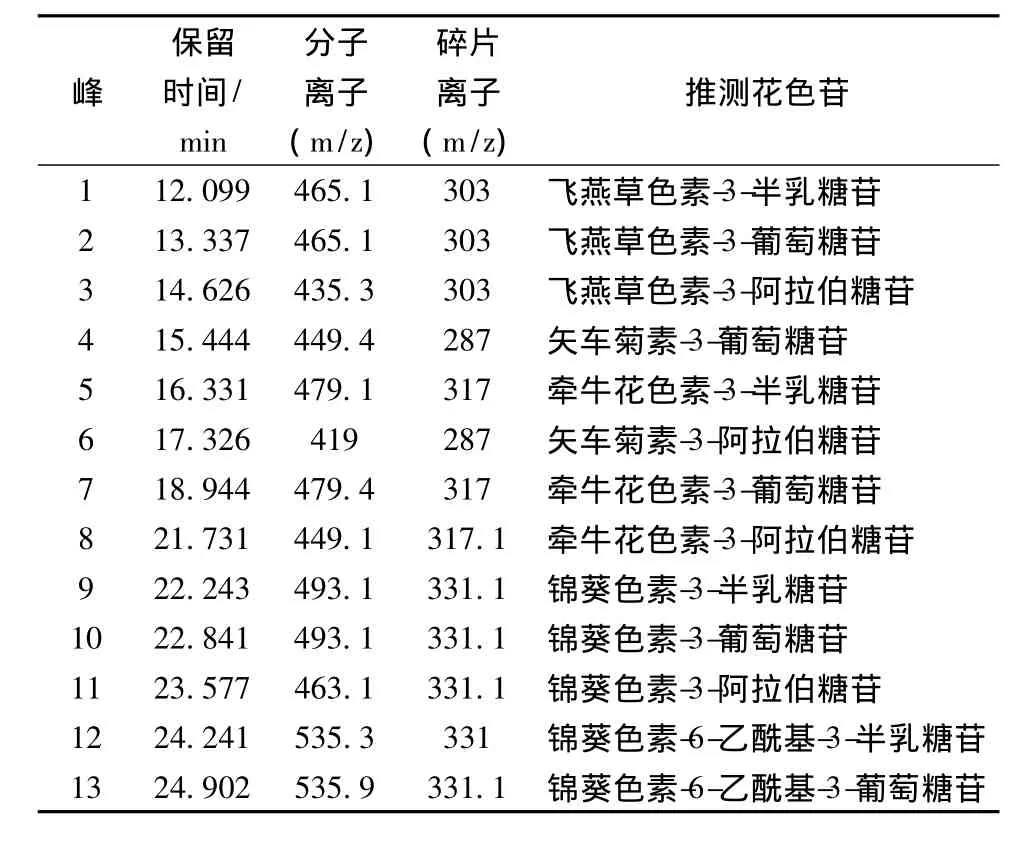
表1“北陆”蓝莓果实花色苷类物质的LC-MS/MS鉴定Table 1 Anthocyanins identification in‘Hokuriku’blueberry fruits by LC-MS/MS
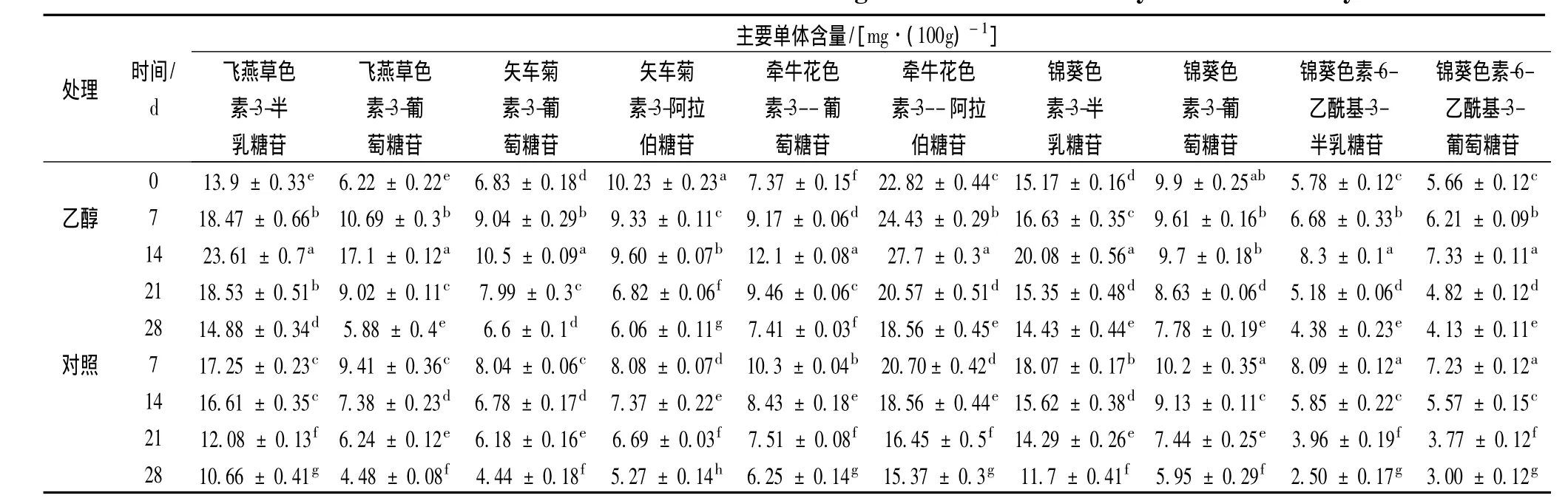
表2 乙醇处理对蓝莓果实花色苷10种主要单体含量的影响Table 2 Effect of treatment with ethanol on content changes of individual anthocyanin in blueberry fruits
2.4 乙醇处理对蓝莓果实DPPH自由基清除率的影响
本实验选取DPPH自由基清除率作为评价蓝莓果实抗氧化能力的指标。如图6所示,随着贮藏时间的延长,DPPH自由基清除率呈先上升后下降的趋势,与总花色苷含量的变化趋势基本一致,乙醇处理组在贮藏14 d达到最大值,对照组在贮藏7 d达到最大值,乙醇处理显著(P<0.05)抑制了DPPH自由基清除率的下降,在整个贮藏期间,乙醇处理组果实抗氧化活性均高于对照组果实。
3 讨论
本试验发现,500 μL/L乙醇熏蒸处理可以显著降低蓝莓果实采后贮藏期间的腐烂指数,抑制贮藏期间蓝莓果实TA、Vc含量的下降,从而维持了果实较好的食用品质,延长保藏期。这与文献报道的乙醇熏蒸可以有效抑制葡萄[3]、杨梅[5]和枸杞[6]等果实采后腐烂和品质下降的结论相一致。
蓝莓果实富含花色苷而且种类丰富,花色苷是品质优良的天然色素,美国农业部人类营养中心(HNRCA)的研究人员比较了40多种新鲜水果和蔬菜的抗氧化活性,发现蓝莓是所有样品中抗氧化能力最高的,这可能的原因是蓝莓果中含有很高的花色苷[19]。维持和提高蓝莓果实采后抗氧化能力具有重要的营养学意义。研究发现,乙醇能够调控植物一系列生理生化反应,包括促进杨梅[5]、葡萄[7]和树莓[9]等浆果果实中花色苷的积累。在本试验中,整个贮藏期间,乙醇处理组果实总酚、总花色苷含量和抗氧化能力均显著高于对照组。乙醇处理诱导了贮藏期间蓝莓果实中酚类和花色苷的合成。通过HPLC法分离得到试验用“北陆”蓝莓果实含有13种花色苷单体,乙醇处理提高了蓝莓果实大部分花色苷单体含量,但锦葵色素-3-葡萄糖苷和矢车菊素-3-阿拉伯苷含量呈下降趋势,这可能与这2种单体花色苷稳定性较弱有关,具体原因有待进一步研究。
采后水杨酸[20]、茉莉酸甲酯[21]和热水处理[22]等方法均可通过诱导不同果实内苯丙烷代谢关键酶活性(如PAL、C4H和CHS等),而促进果实内酚类和花色苷物质的积累。关于乙醇处理果实后花色苷积累的相关研究较少,Kereamy[23]等研究发现,乙醇通过激发UFGT,从而促进了转色期葡萄果实中花色苷的积累。果实对乙醇处理的响应取决于品种、成熟度、乙醇处理浓度、处理时间和处理模式等[7,24-25]。采后乙醇处理蓝莓果实是不是通过诱导苯丙烷代谢关键酶活性来提高花色苷含量,乙醇是不是发挥信号分子作用来调控酶活等,尚待进一步研究。

图6 乙醇处理对蓝莓果实DPPH自由基清除率的影响Fig.6 Effect of treatment with ethanol on DPPH scavenging activity changes of blueberry fruits
4 结论
本试验表明采后500 μL/乙醇熏蒸处理可以显著降低蓝莓果实低温贮藏期间的腐烂指数,抑制蓝莓果实TA、Vc含量的下降,显著提高果实总酚、总花色苷含量和DPPH自由基清除率,从而改善蓝莓果实低温贮藏期间果实的品质和营养。
[1] 姜爱丽.蓝莓果实采后生理生化代谢及调控研究[D].沈阳:沈阳农业大学,2011.
[2] 陈伟,金文渊,杨震峰,等.MeJA处理对枇杷果实采后抗氧化活性的影响[J].中国食品学报,2012,12(1):112-117.
[3] Lurie S,Pesis E,Gadiyeva O,et al.Modified ethanol atmosphere to control decay of table grapes during storage[J].Postharvest Biology and Technology,2006,42(3):222-227.
[4] Karabulut O,Arslan U,Kuruoglu G,et al.Control of postharvest diseases of sweet cherry with ethanol and hot water[J].Journal of Phytopathology,2004,152(5):298-303.
[5] 杨爱萍,汪开拓,金文渊,等.乙醇熏蒸处理对杨梅果实保鲜及抗氧化活性的影响[J].食品科学,2011,32(20):277-281.
[6] 胡文瑾,毕阳,李颖超,等.采后热水和乙醇处理对枸杞鲜果腐烂的控制及品质的影响[J].食品工业科技,2013,34(12):308-311.
[7] Pesis E.The role of the anaerobic metabolites,acetaldehyde and ethanol,in fruit ripening,enhancement of fruit quality and fruit deterioration[J].Postharvest Biology and Technology,2005,37(1):1-19.
[8] Ayala-Zavala J F,WANG S Y,WANG C Y,et al.Methyl jasmonate in conjunction with ethanol treatment increases antioxidant capacity,volatile compounds and postharvest life of strawberry fruit[J].European Food Research and Technology,2005,221(6):731-738.
[9] Chanjirakul K,WANG S Y,WANG C Y,et al.Effect of natural volatile compounds on antioxidant capacity and antioxidant enzymes in raspberries[J].Postharvest Biology and Technology,2006,40(2):106-115.
[10] 曹健康,姜微波,赵玉梅.果蔬采后生理生化试验指导书[M],北京:中国轻工业出版社,2007.
[11] GB/T 6195-1986.水果、蔬菜维生素C含量测定法(2,6-二氯靛酚滴定法)[S].
[12] Lako J,Trenerry V C,Wahlqvist M,et al.Phytochemical flavonols,carotenoids and the antioxidant properties of a wide selection of Fijian fruit,vegetables and other readily available foods[J].Food Chemistry,2007,101(4):1 727-1 741.
[13] CHENG G W,Breen P J.Activity of phenylalanine ammonia-lyase(PAL)and concentrations of anthocyanins and phenolics in developing strawberry fruit[J].Journal of the American Society for Horticultural Science,1991,116(5):865-869.
[14] Larrauri J A,Sánchez-Moreno C,Saura-Calixto F.Effect of temperature on the free radical scavenging capacity of extracts from red and white grape pomace peels[J].Journal of agricultural and food chemistry,1998,46(7):2 694-2 697.
[15] BAO J,CAI Y,SUN M,et al.Anthocyanins,flavonols,and free radical scavenging activity of Chinese bayberry(Myrica rubra)extracts and their color properties and stability[J].Journal of Agricultural and Food Chemistry,2005,53(6):2 327-2 332.
[16] Fawbush F,Nock J F,Watkins C B.Antioxidant contents and activity of 1-methylcyclopropene(1-MCP)-treated‘Empire’apples in air and controlled atmosphere storage[J].Postharvest Biology and Technology,2009,52(1):30-37.
[17] Bunea A,Ruginǎ D,Scon■a Z,et al.Anthocyanin determination in blueberry extracts from various cultivars and their antiproliferative and apoptotic properties in B16-F10 metastatic murine melanoma cells[J].Phytochemistry,2013,95:436-444.
[18] Giovanelli G,Buratti S.Comparison of polyphenolic composition and antioxidant activity of wild Italian blueberries and some cultivated varieties[J].Food Chemistry,2009,112(4):903-908.
[19] 李颖畅,宣景宏,孟宪军.蓝莓果中花色素苷的研究进展[J].食品研究与开发,2007,28(1):178-180.
[20] CHEN J Y,WEN P F,KONG W F,et al.Effect of salicylic acid on phenylpropanoids and phenylalanine ammonia-lyase in harvested grape berries[J].Postharvest Biology and Technology,2006,40(1):64-72.
[21] WANG K,JIN P,CAO S,et al.Methyl jasmonate reduces decay and enhances antioxidant capacity in Chinese bayberries[J].Journal of Agricultural and Food Chemistry,2009,57(13):5 809-5 815.
[22] Nafussi B,Ben-Yehoshua S,Rodov V,et al.Mode of action of hot-water dip in reducing decay of lemon fruit[J].Journal of Agricultural and Food Chemistry,2001,49(1):107-113.
[23] El Kereamy A,Chervin C,Souquet JM,et al.Ethanol triggers grape gene expression leading to anthocyanin accumulation during berry ripening[J].Plant Science,2002,163(3):449-454.
[24] Plotto A,Bai J,Narciso J,et al.Ethanol vapor prior to processing extends fresh-cut mango storage by decreasing spoilage,but does not always delay ripening[J].Postharvest Biology and Technology,2006,39(2):134-145.
[25] Ritenour M,Mangrich M,Beaulieu J,et al.Ethanol effects on the ripening of climacteric fruit[J].Postharvest Biology and Technology,1997,12(1):35-42.
