活血化瘀法对哮喘大鼠气道重塑模型的调控作用研究
2015-11-18夏永辉谭丽萍
陈 静,夏永辉,谭丽萍,程 羽
(云南中医学院,云南 昆明650500)
支气管哮喘(哮喘)是由多种细胞和细胞组分参与的气道慢性炎症性疾病。气道重塑是哮喘的一大重要病理学特征,其本质就是气道纤维化和胶原沉积。气道重塑可加重气道高反应性,导致肺功能持续性与进行性损害,从而增加了临床上哮喘的难治性[1],有效改善气道重塑成为哮喘防治的新方向。TGF-β1是迄今已知最强的致纤维化因子之一,也是导致哮喘气道重塑的主要调控因子[2]。MMP-9是降解细胞外基质(ECM)的主要成分,在生理和病理情况下有利于组织重构[3-4]。中医多数医家认同哮喘是由于宿痰伏肺,外邪入侵或遇诱因引触,津血同源,各种原因导致血停成瘀,津聚为痰,痰瘀互结,津、血运行受碍,病情迁延。故在不同证型的气道纤维化中瘀血都成为了重要病理产物,活血化瘀成为治疗器官纤维化的重要方法[5]。本研究观察了中医活血化瘀法对哮喘大鼠气道重塑后肺组织及TGF-β1、MMP-9的影响,旨在探讨活血化瘀法干预气道重塑的作用机制。现报道如下。
1 实验资料
1.1 实验动物 SPF级SD雄性大鼠30只,4~6周龄,体质量(180±20)g,购自四川省医学科学院实验动物研究所,动物许可证编号:SCXK(川)2013-24,合格证号:0018160。
1.2 试剂及仪器 鸡卵清蛋白(OVA)、氢氧化铝凝胶(Sigma公司,美国);大鼠 TGF-β1ELISA试剂盒、大鼠 MMP-9 ELISA试剂盒(苏州卡尔文生物科技有限公司);酶标仪(美国分子仪器公司);压缩雾化器(Pari Turboboy,德国);台式高速离心机(BECKMAN公司,美国);自备有机玻璃雾化箱(45 cm ×35 cm ×20 cm)。
1.3 实验药物 活血化瘀法所选药物由丹参20 g、红花9 g、桑白皮15 g、白芥子12 g、浙贝母15 g组成,购于昆明福林堂药业有限公司,以水煎法进行药液浓缩,每毫升药液含生药1 g,根据成人(60 kg)临床一日用药量换算出大鼠(200 g)等效用药量,以上剂量均根据动物体表面积等效剂量换算。
1.4 实验方法
1.4.1 模型制备及分组 将SD雄性大鼠30只随机分成正常组、模型组、药物干预组,每组10只。模型组和药物干预组第1天和第14天腹腔注射OVA-氢氧化铝混悬液(OVA 1 mg,氢氧化铝100 mg,加生理盐水至2 mL)2 mL致敏,于实验第21天起将大鼠置于密闭容器内,予2%OVA生理盐水雾化激发,每次30 min,隔天1次,连续激发8周,药物干预组于每次激发前30 min灌胃给予上述中药水煎剂1.3 mL。正常组用生理盐水代替OVA致敏和激发。实验中观察大鼠反应,出现烦躁不安、呼吸急促深快、腹肌抽搐、烦躁呛咳及点头运动等症状表明建立哮喘模型成功[6]。
1.4.2 组织病理切片制备 各组大鼠末次激发后24 h,打开胸腔取下左肺组织,中性甲醛固定,石蜡包埋后切片,HE染色光学显微镜下观察细支气管、血管及肺泡的病理改变情况。1.4.3 指标检测 采用酶联免疫吸附试验法(ELISA)检测各组大鼠肺组织匀浆上清液TGF-β1、MMP-9水平。参照试剂盒说明书进行,通过标准品吸光度(A)值绘制标准曲线,然后计算各样本的值。
1.5 统计学方法 实验数据采用SPSS 16.0软件进行统计分析处理,结果以均数±标准差(±s)表示。各组数据服从正态分布,采用LSD法检验,进行多组间均数的多重比较。P<0.05为差异有统计学意义。
2 结 果
2.1 动物死亡情况 模型组死亡3只,药物干预组死亡2只。
2.2 肺组织病理学改变 正常组大鼠气道周围无炎性细胞浸润,支气管管腔规则,气道黏膜上皮及肺泡结构完整,肺泡间隔窄,气道平滑肌薄,肺泡腔透亮,无上皮脱落损伤,黏膜无水肿,见图1。模型组大鼠气道周围大量密集炎细胞浸润,可见黏液栓,肺泡融合、不同程度断裂,充血水肿,杯状细胞增生,平滑肌增生,见图2。药物干预组大鼠支气管管壁趋于正常,上皮结构较完整,管壁未见增厚,浸润的炎性细胞减少,无明显炎性渗出,见图3。
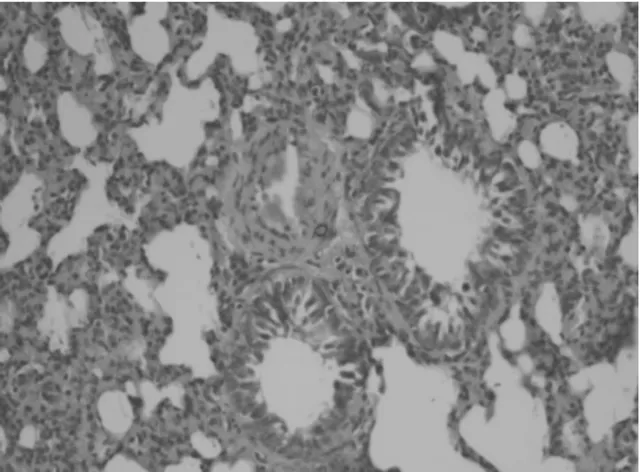
图1 正常组肺组织病理学表现(HE×200)
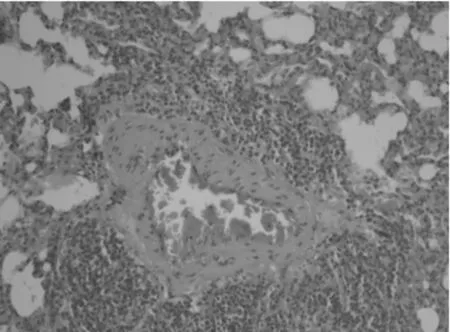
图2 模型组肺组织病理学表现(HE×200)
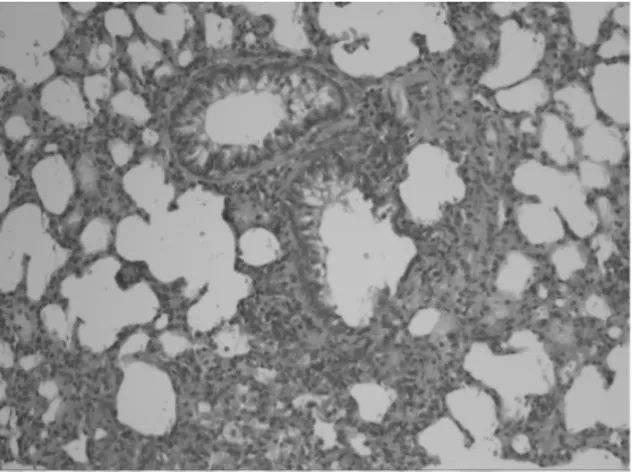
图3 药物干预组肺组织病理学表现(HE×200)
2.3 肺组织匀浆TGF-β1及MMP-9水平比较 模型组肺组织TGF-β1及MMP-9水平均明显高于正常组(P均<0.05);药物干预组肺组织TGF-β1及MMP-9水平均明显低于模型组(P均<0.05),TGF-β1水平仍高于正常组(P<0.05),MMP-9水平与正常组比较差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠肺组织匀浆TGF-β1及MMP-9水平比较(±s,ng/mL)
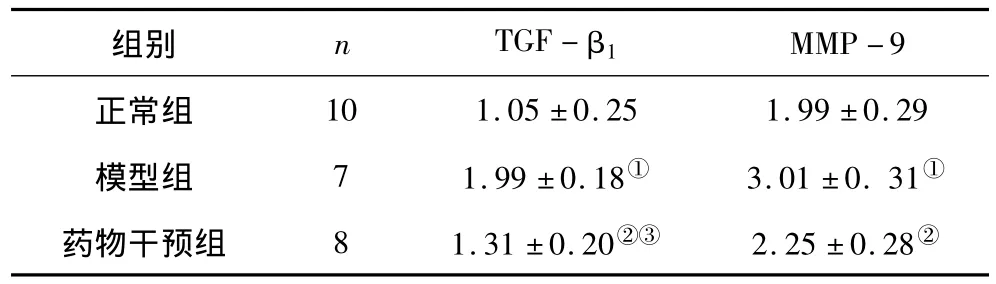
表1 各组大鼠肺组织匀浆TGF-β1及MMP-9水平比较(±s,ng/mL)
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05;③与正常组比较,P <0.05。
10 1.05 ±0.25 1.99 ±0.29模型组 7 1.99±0.18① 3.01±0.31①药物干预组 8 1.31±0.20②③ 2.25±0.28 MMP-9正常组组别 n TGF-β1②
3 讨 论
气道重塑是哮喘发展到一定阶段气道出现的不可逆改变,也是哮喘难治的重要原因之一。目前,哮喘治疗主要是控制症状、抗炎、免疫疗法,从改善气道重塑的角度进行哮喘治疗的药物很少,作用也不理想,因此,从气道重塑的调控因子入手,用药物控制细胞因子的含量从而干预气道重塑是治疗难治性哮喘的一个新思路。
TGF-β是哮喘气道重塑的主要调控因子,其中以TGF-β1活性最强。作为促纤维化的关键因子,TGF-β1可促进平滑肌细胞和杯状细胞肥大增生,增加胶原和纤连蛋白合成并促进气道胶原沉积和基底膜增厚,促进结缔组织蛋白合成,从而导致管腔狭窄和不可逆的肺功能改变[7]。MMP-9是特异性降解ECM的锌依赖性蛋白酶家族,作为与哮喘气道重塑关系最为密切的基质金属蛋白酶,其主要负责降解ECM,哮喘状态下,MMP-9的过度表达不仅能导致ECM结构重建,而且还能诱导嗜酸粒细胞迁移并影响气道平滑肌细胞增殖与迁移,进而诱发哮喘气道重塑[8]。因此,抑制TGF-β1和MMP-9表达可减轻哮喘气道重塑[9-10]。
哮喘在中医属“哮病”范畴,传统认为宿痰伏肺是哮喘的夙根,但现代中医从痰的产生机制和临床实践分析,认为痰瘀密切相关,相互影响。各种原因导致血停成瘀,津聚为痰,产生瘀血、痰浊等病理产物,痰浊、瘀血有形之邪阻滞肺络,搜逐不易,致肺管狭窄,使无形之气不能宣降,痰瘀互结,气道狭窄,更致津血运行受碍,使病情缠绵难愈[11]。曹世宏认为,肺燥阴伤和肺气虚冷是哮喘的主要病机,但两者均可导致瘀血,瘀血一旦形成又可影响气机的宣畅,阴津阳气难以布达,使肺纤维化形成加重[12]。因此,活血化瘀是治疗器官纤维化的重要方法。
中医药治疗哮喘有着几千年的实践经验,形成了一套完整的理法方药体系,在防治哮喘上有独特优势。近年来对中药的研究表明,活血化瘀药物能改善结缔组织代谢,抑制纤维母细胞合成胶原,使病变的胶原纤维变细、疏松化,对增生性病变组织有不同程度的软化和吸收作用[13]。本研究在深入探讨哮喘气道重塑中医病因病机的基础上,利用中药多靶点、多调控途径的特点和优势,选择活血化瘀法作为治则治法对哮喘气道重塑进行干预调控,结果显示活血化瘀法干预后,大鼠肺组织炎细胞浸润减少,支气管管壁和平滑肌增生程度减轻,气道重塑逐渐改善,肺组织TGF-β1、MMP-9水平较模型组明显下降。表明TGF-β1、MMP-9是哮喘气道重塑的重要调控因子,监测TGF-β1、MMP-9的表达有助于了解气道重塑的发生时间及发展程度;活血化瘀法能有效干预和阻断哮喘气道重塑的发生发展,其机制可能是通过抑制TGF-β1、MMP-9表达而实现的。药物干预后大鼠肺组织TGF-β1仍高于正常组,主要考虑气道重塑是哮喘持续发展的病理结果,用药物干预和阻断气道重塑需要一定的时间。
[1] Makinde T,Murphy RF,Agrawal DK.The regulatory role of TGF -beta in airway remodeling in asthma[J].Immunol Cell Biol,2007,85(5):348-356
[2] Kenyon NJ,Ward RW,Mcgrew G,et al.TGF - beta1 causes airway fibrosis and increased collagenⅠand ⅢmRNA in mice[J].Thorax,2003,58(9):772 -777
[3] Watson AM,Benton AS,Rose MC,et al.Cigarette smoke alters tissue inhibitor of metalloproteinase 1 and matrix metalloproteinase 9 levels in the basolateral secretions of human asthmatic bronchial epithelium in vitro[J].J Investig Med,2010,58(5):725 -729
[4] Mehra D,Sternberg DI,Jia Y,et al.Altered lymphocyte trafficking and diminished airway reactivity in transgenic mice expressing human MMP - 9 in a mouse model of asthma[J].Am J Physiol Lung Cell Mol Physiol,2010,298(2):189 -196
[5] 牛建昭,贲长恩.器官纤维化基础及中医药防治[M].北京:人民卫生出版社,2008:11
[6] Eynott P R,Nath P,Leung S Y,et al.Allergen-induced inflammuition and airway epithelial and smooth muscle cell proliferation:role of Jun N - terminal kinase[J].Br J Pharmmeol,2003,140(8):1373-1380
[7] O’Donnell MP.Renal tubulointerstitial fibrosis.New thoughts on its development and progression[J].Postgrad Med,2010,108(1):159-162
[8] Piirila P,LauhioA,Majuri MI,et al.Matrix metalloproteinases-7,-8,-9 and TIMP-1 in the follow-up of diisocyanate-induced asthma[J].Allergy,2010,65(1):61 -68
[9] 彭光耀,刘鑫,黄艳,等.TGF-β1/Smads通路在哮喘大鼠气道重塑模型中的动态变化[J].广东医学,2010,31(5):557-560
[10] McMillan SJ,Xanthou G,Lloyd CM.Manipulation of allelgen-induced airway remodeling by treatment with anti-TGF-beta antibody:effect on the smad signaling pathway[J].J Immunol,2005,174(9):5774-5780
[11]田金娜,李建保,刘小凡.丹龙定喘汤对哮喘小鼠气道重塑及血清 TGF-β1的影响研究[J].四川中医,2012,30(4):17-19
[12]智屹惠.曹世宏教授论治肺间质纤维化[J].南京中医药大学学报:自然科学版,2001,17(3):185 -186
[13]邹萍,盛薇,李惠林,等.丹参注射液诱导口腔粘膜下纤维性变成纤维细胞凋亡的试验研究[J].中华中医药学刊,2007,25(12):2566
