11C左旋间羟基麻黄素制备方法的优化及改进
2015-11-18刘磊李彦生俞浩楠陈秋松
刘磊,李彦生,俞浩楠,陈秋松
(天津医科大学总医院PET/CT影像诊断科,天津 300052)
11C左旋间羟基麻黄素制备方法的优化及改进
刘磊,李彦生,俞浩楠,陈秋松
(天津医科大学总医院PET/CT影像诊断科,天津 300052)
目的:优化及改进交感神经受体显像剂11C标记左旋间羟基麻黄素((-)-[11C]HED)的放射化学合成反应条件和分离纯化方法。方法:利用14N(p,α)11C核反应生产[11C]-CO2,使用TRACERlab FXc碳多功能化学合成器在线制备甲基化试剂11C-三氟甲基磺酰基甲烷([11C]-CH3OTf)。将前体间羟胺的乙腈溶液降温至0℃捕获[11C]-CH3OTf后,加热进行甲基化反应。利用半制备C-18反相色谱柱,以生理盐水/乙醇95/5(v∶v)作为半制备色谱流动相分离纯化反应产物,切峰、除菌后得到(-)-[11C]HED注射液。采用单因素分析和正交实验设计法,选择放化反应温度(A)、时间(B)、前体用量(C)为因素各取3水平,按L9(34)正交表进行实验。结果:放化反应温度为主要因素,前体用量及反应时间为次要因素。结合正交实验结果和纯化实际情况,确定最佳工艺条件为A3B1C3,即反应温度70℃、前体用量0.2 mg、反应时间40 s。验证实验结果显示自[11C]-CO2轰击结束计时,(-)-[11C]HED制备耗时约25 min。产物的校正产率(校正至[11C]CH3I的活度)为(49.1±5.1)%(43.2%~60.9%)(n=50),放射化学纯度>99%(n= 50),产物放射性比活度(24.4±2.2)(19.4~27.8)GBq·μmol-1(n=50)。细菌、内毒素检测结果均为阴性。结论:制备方法的优化及改进可使自动化制备(-)-[11C]HED过程高效、便捷。
正电子发射断层显像;11C-间羟基麻黄素;放化合成;正交优选;分离纯化
正电子发射断层显像(positron emission tomogaphy,PET)是当代前沿医学影像学技术。PET显像所使用的正电子核素标记的药物进入体内后发生衰变,一个质子转变为一个中子和一个正电子。正电子在组织中行进1~2 mm后与周围组织中的电子结合而发生湮没,产生一对能量为511 KeV而方向相反的高能γ光子,可被PET探测器检测并经计算机重建出断层及三维图像。PET的发展有赖于正电子药物的发展,同时也促进了正电子药物的发展[1]。间羟胺(metaraminol)为去甲肾上腺素的类似物,其正电子核素放射性标记药物11C左旋间羟基麻黄素((-)-[11C]HED)应用于交感神经系统PET显像,可以反映活体脏器肾上腺素受体的分布。(-)-[11C]HED的首篇报道见于1990年,Rosenspire等[2]成功地放化合成出示踪剂,并进行了动物体内分布代谢和阻断实验。随后(-)-[11C]HED被尝试用于充血性心力衰竭诊断、心脏移植检测、心率失常及糖尿病自主神经病变等心脏交感神经受体显像,以及嗜铬细胞瘤和神经母细胞瘤等交感神经肿瘤的定位诊断[3-17]。虽然随后学者们对(-)-[11C]HED的制备方法进行过研究和探讨[18-21],但至今未见优化反应条件的报道。文献报道部分研究所得产物溶液无法直接应用于临床显像,现有分离纯化方法有待优化改进。此外,国内尚无利用[11C]-CH3OTf作为反应甲基化试剂的报道。本研究旨在首次采用单因素实验和正交实验法优化(-)-[11C]HED放化合成反应条件,同时进一步改进分离纯化方法。
1 材料和方法
1.1 仪器设备TRACERlab FXc碳多功能化学合成器,MINItrace医用回旋加速器(10 MeV)(美国GE公司)。半制备高效液相色谱柱(NUCLESOIL 100-5C18Nautilus反相色谱柱,250 mm×10 mm i. d.,5 μm,德国MACHEREY-NAGEL公司)。分析型高效液相色谱仪(ProStar 210,美国VARIAN公司),分析型高效液相色谱柱(SymmetryTMC-18反相色谱柱,150 mm×4.6 mm i.d.,5 μm,SentryTMC-18保护柱,美国WATERS公司),ProStar 325高效液相色谱仪紫外-可见检测器(美国VARIAN公司)。
1.2 化学试剂(-)-[11C]HED的前体间羟胺(游离碱)(metaraminol free base)和(-)-HED标准品(盐酸盐)(HED Hydrochloride)为德国ABX公司产品。乙腈(HPLC级,美国FISHER SCIENTIFIC公司),乙醇(Ph Eur,BP,JP,USP级,德国MERCK公司),0.9%氯化钠注射液(天津市百特医疗用品有限公司)。除菌过滤器(Acrodisc 0.2 μm,美国PALL公司)。
1.3 (-)-[11C]HED的放射化学合成步骤利用回旋加速器轰击N2/O2混合气(99%N2,1%O2),发生14N(p,α)11C核反应,生产[11C]-CO2。经[11C]CH3I在线合成[11C]-CH3OTf(图1)[22]。

图1 在线制备[11C]-CH3OTf原理Fig 1On-line radiosynthesis principle of[11C]-CH3OTf
将前体间羟胺的乙腈溶液注入反应管,降温至0℃捕获[11C]-CH3OTf,待反应管内所测放射性活度达到最大后,在一定温度下加热进行甲基化反应(图2),反应完成后加入1.0 mL注射用水淬灭反应。1.4(-)-[11C]HED分离纯化利用氦气将反应管内的反应混合物经过色谱六通阀,转运到半制备HPLC色谱柱上进行分离纯化。色谱流动相为生理盐水/乙醇95/5(v∶v),流速4.5 mL·min-1,紫外检测波长设为280 nm,利用放射性和紫外检测器检测流出峰,对比标准品的保留时间确认产物。产物约8.5 min出峰,切峰后经0.2 μm除菌过滤器得到(-)-[11C]HED注射液。
1.5 单因素实验影响(-)-[11C]HED标记率的主要因素有甲基化反应温度、反应时间和前体用量,分别对以上3因素进行标记率的单因素实验。具体过程为0.3 mg前体,反应时间1 min,反应温度分别设置为0、25、50、60℃和70℃,计算不同反应温度下(-)-[11C]HED标记率。0.3 mg前体,反应温度70℃,反应时间分别设置为40 s、1 min、1.5 min、2 min和5 min,计算(-)-[11C]HED标记率。反应温度70℃,反应时间40 s,前体用量分别设置为0.1、0.2、0.3、0.4、0.5 mg,计算(-)-[11C]HED标记率。以上每个条件各进行5次实验,结果以±s形式表示。
1.6 正交设计实验以反应温度、反应时间和前体用量为实验因素,根据单因素实验结果,各选择3个影响(-)-[11C]HED标记率效果因素中有意义的水平,进行正交设计实验,经方差分析确定最优反应条件。因素水平设计见表1。
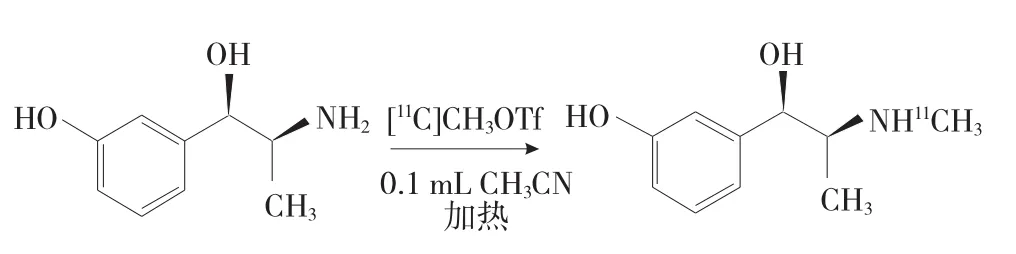
图2 放射化学合成(-)-[11C]HED过程Fig 2Radiosynthesis of(-)-[11C]HED
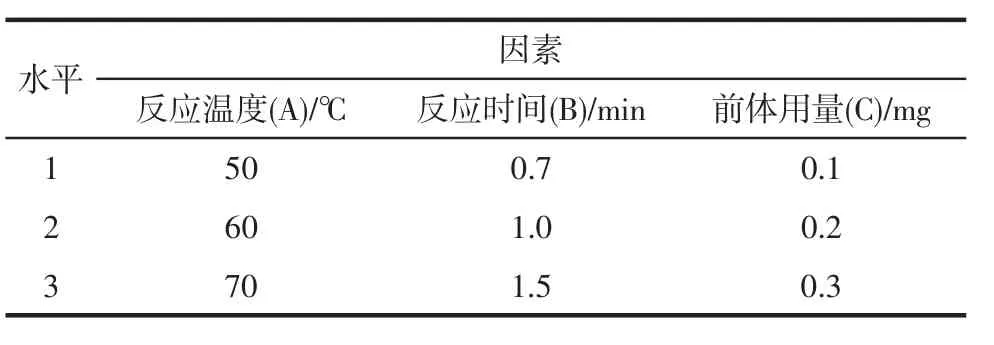
表1 优化放化合成(-)-[11C]HED反应条件的正交实验因素水平Tab 1Orthogonal experiment factors and levels of radiosynthesis (-)-[11C]HED
1.7 (-)-[11C]HED质量控制目测(-)-[11C]HED注射液性状、测定pH值、测量活度并计算放射性浓度。使用与半制备色谱同样的流动相,利用分析型HPLC检测产品的放射化学纯度和化学纯度。分别配制(-)-HED标准品的递增质量浓度(0、5、10、25、50、100、150 μg·mL-1)溶液,经分析型HPLC进样,绘制(-)-HED浓度-峰面积标准曲线,根据线性函数计算(-)-HED浓度及产物比活度。细菌内毒素和无菌检查方法参见《中华人民共和国药典》2010版(XI E细菌内毒素检查法和XI H无菌检查法)。
2 结果
2.1 单因素实验结果
2.1.1 反应温度在所测范围内,标记率随温度升高而提高。反应温度为70℃时标记率最高,见图3。
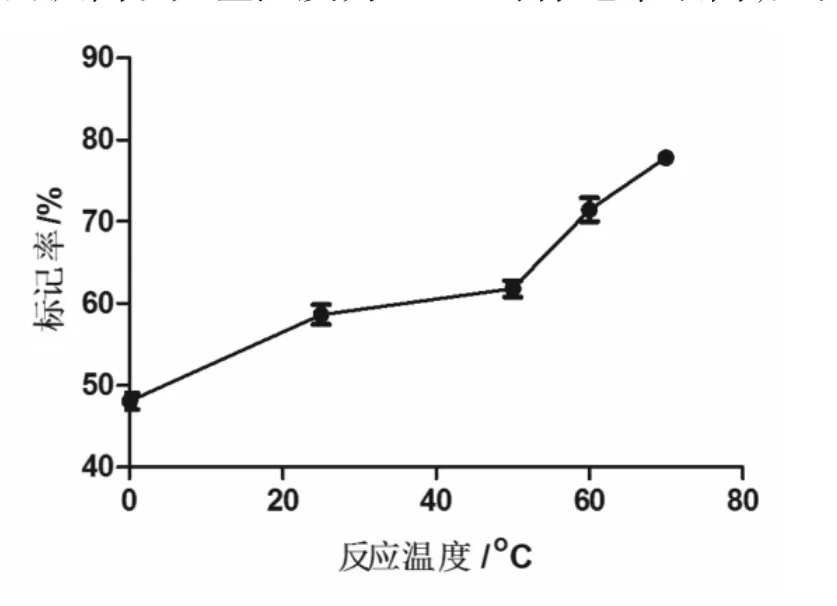
图3 反应温度-标记率曲线Fig 3Reaction temperature-labeling yield curve
2.1.2 反应时间在所测范围内,标记率随时间延长而降低。反应时间为40 s时标记率最高,见图4。

图4 反应时间-标记率曲线Fig 4Reaction time-labeling yield curve
2.1.3 前体用量在所测范围内,标记率随前体用量提高而增大。前体用量为0.5 mg时标记率最高,见图5。
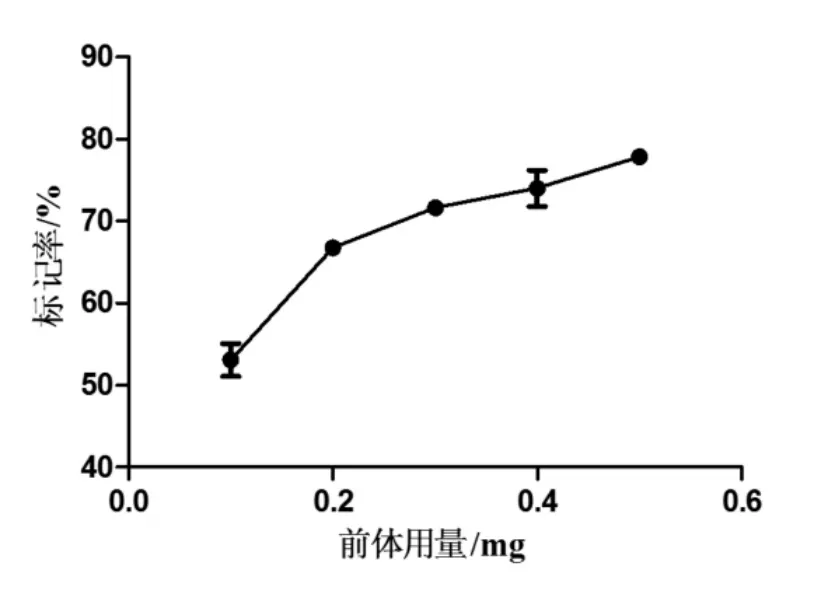
图5 前体用量-标记率曲线Fig 5The amounts of precursor-labeling yield curve
2.2 正交实验设计采用L9(34)正交表,取反应温度、反应时间和前体用量3因素为研究对象,各取3水平。每次以(-)-[11C]HED的放化合成反应标记率为指标进行正交实验。因素水平设计见表1,实验结果见表2。

表2 优化放化合成(-)-[11C]HED反应条件的正交实验设计与结果Tab 2Orthogonal experiment design and result of optimize radiosynthesis conditions of(-)-[11C]HED
2.3 (-)-[11C]HED放化合成工艺验证结合正交实验结果,前体用量超过0.3 mg会给增加分离纯化工作的难度,致使产物化学纯度大幅下降。因此,本研究最终采取的反应条件为反应温度70℃、前体用量0.2 mg、反应时间40 s。自[11C]-CO2轰击结束计时,本方法制备(-)-[11C]HED耗时约25 min。产物的不校正产率为(11.51±0.48)%(10.66%~12.33%)(n= 50),校正到[11C]CH3I活度的产率为(49.1±5.1)% (43.2%~60.9%)(n=50)。
质量控制结果显示本方法制备的(-)-[11C]HED为无色、澄清、透明溶液,pH值为6.5~7.0。从分析色谱的放射性谱图上看,约5 min出产物峰,与标准品以及掺入标准品的产物紫外谱图保留时间一致,证实产物峰为(-)-[11C]HED(图6)。产物放射化学纯度>99%(n=50),放射性比活度为(24.4±2.2)(19.4~27.8)GBq·μmol-1(n=50)(美国药典对受体类正电子药物要求分别为>90%和>18.5 GBq·μmol-1)。样品均无菌落发育,细菌内毒素低于检测下限(n=50)。所得结果表明(-)-[11C]HED放化合成条件是稳定的。
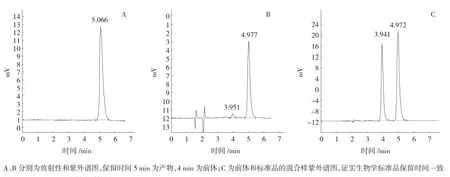
图6 (-)-[11C]HED注射液质控图Fig 6Results of quality control of(-)-[11C]HED
3 讨论
在(-)-[11C]HED的放化合成反应路线中,国外文献报道大多采用反应活性较高的[11C]-CH3OTf作为甲基化试剂[2,18-19]。国内学者多选取[11C]CH3I作为甲基化试剂,他们认为[11C]-CH3OTf作为甲基化试剂反应步骤较繁琐[21],或者实验结果欠理想[20]。本研究利用[11C]-CH3OTf作为甲基化试剂,因其活性较高在反应过程中能降低反应温度,缩短反应时间,减少前体用量。甲基化反应中会伴随有副产物的生成,半制备HPLC放射性谱图显示约11 min出副产物峰,但通过切峰可以有效地分离纯化。经大样本实验研究(n=50)证实最终产物质控合格。
在PET用正电子药物的研发和制备领域,运用单因素实验和正交实验的方法优化反应条件,以达到获得较高标记率和产率的目的,国内外尚罕见报道。在优化(-)-[11C]HED放化合成条件中(1)温度的升高可以提高标记率,溶剂乙腈的沸点是81.8℃,反应温度过高,可能会造成溶液沸腾损失,因此,在获得较为满意的标记率情况下,选定70℃为最佳反应温度。(2)分析色谱图显示产物未随反应时间的延长而分解,据此判断标记率随反应时间延长而下降的现象,可能的原因为标记率峰值出现在40 s以内。鉴于40 s时间短暂,在获得较为满意的标记率情况下,笔者认为不必再去探寻确切拐点。(3)前体投放量增加可以提高标记率。但增大前体量,虽经HPLC分离,产物中前体含量仍会明显增加,致使化学纯度下降。数据显示,前体量为0.3 mg时,产物中前体含量>30%,因此本研究选定的最佳前体用量为0.2 mg,以利于降低产物中前体残留量。此外,前体用量低于文献报道[2,18-20],亦有利于节省生产成本。
目前的国内外文献报道大多利用反相HPLC法分离纯化(-)-[11C]HED。有学者利用磷酸二氢钠/乙醇体系作为流动相[2,20]梯度洗脱,能更有效地去除前体间羟胺,但分离纯化耗时较长。Någren等[18]利用乙腈/磷酸溶液体系,流出液不适于直接注射,必须经过处理后方能应用于临床。国内有学者尝试利用磷酸盐缓冲盐水/乙醇体系方法分离纯化(-)-[11C]HED[21],其制备中利用活性相对较低的[11C]CH3I作为甲基化试剂,副产物少,易于分离纯化。本研究采用生理盐水/乙醇95/5(v∶v)体系作为分离纯化产物流动相,产物在8.5 min左右出峰,经切峰、除菌后可直接应用于临床显像。此外,研究中分析色谱采用和半制备色谱相同的流动相体系,亦在一定程度上简化了药物质控过程。
分析色谱紫外谱图显示产物溶液中含有微量前体间羟胺,含量<3%。间羟胺是临床使用的常规药物,成人静脉注射初量为0.5~5 mg,极量1次100 mg(每分钟0.3~0.4mg)。小儿常用量为静脉滴注按体质量0.4 mg·kg-1。Law等[23]报道注射0.1~0.2 nmol·kg-1的间羟胺对(-)-[11C]HED心肌摄取没有明显影响,但大于10 nmol·kg-1将影响心肌摄取,对其它脏器没有影响。国内有学者报道研究结果[20]与前述研究的心肌摄取结果类似。经计算,本研究所得产物中所含间羟胺的注射量<0.2 nmol·kg-1,因此不会对显像造成显著影响。
[1]刘磊,李彦生,陈秋松.反相高效液相色谱法测定正电子药物标准品及其前体[J].天津医科大学学报,2008,14(1):112
[2]Rosenspire K C,Haka M S,Van Dort M E,et al.Synthesis and preliminary evaluation of carbon-11-meta-hydroxyephedrine:a false transmitter agent for heart neuronal imaging[J].J Nucl Med,1990,31(8):1328
[3]付占立,王荣福.心脏神经显像[J].中华核医学杂志,2005,25(5):314
[4]Eriksson B,Örlefors H,Öberg K,et al.Developments in PET for the detection of endocrine tumors[J].Best Pract Res Clin Endocrinol Metab,2005,19(2):311
[5]袁志斌.PET显像在内分泌肿瘤中的应用[J].国外医学-放射医学核医学分册,2003,27(5):208
[6]Pietilä M,Malminiemi K,Ukkonen H,et al.Reduced myocardial carbon-11 hydroxyephedrine retention is associated with poor prognosis in chronic heart failure[J].Eur J Nucl Med,2001,28(3): 373
[7]Carrió I.Cardiac neurotransmission imaging[J].J Nucl Med,2001,42(7):1062
[8]Bengel F M,Ueberfuhr P,Schiepel N,et al.Effect of sympathetic reinnervationonallograftperformanceafterorthotopicheart transplantation[J].N Engl J Med,2001,345(10):731
[9]Calkins H,Allman K,Bolling S,et al.Correlation between scintigraphic evidence of regional sympathetic neuronal dysfunction and ventricular refractoriness in the human heart[J].Circulation,1993,88(1):172
[10]Allman K C,Stevens M J,Wieland D M,et al.Noninvasive assessment of cardiac diabetic neuropathy by11C-hydroxyephedrine and positron emission tomography[J].J Am Coll Cardiol,1993,22(6): 1425
[11]Stevens M J,Raffel D M,Allman K C,et al.Cardiac sympathetic dysinnervation in diabetes impjlications for enhanced cardiovascular risk[J].Circulation,1998,98(10):961
[12]Shulkin B L,Wieland D M,Schwaiger M,et al.PET scanning with hydroxyephedrine:an approach to the location of pheochromocytoma [J].J Nucl Med 1992,33(6):1125
[13]Shulkin B L,Wieland D M,Baro M E,et al.PET hydroxyephedrine imaging of neuroblastoma[J].J Nucl Med,1996,37(1):16
[14]Trampal C,Engler H,Juhlin C,et al.Pheochromocytomas:detection with11C hydroxyephedrine PET[J].Radiology,2004,230(2):423
[15]Mann G N,Link J M,Pham P,et al.[11C]metahydroxyephedrine and [18F]fluorodeoxyglucosepositronemissiontomographyimprove clinical decision making in suspected pheochromocytoma[J].Ann Surg Oncol,2006,13(2):187
[16]Franzius C,Hermann K,Weckesser M,et al.Whole-body PET/CT with11C-meta-hydroxyephedrine in tumors of the sympathetic nervous system:feasibility study and comparison with123I-MIBG SPECT/CT[J].J Nucl Med,2006,47(1):1635
[17]Yamamoto S,Hellman P,Wassberg C,et al.11C-hydroxyephedrine positron emission tomography imaging of pheochromocytoma:A single center experience over 11 years[J].J Clin Endocrin Metab,2012,97(7):2423
[18]Någren K,Müller L,Halldin C,et al.Improved synthesis of some commonly used PET radioligands by the use of[11C]methyl triflate [J].Nucl Med Biol,1995,22(2):235
[19]Van Dort M E,Tluczek L.Synthesis and carbon-11 labeling of the stereoisomers of meta-hydroxyephedrine(HED)and meta-hydroxypseudoephedrine(HPED)[J].J Labelled Cpd Radiopharm,2000,43(6):603
[20]尹大一,刘健,张晓军,等.11C-(-)间羟基麻黄素的合成及Micro PET显像[J].同位素,2012,25(1):21
[21]王治国,张宗鹏,张国旭,等.心脏交感神经受体显像剂11C标记羟基麻黄素合成方法优化[J].中国药师,2014,17(3):369
[22]Jewett D M.A simple synthesis of[11C]methyl triflate[J].Appl Radiat Isot,1992,43(11):1383
[23]Law M P,Osman S,Davenport R J,et al.Biodistribution and metabolism of[N-methyl-11C]-m-hydroxyephedrine in the rat[J]. Nucl Med Biol,1997,24(5):417
(2015-01-23收稿)
Optimization and improvement of production of(-)-[11C]meta-Hydroxyephedrine
LIU Lei,LI Yan-sheng,YU Hao-nan,CHEN Qiu-song
(Department of PET-CT Diagnostic,General Hospital,Tianjin Medical University,Tianjin 300052,China)
Objective:To optimize methylated conditions and improve purification protocol of(-)-[11C]meta-Hydroxyephedrine(-)-[11C]HED)synthesis,as a receptor of sympathetic nervous system,to get relatively high labeling yield.Methods:[11C]-CO2was produced via14N (p,α)11C nuclear reaction.11C-Methyl Triflate([11C]-CH3OTf),served as the[11C]methylation reagent,was obtained online by GE TRACERlab FXc synthesis module,and bubbled into reactor at 0℃until maximum radioactivity was accumulated.(-)-[11C]HED was synthesized by direct N-methylation of metaraminol with[11C]-CH3OTf.The product was purified by semi-preparative reversed-phase HPLC with the eluent saline/ethanol 95/5(v∶v).Single factor analysis and orthogonal experimental design were applied to investigate the optimized methylated synthesis conditions with L9(34)orthogonal test.Results:The reaction temperature was the main process factor,and the amount of precursor was the secondary factor.In consideration of the situation of orthogonal experimental results and purification,the optimum condition was A3B1C3,in which the reactor was heated to 70℃to ensure 0.2 mg precursor was methylated with[11C]-CH3OTf for 40 s.The validation test results illustrated that the total synthesis time of the tracer was approximately 25 min from end-of-bombardment.The radiochemical yield was(49.1±5.1)%(43.2%~60.9%)(n=50,corrected to[11C]CH3I).The radiochemical purity of the product was up to 99%(n=50).The specific activity was(24.4±2.2)(19.4~27.8)GBq·μmol-1(n=50)at end of synthesis.Conclusion:Reaction temperature,amounts of precursor and reaction time are the most important conditions for the methylated reaction.The automatic radiosynthesis procedure of(-)-[11C]HED with relatively high radiochemical yield is convenient and efficient.
positron emission tomogaphy;(-)-[11C]meta-Hydroxyephedrine;radiosynthesis;orthogonal design;purification
R445
A
1006-8147(2015)05-0441-05
刘磊(1981-),男,主管技师,硕士,研究方向:药物化学
及正电子药物研发与合成;通信作者:陈秋松,E-mail:qs_c8@hotmail.com。
