分析第6版和第7版TNM分期在肺腺癌患者中的差异
2015-11-18赵青春韦森张洪兵任典陈军
赵青春,韦森,张洪兵,任典,陈军
(天津医科大学总医院肺部肿瘤外科,天津 300052)
分析第6版和第7版TNM分期在肺腺癌患者中的差异
赵青春,韦森,张洪兵,任典,陈军
(天津医科大学总医院肺部肿瘤外科,天津 300052)
目的:分析国际肺癌研究协会第6版和第7版TNM分期在肺腺癌患者中的差异。方法:对302例术后确诊为肺腺癌的患者按照第6版和第7版TNM分期标准进行重新分期,对比两种分期下患者的分期组成结构及预后情况。结果:入组患者中共有71(23.5%)例存在分期变动,其中36(11.9%)例分期升级,35(11.6%)例分期降级。生存分析结果显示第7版分期与第6版分期在肺腺癌患者中无显著差异,且相邻组别之间术后生存时间未见明显差异。结论:肺腺癌复杂的病理组织亚型和高基因突变率以及跨叶型肺癌特殊的T分期均会影响患者的预后。结合临床分期、病理类型以及基因型等多因素共同评估患者预后将成为诊治肺腺癌新的发展趋势。
肺腺癌;TNM分期;跨叶型肺癌;靶向治疗;基因突变;预后
肺癌是世界范围内患病率和死亡率最高的恶性肿瘤,5年生存率约为15%,且其患病率呈逐年上升趋势[1]。肺癌分期对于制定正确的治疗方案,准确判断患者预后有重要的指导意义。随着人们对肺癌的研究进展以及肺癌诊治的长足进步,2009年由国际抗癌联盟(UICC)颁布的第7版肺癌分期标准已被世界各国采纳并被广泛应用[2]。新分期入组临床病例数远远超过前6版总的病例数,且范围不仅局限于欧美国家,因而更具广泛性和权威性。第7版的大体结构仍与第6版相似,但细节方面做了一些改动,较以前的各个版本更具有科学性及说服力。目前已有大量相关文献报道证实第7版TNM分期较第6版分期更能准确地反映出处于不同病期患者的预后情况,从而指导更有效的治疗[3-7]。但无论新旧版分期均未能明确跨叶型肺癌(adjacent lobe invasion,ALI)的定义,且未能有效结合病理分型对患者预后进行准确地预测,尤其是随着分子靶向技术研究的进展以及分子靶向药物的广泛应用,术后干预必将影响患者的预后,以上因素均会导致肺癌不同分期相对应的生存时间发生改变。肺腺癌是非小细胞肺癌(NSCLC)中最常见的类型之一,其病理分型及分子分型越来越受到人们的广泛关注。如何结合肺腺癌临床分期、病理分类及分子分型来有效预测患者的预后,从而寻求肺腺癌个体化治疗方法成为人们研究的热点。本研究针对中国部分肺腺癌患者作回顾性研究,旨在比较肺腺癌患者在新版TNM分期较旧版TNM分期的期别变化,以及不同期别对应预后的差异,分析产生该差异的影响因素。
1 对象和方法
1.1 研究对象收集天津医科大学总医院肺部肿瘤外科2008年1月-2013年6月行肺部手术且术后确诊为腺癌的397例患者,其中63例患者术后失访,剩余患者中有29例为单纯胸膜活检或单纯肺叶楔形切除而不能明确N分期;3例患者围手术期死亡;最终有302例患者纳入研究。所有患者临床资料均来自既往住院病历。对每一例患者分别按照第6版和第7版肺癌TNM分期标准进行分期。第7版TNM分期与第6版TNM分期比较见表1。采用电话方式对患者进行随访,术后生存时间定义为手术当天起至最后随访时间,死亡患者至死亡当天。统计比较新旧分期下患者的期别组成结构,新旧分期变化,不同分期所对应的病理亚型、表皮生长因子受体(EGFR)的突变情况及ALI患者的临床特征。
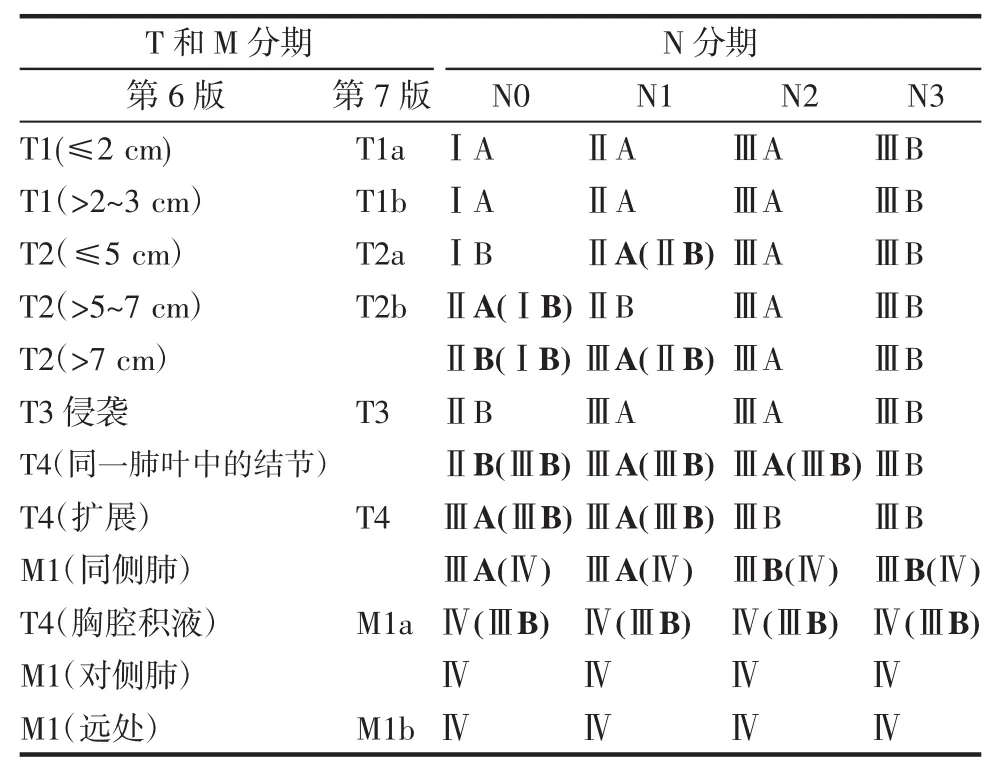
表1 第7版TNM分期对比第6版TNM分期做出的修订
1.2 病理分型302例患者病理切片均从医院病理科重新调阅,经两位经验丰富的高年资病理科医生采用盲法阅片,重新确诊病理亚型,对于诊断意见不一致的样本进行多次探讨并最终达成一致观点。分型标准参照2011年国际肺癌研究学会、美国胸科学会和欧洲呼吸学会(IASLC/ATS/SERS)联合推出的肺腺癌国际多学科分类新标准[8]。浸润前腺癌包括原位腺癌(AIS)和微浸润性腺癌(MIA),浸润性腺癌以5%的增量半定量法评估组织学类型并选择一种作为主要类型,可分为伏壁样生长为主型(LPD)、腺泡样为主型(ACI)、乳头状为主型(PAP)、微小乳头状为主型(MIP)和实体型为主型(SOL),此外还包括浸润性黏液腺癌(IMA)、胶质型腺癌和肠型腺癌等在内的浸润性肺腺癌变异亚型(VIA)。
1.3 基因检测共有176例患者行EGFR检测,该检测统一由益善生物技术有限公司(中国广州)执行。检测采用基因芯片技术,具体检测方法参考标准方案进行[9]。
1.4 跨叶型肺癌鉴定ALI被定义为肿瘤跨越叶间胸膜而直接侵犯同侧相邻肺叶,且肿瘤未曾侵袭壁层胸膜、纵隔胸膜、膈神经、胸壁及上腔静脉等大血管,且排除远处转移。通过结合胸部强化CT和术中所见共同鉴定ALI(图1)。

图1 典型ALI患者的胸部强化CT
1.5 统计学分析不同组别患者临床特征差异的比较采用χ2检验或Fisher精确检验法进行。应用Log-rank方法分析比较不同组别患者之间术后生存时间的差异。所有统计学数据均采用SPSS 17.0软件进行分析,P<0.05被认为有统计学意义。
2 结果
入组的302例肺腺癌患者中,男性158例,女性144例;中位年龄62岁(32~84岁);吸烟患者124例,非吸烟患者178例;随访至2014年7月25日,生存患者209例,死亡93例,中位生存时间778 d;肺段切除24例,肺叶切除192例,双叶切除(包括肺叶切除加相邻肺叶部分切除)54例,全肺切除3例,袖式成形加肺叶切除29例。
按照第6版和第7版肺癌分期标准对所有肺腺癌患者进行TNM分期,结果总结见表2、3。共有71例(23.5%)患者存在分期变动,其中36例(11.9%)分期降级,包括6例ⅠB变为ⅡA,8例ⅠB变为ⅡB,22例ⅢB变为Ⅳ;35例(11.6%)分期升级,包括21例ⅡB变为ⅡA,4例ⅢB变为ⅡB,4例ⅢB变为ⅢA,5例Ⅳ变为ⅢA,1例Ⅳ变为ⅢB。

表2 按照第6版分期和第7版分期标准对肺腺癌患者进行分期结果[n(%)]
患者按照第6版和第7版TNM分期标准分期,不同期别生存曲线见图2(a,b)。参照图2结果可知,无论是第6版分期还是第7版分期均不能准确地体现患者的预后情况。

表3 302例肺腺癌患者TNM分期修订后重新分布情况[n(%)]
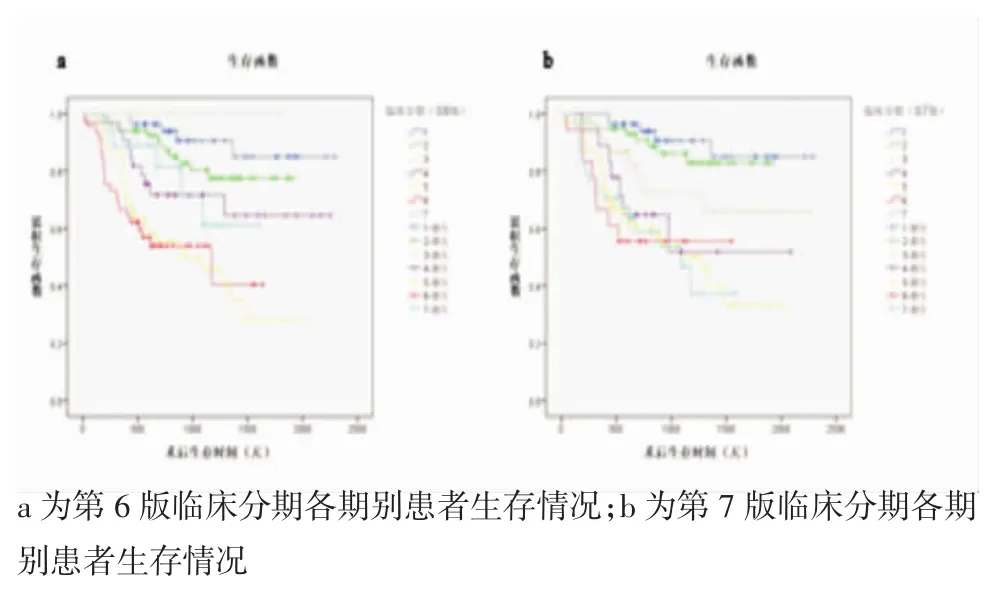
图2 不同期别肺腺癌患者生存曲线
依照肺癌国际多学科分类标准将患者病理标本重新进行分型,结果AIS 1例,MIA 1例,浸润性腺癌中最多的为ACI 120例,其次为SOL 70例,PAP 47例,LPD 41例,MIP8例,此外还有浸润性腺癌变异亚型14例。患者病理类型按照第6版和第7 版TNM分期的分布情况见表4。

表4 肺腺癌患者病理亚型在新旧版分期中的分布情况[n(%)]
共有78例(44.3%,78/176)患者存在EGFR突变,其中包括19号外显子突变40例,21号外显子突变38例。其中19号和21号外显子突变在第6版和第7版不同期别中的例数分别为ⅠA期(6,6)、ⅠB期(16,16)、ⅡA期(2,8)、ⅡB期(8,3)、ⅢA期(16,18)、ⅢB期(22,9)、Ⅳ期(8,18)。
共有17例患者确诊为ALI,平均年龄为(55.9± 12.0)岁;其中男性7例,女性10例;吸烟患者9例,非吸烟患者8例;肿瘤位于左侧肺叶2例,肿瘤位于右侧肺叶15例;手术方式包括肺叶加肺段切除5例、双肺叶切除(右侧)11例、单侧全肺切除1例;淋巴结N分期分别为N0期4例、N1期2例、N2期11例。
3 讨论
肺癌TNM分期的目的就是为了更准确地了解肺癌患者处于疾病的哪一个阶段,对于安排治疗计划以及对预后的判断有重要的指导作用。2009年新版UICC肺癌TNM分期(第7版分期)标准主要是根据患者的5年生存率及中位生存期来制定的,该分期的优越性和权威性已被全世界广泛接受和认可。然而随着新版肺癌分期的广泛应用,其局限性也逐渐被人们所认知。本研究中,无论第6版分期还是第7版分期,均未能准确体现出各期别术后生存时间的差异,分析原因可能有如下几点。
3.1 肺腺癌病理亚型的影响2011年IASLC/ATS/ ERS联合推出的肺腺癌国际多学科分类新标准将肺腺癌分为多种亚型,目前已有相关文献证实各种亚型腺癌患者预后存在差异,其中LPD预后最好,其次为ACI和PAP,MIP和SOL预后较差[8]。如表5所示,本研究ⅠA期和ⅠB期患者中LPD分布最多,SOL主要分布在Ⅲ~Ⅳ期患者中,其余病理类型分布未见明显规律。肺腺癌亚型的差异可能导致患者预后与TNM分期的预后不一致。此外,有学者在肺腺癌病理亚型的研究中发现,病理亚型与EGFR突变状态存在相关性,并认为EGFR突变在非黏液性BAC、乳头状和微乳头状腺癌亚型中发生率更高而在其他组织学亚型中发生率较低,尤其在黏液性BAC亚型中EGFR突变率更低[10]。但肺腺癌病理类型和分子分型的内在关系研究仍在探索阶段。由于病理类型和EGFR突变关系密切,从而可能导致患者服用靶向药物的机会存在差异,因而从侧面角度反映了患者的预后情况,同时也证明单一利用临床分期来预测患者的预后存在一定的不足。
3.2 靶向药物治疗的影响研究证实EGFR作为酪氨酸激酶抑制剂(TKIs)敏感性和有效性的预测指标,在白种人群中的突变率为5%~20%,在亚裔肺腺癌患者中的突变率为20%~60%[11-16]。本研究经基因突变检测的176例患者中,共有44.3%(78/176)存在EGFR突变,19和21外显子突变占44.3%(78/ 176),其突变率与其他报道相符。本研究数据显示,19和21外显子突变主要分布在Ⅲ~Ⅳ期患者中,第6版分期Ⅲ~Ⅳ期患者中EGFR突变型占EGFR突变(19和21外显子突变)总数的59.0%(46/78);第7版分期Ⅲ~Ⅳ期患者中EGFR突变型占EGFR突变(19和21外显子突变)总数的57.7%(45/78)。该结果意味着中晚期肺腺癌患者中有超过一半的患者均存在EGFR突变,极大地增加了口服靶向药物治疗的概率,有效地改善了患者的预后,甚至促使预后优于分期较低的组别。此外,本研究结果还显示,EGFR突变在ⅠB期患者中分布比例较大(20.5%,16/78),提示ⅠB期患者可能有更多机会一线或二线应用口服靶向药物而从中获益,因此导致ⅠA期和ⅠB期患者预后无显著差异。近来有研究者发现,相比EGFR野生型的患者,EGFR突变患者对于化学药物治疗也显示出更好的敏感性和反应性[17]。因此,进一步导致新旧版分期下各期别患者预后情况的交叉现象。
3.3 跨叶型肺癌(ALI)T分期的影响无论是第6版还是第7版TNM分期,均未对ALI的T分期作出明确的定义。针对于ALI应归类为T2还是T3的问题,不同的学者对其预后做了统计分析比较,但得出的结论不同。Miura等[18]研究发现,ALI患者的5年生存率为34.2%,中位生存期为56.5个月,其预后明显优于T3组患者,且其差异有统计学意义,故推荐ALI应归类为T2分期。然而,更多的学者们[19-22]得出了相反的结论,因此他们认为NSCLC伴有ALI的患者应按照T3分期来处理。Nonaka等[23]首次将ALI分为鳞癌组和腺癌组,分别同T2和T3组患者比较,结果证实仅伴有ALI的鳞癌患者应归类为T2,而ALI腺癌则应归类为T3。截至目前我们尚未找到对仅针对肺腺癌伴ALI患者的相关研究。由于T分期不同,则临床分期也不尽相同,相对应的手术方式也不同,这些因素都直接影响到临床分期对患者术后生存情况的预测,同时也可能导致不同期别患者预后情况的交叉现象。
3.4 手术指征变化的影响第7版TNM分期确定淋巴结阴性脑单发转移分期为Ⅳ期,不推荐手术,但目前临床已有报道,外科手术治疗非小细胞肺癌合并孤立性脑转移灶的患者可以取得良好的治疗效果,尤其是腺癌患者及无纵隔淋巴结转移的患者生存期明显延长[24]。这些患者虽被分为Ⅳ期,但手术切除可取得良好效果,甚至某些患者预后好于ⅢB期或ⅢA期患者。由于手术技术进步与多种治疗径路的选择以及术后治疗的进展,使T4期的肿瘤不能切除的概念发生了改变,如T4期“肿瘤侵犯大血管”为非手术指征,但分期系统并没有说明是哪些大血管或“大血管”的范围究竟应包括到哪一级。实际临床上,如<7 cm的肿瘤仅有周围血管侵犯或上腔静脉、无名静脉、肺动脉等血管小范围受侵,但其受累长度均能达到手术钳闭要求时,均认为可以切除。我科以治疗中晚期肺癌为特色,其中不乏原发肺癌合并孤立性脑转移的患者,行上腔静脉及无名静脉部分切除、人造血管置换术的患者也不在少数。这些患者大多可通过手术获益,使生存期明显延长,因此造成晚期患者预后优于中期患者甚至早期患者的现象也不足为奇。
3.5 其他因素的影响由于术前胸部CT检查遗漏或敏感性低,致使肺部、胸膜或远处病灶未能及时查出,从而可导致错误分期。此外,本研究纳入病例较少,调查区域局限,其准确性及有效性可能稍差。以上诸多因素均可导致临床分期各期别患者预后交叉的现象。期待更多、更广泛、更严谨的研究在未来展开。
由于肺腺癌病理类型特殊,且跨叶型肺癌的T分期尚不明确,单纯依靠临床TNM分期不能准确地预测患者预后。随着肺腺癌病理亚型的深入研究及分子靶向治疗的飞速发展,进一步研究肺腺癌临床TNM分期、病理亚型和分子分型三者之间的内在关系,并联合三者有效预测患者预后将成为诊断和治疗肺腺癌的新趋向。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225
[2]Groome P A,Bolejack V,Crowley J J,et al.The IASLC lung Cancer staging project:Validation of the proposals for revision of the T,N,andMdescriptorsandconsequentstagegroupingsinthe forthcoming(seventh)edition of the TNM classification of malignant tumours[J].J Thorac Oncol,2007,2(8):694
[3]Kameyama K,Takahashi M,Ohata K,et al.Evaluation of the new TNM staging system proposed by the International Association for the Study of Lung Cancer at a single institution[J].J Thorac Cardiovasc Surg,2009,137(5):1180
[4]Fukui T,Mori S,Hatooka S,et al.Prognostic evaluation based on a new TNM staging system proposed by the International Association for the Study of Lung Cancer for resected non-small cell lung cancers[J].J Thorac Cardiovasc Surg,2008,136(5):1343
[5]Ruffini E,Filosso P L,Bruna M C,et al.Recommended changes for T and N descriptors proposed by the International Association for the Study of Lung Cancer-Lung Cancer Staging Project:a validation study from a single-centre experience[J].Eur J Cardiothorac Surg,2009,36(6):1037
[6]Suzuki M,Yoshida S,Tamura H,et al.Applicability of the revised International Association for the Study of Lung Cancer staging system to operable non-small-cell lung cancers[J].Eur J Cardiothorac Surg,2009,36(6):1031
[7]Yoshida Y,Murayama T,Sato Y,et al.Validation of 7th TNM staging system for lung cancer,based on surgical outcomes[J].Asian Cardiovasc Thorac Ann,2013,21(6):693
[8]Travis W D,Brambilla E,Noguchi M,et al.International association for the study of lung cancer/American thoracic society/European respiratory society:international multidisciplinary classification of lung adenocarcinoma:executive summary[J].Proc Am Thorac Soc,2011,8(5):381
[9]Li G Q,Luo X D,He J Y,et al.A novel liquidchip platform for simultaneous detection of 70 alleles of DNA somatic mutations on EGFR,KRAS,BRAF and PIK3CA from formalin-fixed and paraffin-embedded slides containing tumor tissue[J].Clin Chem Lab Med,2011,49(2):191
[10]Inamura K,Ninomiya H,Ishikawa Y A.Is the epidermal growth factor receptor status in lung cancers reflected in clinicopathologic features[J].Arch Pathol Lab Med,2010,134(1):66
[11]Pao W,Girard N.New driver mutations in non-small-cell lung cancer[J].Lancet Oncol,2011,12(2):175
[12]Li C,Sun Y H,Fang Z Y,et al.Comprehensive analysis of epidermal growth factor receptor gene status in lung adenocarcinoma[J].J Thorac Oncol,2011,6(6):1016
[13]Liam C K,Wahid M,Rajadurai P,et al.Epidermal growth factor receptor mutations in lung adenocarcinoma in Malaysian patients[J]. J Thorac Oncol,2013,8(6):766
[14]Yoshizawa A,Sumiyoshi S,Sonobe M,et al.Validation of the IASLC/ATS/ERS lung adenocarcinoma classification for prognosis and association with EGFR and KRAS gene mutations:analysis of 440 Japanese patients[J].J Thorac Oncol,2013,8(1):52
[15]Bauml J,Mick R,Zhang Y,et al.Frequency of EGFR and KRAS mutations in patients with non small cell lung cancer by racial background:Do disparities exist[J].Lung Cancer,2013,81(3):347
[16]Boch C,Kollmeier J,Roth A,et al.The frequency of EGFR and KRAS mutations in non-small cell lung cancer(NSCLC):routine screening data for central Europe from a cohort study[J].BMJ Open,2013,3(4)
[17]MaemondoM,InoueA,KobayashiK,etal.Gefitinibor chemotherapy for non-small-cell lung cancer with mutated EGFR [J].N Engl J Med,2010,362(25):2380
[18]Miura H,Taira O,Uchida O,et al.Invasion beyond interlobar pleura in non-small cell lung cancer[J].Chest,1998,114(5):1301
[19]Okada M,Tsubota N,Yoshimura M,et al.How should interlobar pleural invasion be classified?Prognosis of resected T3 non-small cell lung cancer[J].Ann Thorac Surg,1999,68(6):2049
[20]Demir A,Gunluogtu M Z,Sansar D,et al.Staging and resection of lung cancer with minimal invasion of the adjacent lobe[J].Eur J Cardiothorac Surg,2007,32(6):855
[21]Yang H X,Hou X,Lin P,et al.Peripheral direct adjacent lobe invasion non-small cell lung cancer has a similar survival to that of parietal pleural invasion T3 disease[J].J Thorac Oncol,2009,4(11): 1342
[22]Haam S J,Park I K,Paik H C,et al.T-stage of non-small cell lung cancer directly invading an adjacent lobe[J].Eur J Cardiothorac Surg,2012,42(5):807
[23]Nonaka M,Kataoka D,Yamamoto S,et al.Outcome following surgery for primary lung Cancer with interlobar pleural invasion[J]. Surg Today,2005,35(1):22
[24]贾克刚,丛伟,薛洋,等.非小细胞肺癌合并孤立脑转移灶的手术疗效观察[J].华西医学,2012,(11):1634
(2015-03-20收稿)
R734.2
A
1006-8147(2015)05-0432-05
天津市科技计划项目基金资助(12ZCDZSY16100)
赵青春(1988-),男,硕士在读,研究方向:胸心外科学;通信作者:陈军,E-mail:huntercj2004@yahoo.com。
