新辅助化疗在局部晚期口腔癌中的疗效分析
2015-11-18刘晓楠卓姗姗岳玖玲张文超张仑
刘晓楠,卓姗姗,岳玖玲,张文超,张仑
(天津医科大学肿瘤医院颌面耳鼻喉肿瘤科,国家肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室,天津 300060)
新辅助化疗在局部晚期口腔癌中的疗效分析
刘晓楠,卓姗姗,岳玖玲,张文超,张仑
(天津医科大学肿瘤医院颌面耳鼻喉肿瘤科,国家肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室,天津 300060)
目的:探讨新辅助化疗在局部晚期口腔鳞癌中的疗效,分析影响局部晚期口腔癌预后的危险因素。方法:收集行新辅助化疗的局部晚期口腔癌患者的临床病理资料,并对预后影响因素行相关性分析。结果:新辅助化疗有效率为64.8%,完全缓解率为5.6%,部分缓解率为59.2%;肿瘤T分期降低者83例,降低2期者25例,降低1期者58例。患者的中位生存期为29个月,可手术组30个月,不可手术组21个月。多因素分析显示淋巴结转移、手术治疗、游离皮瓣修复、手术切缘为局部晚期口腔癌预后影响因素。结论:新辅助化疗降低局部晚期口腔癌的分期,提高手术率,使患者生存获益。淋巴结转移、手术治疗、游离皮瓣修复、手术切缘是预后的独立危险因素。
局部晚期口腔癌;新辅助化疗;手术治疗;可切除率;预后
局部晚期口腔癌是指临床分期为Ⅲ、Ⅳ期的口腔癌[1]。其病变范围广泛,侵犯咀嚼肌间隙、翼板、颅底、颈内动脉的病变被认为是手术的禁忌。而穿透骨皮质、侵犯舌深部肌肉等邻近结构的病变手术往往难以获得安全切缘[2]。因此对于局部晚期口腔癌多采用新辅助化疗,根据化疗疗效决定行手术治疗、放疗等后续治疗。本文对108例采用新辅助化疗的Ⅲ、Ⅳ期的局部晚期口腔癌患者的治疗疗效及生存预后因素进行分析。
1 资料与方法
1.1 一般资料收集天津医科大学肿瘤医院2005 年1月-2009年12月初治的行新辅助化疗的局部晚期口腔癌患者病例资料,末次随访日期截止至2014年10月31日,共收集病例108例。年龄18~88岁,平均年龄58岁。男性72例,女性36例。新辅助化疗后88例行手术治疗,其中28例根据病情行术后辅助放化疗;20例未行手术治疗而行根治性放疗。
1.2 研究方法
1.2.1 入组标准所有患者组织切片检查经我院病理医师确诊为鳞状细胞癌,未经过其他抗肿瘤治疗,治疗前及治疗过程中未发生远处转移。根据国际抗癌联盟(UICC)2002分期标准,结合病史、影像学资料、体格检查进行准确的TNM分期。经辅助检查无明显化疗禁忌,行新辅助化疗。
1.2.2 化疗方案铂类为主的两药联合化疗(DF)48例,剂量为:顺铂75~100 mg/m2静脉滴注d1~2;5-FU 750 mg/m2静脉滴注d2~6。多西他赛+奈达铂+替加氟(TPF)三药联合60例:多西他赛75 mg/m2静脉滴注d1,奈达铂80 mg/m2静脉滴注d1~2,替加氟15 mg/kg静脉滴注d2~6。
1.2.3 疗效评价化疗结束后重新进行体格检查以及复查头颈部CT、MRI、颈部彩超等,对比化疗前后的检查结果评价疗效。依据实体瘤疗效评价标准RECIST(version1.1)评价化疗疗效:完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),将完全缓解(CR)以及部分缓解(PR)视为化疗有效(RR)。
1.2.4 手术治疗88例患者经新辅助化疗后接受手术治疗,行原发灶扩大切除术,安全切缘至少为2 cm,cN0的患者行Ⅰ~Ⅲ区的选择性颈部淋巴结清扫术,cN+的患者行根治性颈部淋巴结清扫术。组织缺损大的患者同时行游离皮瓣组织缺损修复术及功能重建术:其中30例采用前臂皮瓣,18例采用股前外侧皮瓣,4例采用胸大肌皮瓣行软组织缺损修复术,4例采用腓骨肌皮瓣,2例采用髂骨肌皮瓣行骨组织缺损修复术。28例患者由于手术切缘阳性或组织学分级为低分化癌接受术后辅助治疗,其中10例患者接受2周期TPF方案化疗,剂量同前。18例在术后6周内接受术后放化疗,剂量为40~60 Gy,2 Gy/d,顺铂增敏每周30 mg/m2。
1.2.5 放疗20例患者不可行手术治疗而行根治性放疗,剂量为60~75 Gy,2 Gy/d,顺铂增敏每周30 mg/m2。1例患者行调强放疗,其余患者行三维适形放疗。其中1例行27 Gy放疗后因不能耐受而暂停治疗,休息后完成放疗计划。其余所有患者均按时完成放疗计划。
1.3 随访收集患者临床病理特征资料,包括性别、年龄、肿瘤部位、组织学分级、TNM分期、治疗方案、复发、局部淋巴结转移、远处转移等情况。采取电话、门诊复查等方式进行随访。统计5年总生存率,采用Cox回归模型分析影响患者预后的因素。生存时间的计算是从确诊日期起到死亡之日或末次随访日。
1.4 统计学方法采用SPSS17.0软件处理。组间比较采用χ2检验。Kaplan-Meier法用于不同组别的OS,并进行Log-Rank检验。采用Cox回归模型分析影响局部晚期口腔癌患者预后的因素。以P<0.05为差异有统计学意义。
2 结果
2.1 患者的基本临床病理特征临床分期(UICC,2002):III期43例,IV期65例。舌癌34例,牙龈癌49例,硬腭癌4例,口底癌12例,口颊癌9例。T分期:T1期3例,T2期31例,T3期33例,T4期41例。66例有颈部淋巴结转移,42例无颈部淋巴结转移。组织学分级:高分化67例,中分化33例,低分化8例。88例患者行手术治疗,其中58例患者同时行组织缺损修复术。手术切缘阳性者24例,阴性者64例。34例局部复发,9例远处转移。
2.2 化疗有效率新辅助化疗结束后共有6例患者获得完全缓解,64例患者获得部分缓解,总有效率为64.8%,两药联合化疗有效率52.1%(25/48),三药联合化疗有效率75%(45/60)(表1)。TPF方案的有效率高于DF方案,差异具有统计学意义(χ2= 6.141,P=0.013)。

表1 两种化疗方案的疗效(例)Tab 1Effects of TPF and DF therapy(n)
2.3 化疗前后的T分期的变化根据化疗前后影像学及体格检查比较肿瘤大小的变化判断化疗后T分期的变化,共有83例降期,其中两药方案29例,三药方案54例;降低2期以上者共25例,两药方案7例,三药方案18例;降低1期以上者58例,两药方案22例,三药方案36例;不可切除者变为可切除者的比例为51.2%(21/41)。见表2、3。
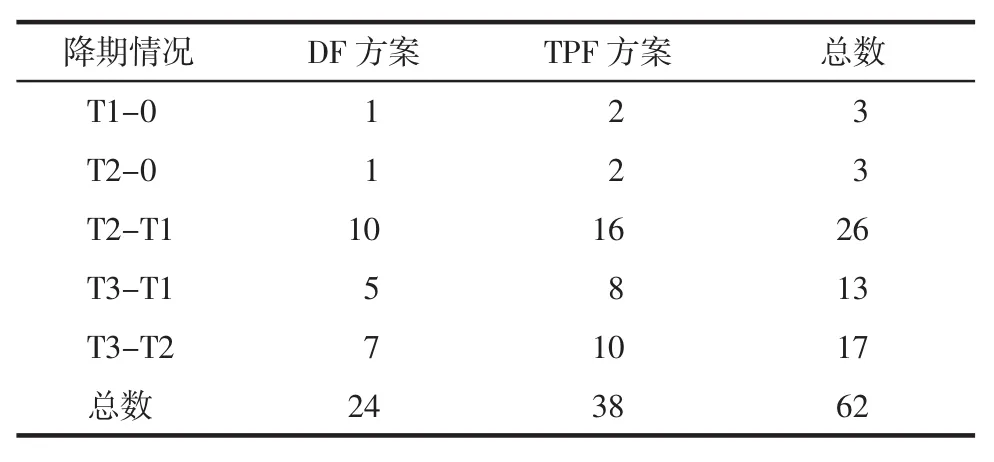
表2 可手术者(T1-T3期)的降期情况(例)Tab 2Change of patients with surgery at tumor stage(T1-T3)(n)

表3 不可手术者(T4期)的降期情况(例)Tab 3Change of patients without surgery at tumor stage(T4)(n)
2.4 两种化疗方案的生存率比较DF方案的中位生存时间为25个月,TPF方案的中位生存时间为33个月,TPF方案延长了生存时间,但差异无统计学意义(图1)(χ2=1.395,P=0.238)。

图1 DF/TPF两种化疗方案的生存曲线比较Fig 1Survival functions of patients with DF/TPF
2.5 手术对生存率的影响患者中位生存期为29 (25~32)个月,可手术组的生存时间为30(25~34)个月,不可手术组的生存时间为21(10~31)个月,前者的生存率高于后者,差异具有统计学意义,见图2 (χ2=7.592,P=0.006)。
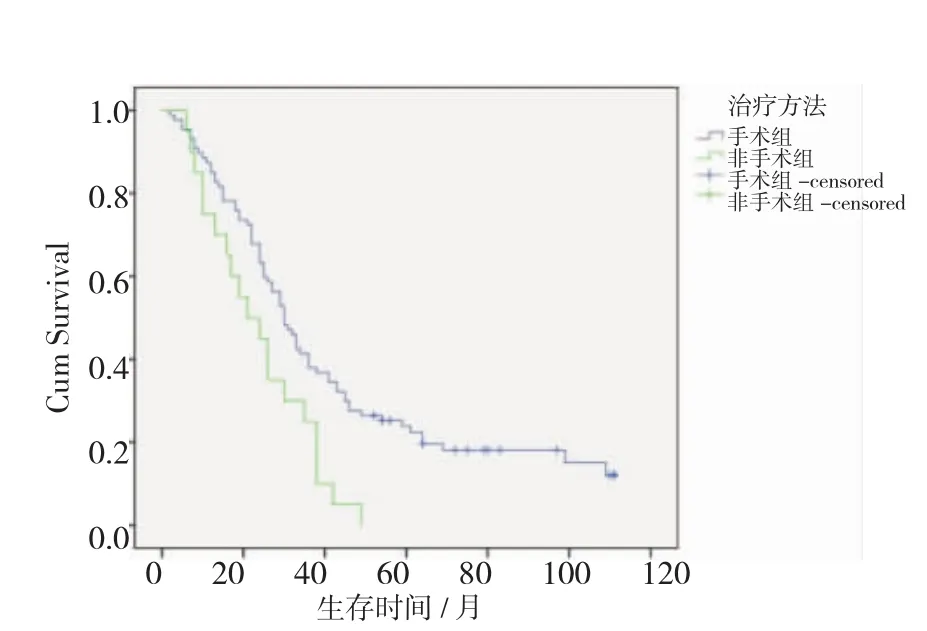
图2 可手术组与不可手术组的生存曲线比较Fig 2Survival functions of patients with surgery vs without surgery
2.6 是否行缺损修复重建对生存率的影响58名选择行游离皮瓣组织缺损修复术患者的中位生存时间为33(22~43)个月,30名未选择组织缺损修复术患者的中位生存时间为26(19~32)个月,两者差异具有统计学意义(χ2=3.949,P=0.047)(图3)。

图3 两种手术方式生存曲线的比较Fig 3Survival functions of two surgery methods
2.7 预后因素分析应用Cox回归模型分析患者的临床病理因素包括肿瘤部位、临床分期、T分期、淋巴结转移、组织学分级以及治疗因素包括治疗方式(可手术与不可手术)、游离皮瓣修复、手术切缘对患者预后的影响,结果显示淋巴结转移、治疗方式、游离皮瓣修复、手术切缘是影响Ⅲ/Ⅳ期口腔癌预后的独立危险因素。见表4。
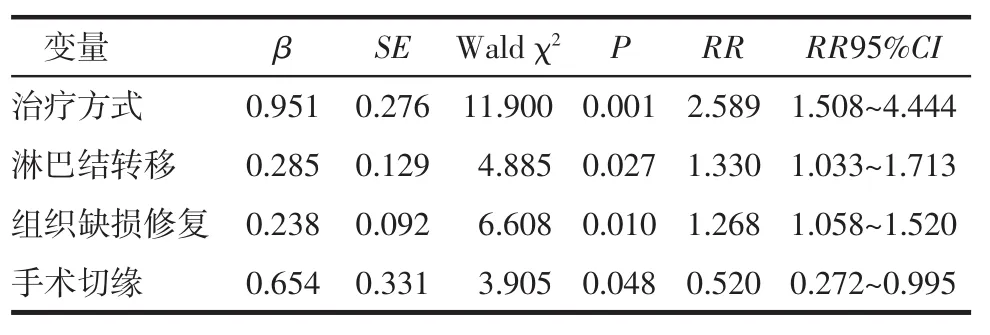
表4 局部晚期口腔癌预后因素分析Tab 4Prognosis factor analysis on locally advanced oral cavity cancers
3 讨论
口腔癌的治疗方案是包括手术、放疗、化疗以及生物治疗等的综合治疗,但手术治疗仍是口腔癌治疗的基石[3]。对于晚期口腔癌根治性放化疗或根治性放疗的疗效并不满意,而手术的可切除性可使这部分患者受益[4,5]。Patil等[6]报道T4a/4b期局部晚期口腔癌患者,手术组的2年局部控制率、中位生存期以及两年生存率均高于非手术组。本研究结果也显示新辅助化疗后可手术组的生存率要高于不可手术组,并且多因素分析结果显示手术治疗是独立的预后因素,因此手术治疗在局部晚期口腔癌的治疗中仍占有重要地位。此外,游离皮瓣修复重建技术的应用不仅可以完整切除瘤灶进而获得安全切缘,而且可以改善手术带来的容貌缺陷及功能缺损。de Vicente等[7]对98例口腔癌的随访结果显示行游离皮瓣修复术的患者死亡率为47%,而未行皮瓣修复术的死亡率为67.3%,游离皮瓣修复术可以降低口腔癌患者的死亡率。在我们的研究中进一步证实了游离皮瓣修复术在口腔癌治疗中的优势,Kaplan-Meier生存曲线显示行游离皮瓣修复术组的生存率高于未修复组,且多因素分析结果显示组织缺损修复术是影响局部晚期口腔癌预后的独立因素。
新辅助化疗通过全身性、系统性的细胞毒性作用,可以降低肿瘤负荷,提高手术的可切除率以及切缘阴性率,同时又可以及时治疗亚临床转移病灶降低转移率。Patil等[2]报道不可切除的晚期口腔癌行TPF方案或TP方案诱导化疗后,TPF方案的可切除率为68%,TP方案的可切除率为37.89%。与此报道一致,本研究中共有41例T4期患者行新辅助化疗,其中21例发生降期,可切除率为51.2%。但本研究的纳入标准较为宽泛,并且样本例数较少并未对两种化疗方案的手术可切除率进行进一步的分析。2007年,TAX323以及TAX324临床试验[8-9]结果显示TPF方案较PF方案可以延长口腔癌患者的无病生存期及总生存率。国内徐义全等[10]报道TPF方案在中晚期(II~IV期)头颈鳞癌中的有效率为85.2%,PF方案的有效率为60%。本研究结果显示在局部晚期(III~IV期)口腔癌中TPF方案的有效率高于DF方案(75%vs 52.1%),具有统计学差异。此外,吴文澜等[11]报道TPF方案对于中晚期或复发性头颈鳞癌也是有效的,为保全器官功能、手术切除肿瘤创造了机会。本研究结果也显示新辅助化疗尤其是TPF方案可使局部晚期口腔癌的瘤灶缩小,降低T分期,提高了手术的可切除率,进而使患者的生存获益。
导致口腔癌治疗失败的明确原因包括局部控制失败以及远处转移。Wang等[12]报道275例口腔癌的局部复发率为32.7%,局部复发导致5年生存率显著下降,局部复发者为31.8%,而未复发者为79.9%。并且,Li等[13]报道发生远处转移的头颈鳞癌的生存率逐年下降,1年为56.8%,3年为9.1%,5年仅为6.8%。此外,Lim等[14]报道单纯行手术治疗的795例I~IV期头颈鳞癌患者的远处转移率为9.4%,并且淋巴结转移、组织学分级差是导致其远处转移的重要因素。本研究中108例III/IV期采用综合治疗的口腔癌的局部复发率为31.5%,远处转移率为8.3%。多因素分析结果显示手术切缘、组织缺损修复、淋巴结转移是影响局部晚期口腔癌预后的独立因素。因此对于局部晚期口腔癌患者要距瘤缘至少2 cm切除原发灶以获得足够的安全切缘,同时T3~4期病灶造成的较大组织缺损,行组织皮瓣修复及功能重建术十分重要。并且,要规范化局部晚期口腔癌患者的颈部淋巴结清扫术,对于cN0的患者要行I~III区的选择性颈部淋巴结清扫术,cN+的患者要行根治性颈部淋巴结清扫术。Capote等[15]分析选择性颈清对早期口腔癌(pT1-2N0M0)患者5年局部控制率以及复发率的影响,结果表明行颈清术患者的复发率显著降低,而5年局部控制率为92.5%,显著高于单纯行病灶切除术组(71.2%)。
本研究结果表明新辅助化疗可使局部晚期口腔癌的原发灶缩小,使部分不可手术者转为可手术者从而获得根治性切除的机会,进而延长了患者的生存期。因此对于局部晚期口腔癌我们推荐新辅助化疗+病灶广泛切除术+颈部淋巴结清扫术+组织皮瓣修复术的综合治疗方式,并根据手术切缘、组织学分级以及颈部淋巴结转移情况行术后辅助放化疗。
[1]李志勇,张艳清,郑艳群,等.局部或区域晚期头颈鳞癌放化疗联合治疗现状和展望[J].中华临床医师杂志(电子版),2013,7(22): 10227
[2]Patil V M,Noronha V,Joshi A,et al.Induction chemotherapy in technically unresectable locally advanced oral cavity cancers:does it make a difference[J].Indian J Cancer,2013,50(1):1
[3]郑家伟,李金忠,涂文勇,等.口腔颌面部恶性肿瘤治疗指南[J].中国口腔颌面外科杂志,2010(2):98
[4]Liao C T,Chang J T,Wang H M,et al.Surgical outcome of T4a and resected T4b oral cavity cancer[J].Cancer,2006,107(2):337
[5]Crombie A K,Farah C,Tripcony L,et al.Primary chemoradiotherapy for oral cavity squamous cell carcinoma[J].Oral Oncol,2012,48 (10):1014
[6]Patil V M,Prabhash K,Noronha V,et al.Neoadjuvant chemotherapy followedbysurgeryinverylocallyadvancedtechnically unresectable oral cavity cancers[J].Oral Oncol,2014,50(10):1000
[7]de Vicente J C,Rodriguez-Santamarta T,Rosado P,et al.Survival after free flap reconstruction in patients with advanced oral squamous cell carcinoma[J].J Oral Maxillofac Surg,2012,70(2):453
[8]Vermorken J B,Remenar E,van Herpen C,et al.Cisplatin,fluorouracil,and docetaxel in unresectable head and neck cancer[J]. N Engl J Med,2007,357(17):1695
[9]Posner M R,Hershock D M,Blajman C R,et al.Cisplatin and fluorouracil alone or with docetaxel in head and neck cancer[J].N Engl J Med,2007,357(17):1705
[10]徐义全,李超,樊晋川,等.两种新辅助化疗方案在头颈鳞癌综合治疗的临床研究[J].中华临床医师杂志(电子版),2012,6(2): 445
[11]吴文澜,张园.多西他赛、顺铂和5-Fu新辅助化疗在中晚期或复发性头颈部鳞癌综合治疗中的应用[Z].国际暨全国头颈肿瘤学术大会论文集,杭州:2011
[12]Wang B,Zhang S,Yue K,et al.The recurrence and survival of oral squamous cell carcinoma:a report of 275 cases[J].Chin J Cancer,2013,32(11):614
[13]Li X,Di B,Shang Y,et al.Clinicopathologic risk factors for distant metastases from head and neck squamous cell carcinomas[J].Eur J Surg Oncol,2009,35(12):1348
[14]Lim J Y,Lim Y C,Kim S H,et al.Predictive factors of isolated distant metastasis after primary definitive surgery without systemic treatment for head and neck squamous cell carcinoma[J].Oral Oncol,2010,46(7):504
[15]Capote A,Escorial V,Munoz-Guerra M F,et al.Elective neck dissection in early-stage oral squamous cell carcinoma--does it influence recurrence and survival[J].Head Neck,2007,29(1):3
(2015-03-01收稿)
Clinical curative effect on neoadjuvant chemotherapy in locally advanced oral cavity cancers
LIU Xiao-nan,ZHUO Shan-shan,YUE Jiu-ling,ZHANG Wen-chao,ZHANG Lun
(Department of Maxillofacial,Ear,nose and Throat Oncology,Cancer Institute and Hospital,Tianjin Medical University,National Clinical Research Center for Cancer,Key Laboratory of Cancer Prevention and Therapy,Tianjin 300060,China)
Objective:To explore the effects of neoadjuvant chemotherapy(NACT)followed by surgery on locally advanced oral cavity cancers and to analyse the prognosis factors.Methods:Clinical pathologic features of patients with locally advanced oral cavity cancers,who were treated with NACT were observed and the prognosis factors were analysed.Results:The response rate of NACT was 64.8%,and the complete response rate(CR)was 5.6%,and the partial response rate(PR)was 59.2%.The conditions of 83 cases at T stage were decreased,25 of which were decreased for 2 stages while 58 decreased for one stage.The median of estimated OS in patients undergoing surgery was 30 months and 21 months in patients treated without surgery.Regional lymph node metastasis,flap application,resection margin,surgery were identified as independent factors that influence prognosis.Conclusion:NACT could lead to successful resection and improve overall survival in locally advanced oral cavity cancers followed by surgery.Regional lymph node metastasis,flap application,resection margin,surgery are independent risk factors of prognosis.
locally advanced oral cavity cancers;neoadjuvant chemotherapy;surgery;resection rate;prognosis
R739.8
A
1006-8147(2015)05-0408-04
刘晓楠(1988-),女,硕士在读,研究方向:头颈部肿瘤;通信作者:张文超,E-mail:zwbeyond_999@sina.com。
