NaCl盐度对氨氧化细菌活性的影响及动力学特性
2015-11-18张宇坤王淑莹董怡君顾升波彭永臻
张宇坤,王淑莹,董怡君,顾升波,彭永臻
(北京工业大学北京市水质科学与水环境恢复工程重点实验室,北京100124)
NaCl盐度对氨氧化细菌活性的影响及动力学特性
张宇坤,王淑莹*,董怡君,顾升波,彭永臻
(北京工业大学北京市水质科学与水环境恢复工程重点实验室,北京100124)
含盐废水的硝化过程常常出现亚硝酸盐积累,NaCl盐度对氨氧化菌(AOB)活性的影响与动力学特性并不清楚.采用高浓度氨氮污水富集培养AOB,并成功实现短程硝化.对富含AOB的污泥进行荧光原位杂交技术(FISH)分析表明AOB占细菌总数比例为(55±7)%.污泥的最大比氨氧化速率为(0.92±0.13)gN/(gVSS·d).用此污泥考察了NaCl盐度对AOB活性的影响,并测定了10g/L时AOB的动力学参数(KNH3、Ko).试验结果表明,与盐度为0g/L时的AOB活性相比,盐度为15g/L时的AOB活性降低了37%;盐度为30g/L时降低了85%.盐度为10g/L时,AOB的最大比氨氧化速率为(0.62 ± 0.03)gN/(gVSS·d),底物半饱和常数KNH3值为(7.62 ± 0.13)mg/L,氧的半饱和常数Ko值为(0.39 ± 0.04)mg/L,其中KNH3测定值高于ASM2模型推荐值.NaCl盐度对AOB的抑制降低了最大比氨氧化速率,对底物(NH4+-N)传递存在影响.
活性;废水;动力学;氨氧化细菌;盐度
随着淡水资源的紧缺,部分沿海地区采用海水替代城市生活用水(海水冲厕,消防等)[1-2],此外,一些人类生产活动(海产品加工废水,蔬菜腌制等)也会带来大量的无机盐[3-4].含无机盐的废水与市政污水混合后进入城市污水处理厂,会对活性污泥产生毒害作用[5],严重影响污水处理厂的正常运行.海水利用产生的污水经市政管网最终流入污水处理厂,水量约占污水处理总量的30%,含盐生活污水的盐度一般不超过10g/L[6-7].
硝化过程作为污水生物处理的重要组成部分,含盐废水的硝化过程活性(最大比氨氧化速率与盐度为0g/L时最大比氨氧化速率的比值)低于普通活性污泥法[8-10].微生物实验表明[7],氨氧化细菌(AOB)的存活率(采用most probably number (MPN)计数法[11])随盐度增高而减小.随着盐度的升高,细胞的渗透压增大,不利于细胞内底物、氧的传递[12],这可能是含盐废水硝化过程效率低下的原因之一.底物-N)半饱和常数(KNH3)和氧的半饱和常数(Ko)是表征AOB的氨氮、氧的传递能力的动力学参数.ASM2模型中给出了无盐度时AOB的KNH3(1mg/L), Ko(0.5mg/ L)的参考值[13].目前,针对NaCl盐度是否会对氨氧化过程中氨氮、氧的传递能力(KNH3,Ko)产生影响还鲜见报道.现有的研究在测定硝化菌群的KNH3,Ko值时常采用异养菌为主的活性污泥[14-16],Manser[14]等测定了普通活性污泥中AOB的KNH3= (0.14 ± 0.1)mg/L, Ko= (0.79 ± 0.08)mg/L;顾升波[16]测定了短程硝化污泥中AOB的Ko= 0.26mg/L,污泥中较低的硝化菌群比例(AOB占全菌比例约3.5~5%)[15-16],降低了硝化菌群动力学参数测定结果的可靠性;对AOB进行富集培养[17-18]有利于提高AOB占全菌比例,本研究以富含AOB的活性污泥(AOB占全菌比例大于50%)为研究对象,减少了异养菌等对动力学测定的影响,可获得更加准确的AOB动力学参数.目前研究多集中于盐度对混合菌群的COD氧化能力、硝化效果的影响,关于盐度对AOB的活性影响及动力学还未见报道.本试验拟采用序批式反应器(SBR)装置富集培养AOB,以富含AOB的活性污泥为研究对象,检测NaCl盐度对AOB活性的影响,并测定盐度为10g/L时AOB的最大比氨氧化速率KNH3值,Ko值,分析NaCl盐度对AOB活性及动力学参数的影响,为污水处理厂高效处理含盐废水提供技术支持.
1 材料与方法
1.1 氨氧化细菌富集装置及运行方式
采用有效容积为10L的SBR装置富集AOB.其中有效容积均为8L,每周期进水2L,排水比为25%;通过温控装置控制温度在22~25℃;溶解氧(DO)控制在2mg/L以上.在每周期开始时和120min时开启蠕动泵,投加1mol/L的NaOH将 SBR装置pH值调节到7.5~8.0;每周期运行360min:进水(12min),曝气(300min),沉淀30min,排水12min,闲置6min;污泥龄约为15d.经过422d富集培养,最大比氨氧化速率可达0.92gN(gVSS·d).
1.2 试验用水水质
对于AOB的富集,人工配置污水采用Vadivelu等[18]的配方,采用NH4HCO3(2000mgN/ L)作为无机碳源和氮源;配制污水均添加痕量元素[18](2mL/L).配水组成见表1,所有的配水试验用水都经过灭菌后再连入反应器;如前所述,耐盐污泥系统常采用盐度10g/L作为污泥驯化的上限[6-7],因此在测定含盐废水AOB的动力学参数时,盐度(NaCl)均设定为10g/L.
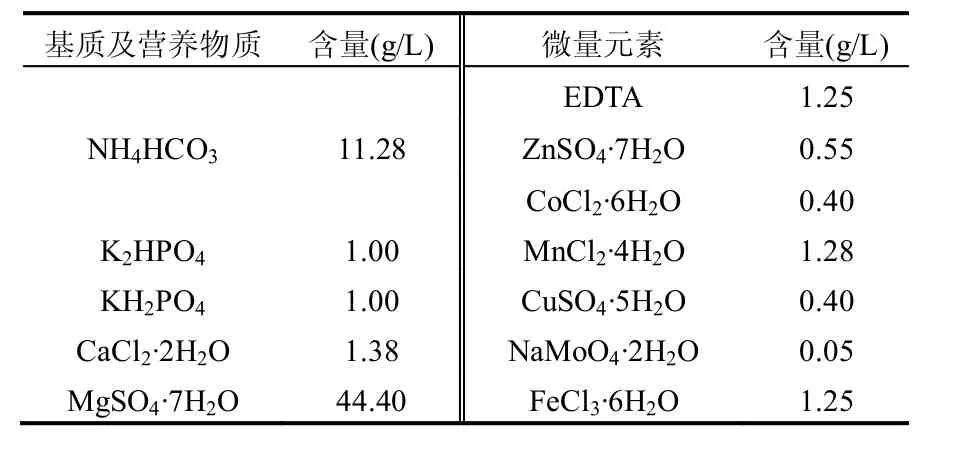
表1 人工配制污水水质情况Table 1 Characteristic of artificial wastewater
1.3 批次试验
1.3.1 NaCl盐度对AOB氨氧化活性的影响 NaCl盐度对AOB氨氧化活性影响的批次试验共6个批次,盐度(NaCl)分别设定为:0,5,10,15,20,30g/L,每个批次包含3组平行试验.试验开始前向500mL批次试验瓶内投加碳酸氢铵溶液,氨氮初始浓度为50mg/L.试验过程中通过投加HCl和NaOH控制pH值为7.2±0.1;控制DO>4mg/L.批次试验时间为30min,水样经Millipore 0.45μm滤膜过滤后检测水样中-N浓度,混合液悬浮固体浓度(MLSS)约为922mg/L,混合液挥发性悬浮固体浓度(MLVSS)约为768mg/L.

式中:q为比氨氮氧化速率,mg/(gVSS·h);qmax为最大比氨氮氧化速率,mg/(gVSS·h);SNH3为氨氮浓度,mg/L;KNH3为底物-N)半饱和常数, mg/L.
1.3.3 氧的半饱和常数的测定 批次试验共进行12个批次,每个批次设定不同的DO浓度(0.3~9mg/L);批次试验中均提供过量的(远大于KNH3值)底物-N):初始-N浓度为30mg/L,每隔5~10min其他条件与底物-N)半饱和常数试验条件相同.Ko值采用式(2)拟合DO浓度--氨氧化菌活性进行检测[19],
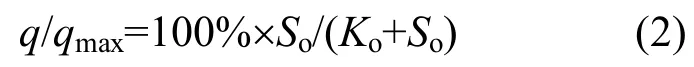
式中:So为溶解氧(DO)浓度, mg/L;Ko为氧的半饱和常数, mg/L.
1.4 检测指标及分析方法
氨氮、亚硝态氮、硝态氮、MLSS、MLVSS均采用标准方法测定[20].荧光原位杂交技术(FISH)采用Amann[21]的操作方法进行,采用4% PFA, 4℃条件下对污泥样品固定120~180min.对固定后的污泥样品超声分散1min,将样品滴加在明胶包被过的载玻片上,干燥后先后浸泡于50%、80%和98%的乙醇溶液中脱水3min. 杂交缓冲液组成包括0.9mol/L NaCl、20mmol/L Tris/HCl,0.01% SDS和甲酰胺(甲酰胺FA浓度见表2,pH值为7.2).将荧光标记的寡核苷酸探针溶解于杂交缓冲液中,在46℃下与污泥样品杂交120min.采用的寡核苷酸探针列于表2.杂交结束后,采用洗脱缓冲液在48℃下洗脱20min.在干燥后的样品上滴加抗荧光衰减液,对每个污泥样品随机拍摄20~25张照片(OLYMPUS BX61荧光显微镜),并采用Image-pro plus 6.0Software®进行计数分析;污泥粒径分布、污泥比表面积检测采用Beun[22]的操作方法.

表2 所用寡核苷酸探针碱基序列Table 2 Oligonucleotide probes used in this study
2 结果与讨论
2.1 AOB富集装置典型周期污染物变化情况及污泥分析
由图1可见,在0~180min氨氮逐渐下降,约170mg/L氨氮被氧化.最大比氨氧化速率为(0.92± 0.13)gN/(gVSS·d),这显示AOB富集装置具有很高的氨氧化活性;同时,亚硝态氮也逐渐增加,0~180min共增加了163mg/L,没有检测到硝态氮.这说明系统中NOB含量较少或活性不高,成功实现了短程硝化,有利于提高AOB占细菌总数的比例.值得注意的是,在180~300min时系统氨氮浓度仍然较高(530mg/L),且氨氮停止下降,这可能是因为此时的pH值很低(约5.9),生成的亚硝态氮以游离亚硝酸(FNA最大值约为0.5mg HNO2-N/L)形式存在,抑制了氨氧化过程[17].由图1b可见,系统温度稳定在(26±1)℃,pH值在氨氧化过程一直在下降,这是由于氨氧化过程释放H+.在曝气120min时用1mol/L的NaOH将反应器pH值调节到7.5~8.0.当pH值在5.9左右时(第180min)pH值不再下降,这可能是由于氨氧化过程受到FNA抑制[17],停止释放H+;DO在140min左右出现突跃点,此时氨氧化速率变小(图1a),需氧量下降.对富含AOB的活性污泥进行FISH检测(图2),结果显示AOB占细菌总数比例为(55±7)%,Nitrobacer占细菌总数比例(4±1)%,未检测到Nitrospira.对AOB富集装置内污泥(第422d)的粒度分布情况进行分析(图3),可以看出污泥的粒径主要分布在50~400μm之间,其污泥平均粒径为163μm,与顾升波[16]培养的AOB污泥粒径相差不大,但大于Blackburne等[19]富集的NOB污泥粒径.同时测得该污泥比表面积为0.0577m2/g.
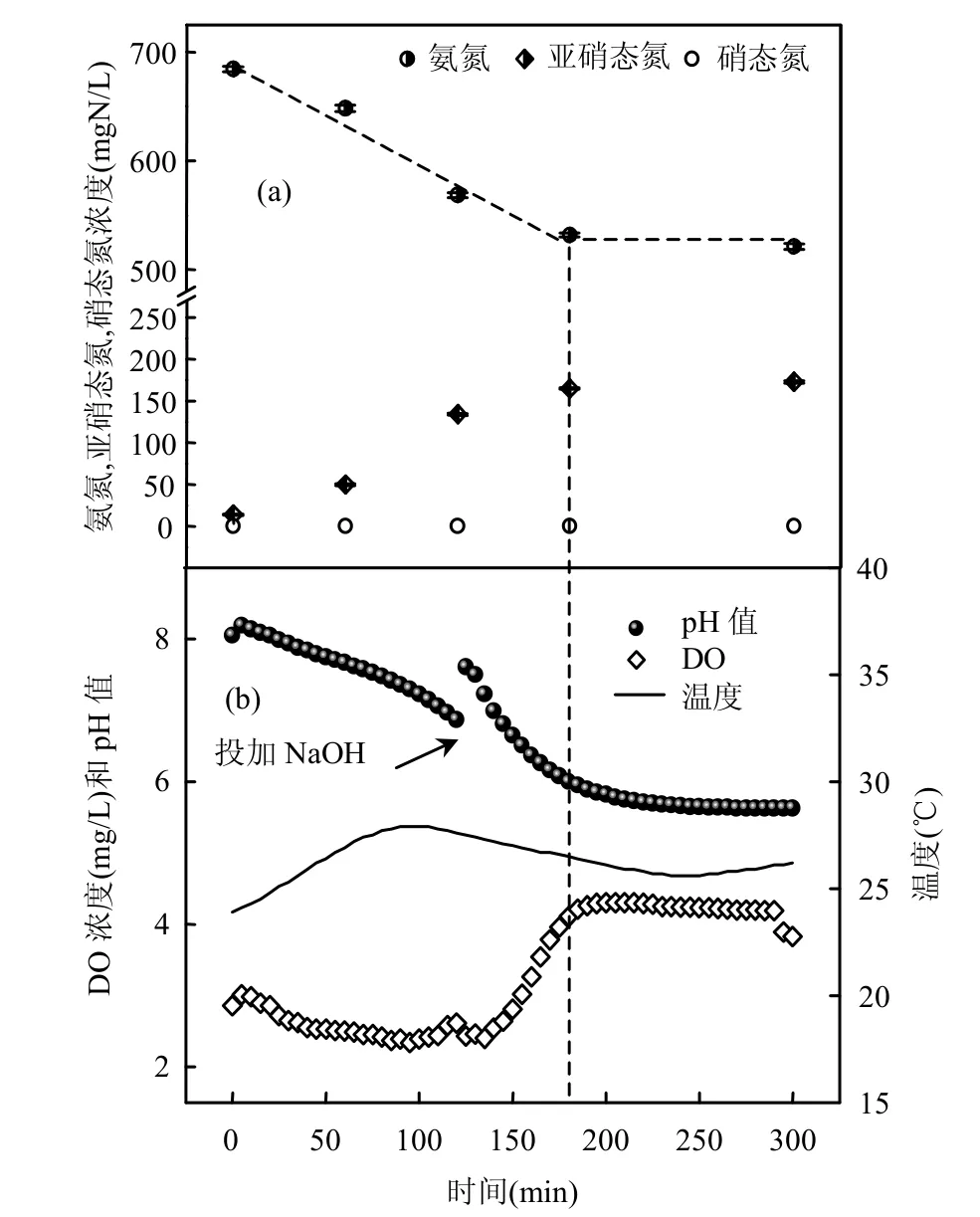
图1 SBR典型周期(第422d)中氨氮,亚硝态氮,硝态氮浓度及参数变化情况Fig.1 Profile of ammonia, nitrite, nitrate and parameters in typical SBR cycle (the 422d)
2.2 NaCl盐度对AOB氨氧化活性的影响
图4显示了NaCl盐度对AOB的氨氧化活性(最大比氨氧化速率与盐度为0g/L时最大比氨氧化速率的比值)的影响.AOB的氨氧化速率随盐度(0~30g/L)的增大而逐渐减小(图4a),盐度为0g/L时AOB的最大比氨氧化速率最大,为0.92gN/ (gVSS·d);盐度为10g/L时AOB的活性相对0g/L时降低27%;当盐度增加为30g/L时,AOB的活性降低了85%.对盐度与AOB活性关系进行线性拟合,结果显示两者线性关系良好(图4b),q/qmax= -2.64X + 100, R2= 0.98.这显示NaCl盐度对AOB的活性存在重要影响,盐度的升高会严重抑制AOB的氨氧化活性,这与以往的研究结果一致[2,6].Omar等[12]认为高盐污水提高了胞内渗透压,限制了细胞的物质传输,这可能是含盐废水氨氧化活性下降的原因之一.
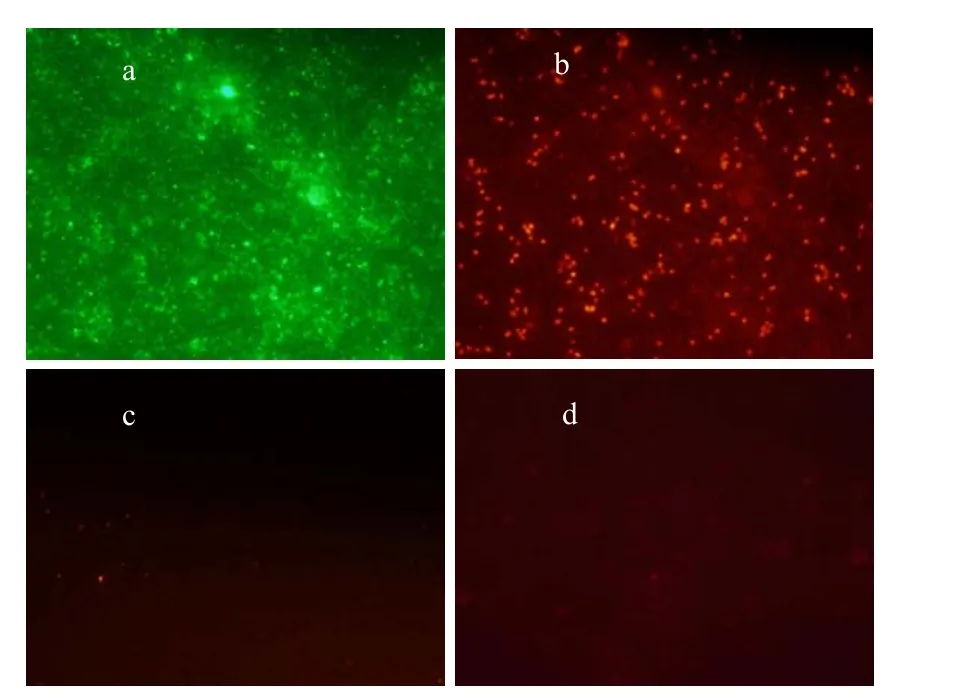
图2 富含AOB系统FISH分析(第422d)Fig.2 The FISH analysis of activated sludge in AOB enrichment system (422d)
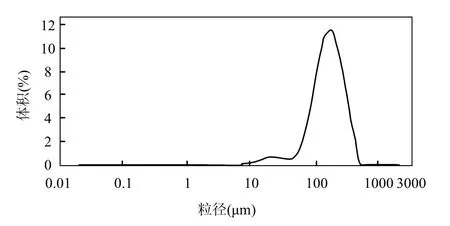
图3 富含AOB系统污泥的粒度分布Fig.3 Volumetric floc size distributions of activated sludge in AOB enrichment system
由图5可见,随着氨氮浓度的增加,AOB的活性(比氨氧化速率与最大比氨氧化速率的比值)也逐渐增加. 采用式(1)对底物与AOB活性进行拟合[19], q/qmax= 100%×SNH3/(7.62+SNH3),最大比氨氧化速率为(0.62 ± 0.03)gN/(gVSS·d), KNH3=(7.62 ± 0.13)mg/L; R2= 0.95. ASM2模型[13]中AOB的KNH3推荐值为1mg/L,本试验测得的KNH3值高于ASM2模型推荐值.较高的KNH3值意味着随着氨氮浓度的降低,最大比氨氧化速率会大幅下降,硝化效率降低,氨氮氧化过程难以进行到底.为了实现含盐废水氨氮的达标排放,需要更长的曝气时间.含盐废水提高了氨氧化菌的细胞渗透压[12]进而对底物的传递产生抑制,底物半饱和常数KNH3值也随之升高;另一方面,较大的污泥粒径也会提高硝化菌群的KNH3值[19].对污泥进行耐盐驯化可能有助于提高含盐废水的硝化效率[7].

图4 NaCl盐度对AOB氨氧化活性的影响Fig.4 Effect of NaCl salinity on activity of AOB
2.4 氧的半饱和常数的测定
由图6可见,盐度为10g/L时,随着DO浓度的增加,AOB的活性也逐渐增强.当DO浓度增加到1.3mg/L附近, AOB活性达到最大值,此后的AOB活性几乎都在最大值上下波动.AOB活性与DO浓度关系拟合相关性良好(R2=0.96).最大比氨氧化速率为0.62gN/(gVSS·d); Ko=(0.39± 0.04)mg/L.ASM2模型[13]中AOB的Ko推荐值为0.5mg/L,与本试验Ko测定值接近.与盐度为0g/L相比,NaCl盐度(10g/L)对AOB的氧的半饱和常数影响不大.

图5 AOB活性随着氨氮浓度的变化规律(盐度为10g/L)Fig.5 The variation of activity of enrichment AOB with ammonia

图6 AOB活性随DO浓度的变化规律(盐度为10g/L)Fig.6 The variation of activity of enrichment AOB with DO
3 结论
3.1 AOB富集装置的污泥经过422d的富集培养,AOB成为优势菌种,FISH分析结果显示AOB占细菌总数比例为(55±7)%.污泥平均粒径为163μm.
3.2 盐度为0g/L时AOB的最大比氨氧化速率为0.92gN/(gVSS·d).盐度为5g/L时,AOB的活性相对0g/L时降低了17%;盐度增加到20g/L时,AOB的活性降低了62%.
3.3 盐度为10g/L时AOB的最大比氨氧化速率为(0.62±0.03)gN/(gVSS·d),底物(NH4+-N)半饱和常数KNH3值为(7.62±0.13)mg/L,氧的半饱和常数Ko值为(0.39±0.04)mg/L.
[1]邢秀强.海水冲厕技术存在的问题及解决措施 [J]. 中国给水排水, 2007,10:5-8.
[2]崔有为,王淑莹,宋学起,等. NaCl盐度对活性污泥处理系统的影响 [J]. 环境工程, 2004,1:19-21.
[3]周 健,曾朝银,龙腾锐,等.高盐高氮榨菜废水生物脱氮试验研究 [J]. 环境科学学报, 2005,25(12):1636-1640.
[4]Chowdhury P, Viraraghavan T, Srinivasan A. Biological treatment processes for fish processing wastewater - A review [J]. Bioresource Technology, 2010,101(2):439-449.
[5]崔有为,王淑莹,甘湘庆,等.生物处理含盐污水的盐抑制动力学[J]. 环境污染治理技术与设备, 2005,5:38-41.
[6]王淑莹,唐 冰,叶 柳,等.NaCl盐度对活性污泥系统脱氮性能的影响 [J]. 北京工业大学学报, 2008,34(6):631-635.
[7]叶 柳.含盐生活污水脱氮除磷特性及优化控制 [D]. 北京:北京工业大学, 2010.
[8]Chen G H, Wong M T, Okabe S, et al. Dynamic response of nitrifying activated sludge batch culture to increased chloride concentration [J]. Water Research, 2003,37(13):3125-3135.
[9]Ye L, Peng C Y, Tang B, et al. Determination effect of influent salinity and inhibition time on partial nitrification in a sequencing batch reactor treating saline sewage [J]. Desalination, 2009,246(1-3):556-566.
[10]Moussa M S, Sumanasekera D U, Ibrahim S H, et al. Long term effects of salt on activity, population structure and floc characteristics in enriched bacterial cultures of nitrifiers [J]. Water Research, 2006,40(7):1377-1388.
[11]Ma F, Ren N Q, Yang J X. Microbiology experiments of pollution control [M]. Harbin: Haerbin Technical University Press, 2002.
[12]Omar S, María C, Estrella A, et al. Nitrification rates in a saline medium at different dissolved oxygen concentrations [J]. Biotechnology Letters, 2001,23:1597-1602.
[13]Henze M, Gujer W, Mino T, et al. Activated sludge models ASM1, ASM2, ASM2d and ASM3scientific and technical report No.9 [R]. London: IWA Publishing, 2000.
[14]Manser R, Gujer W, Siegrist H. Consequences of mass transfer effects on the kinetics of nitrifiers [J]. Water Research, 2005,39(19):4633-4642.
[15]Guo J H, Peng Y Z, Huang H J, et al. Short- and long-term effects of temperature on partial nitrification in a sequencing batch reactor treating domestic wastewater [J]. Journal of Hazardous Materials, 2010,179:471-479.
[16]顾升波.微生物种群和过程调控优化SBR法短程硝化中试与动力学 [D]. 北京:北京工业大学, 2012.
[17]Vadivelu V M, Keller J, Yuan Z G. Free ammonia and free nitrous acid inhibition on the anabolic and catabolic processes of Nitrosomonas and Nitrobacter [J]. Water Science and Technology,2007,56(7):89-97.
[18]Vadivelu V M, Keller J, Yuan Z G. Stoichiometric and kinetic characterisation of Nitrosomonas sp in mixed culture by decoupling the growth and energy generation processes [J]. Journal of Biotechnology, 2006,126(3):342-356.
[19]Blackburne R, Vadivelu V M, Yuan Z G, et al. Kinetic characterisation of an enriched Nitrospira culture with comparison to Nitrobacter [J]. Water Research, 2007,41(14):3033-3304.
[20]APHA. Standard methods for the examination of water and wastewater [R]. Washington, DC: American Public Health Association, 1995.
[21]Amann R I, Krumholz L, Stahl D A. Fluorescent- oligonucleotide probing of whole cells for determinative phylogeneric, and environmental-studies in microbiology [J]. Journal of Bacteriology, 1990,172(2):762-770.
[22]Beun J J, van Loosdrecht M C M, Heijnen J J, et al. Aerobic granulation [J]. Water Science and Technology, 2000,41(4/5):41-48.
致谢:感谢刘丽在论文修订、试验方面给予的帮助和支持.
Effect of NaCl salinity on activity of ammonia-oxidizing bacteria and kinetic characterization.
ZHANG Yu-kun,WANG Shu-ying*, DONG Yi-jun, GU Sheng-bo, PENG Yong-zhen
(Key Laboratory of Beijing for Water Quality Science and Water Environmental Recovery Engineering, Beijing University of Technology, Beijing 100124, China)
China Environmental Science, 2015,35(2):465~470
Nitrite accumulation was always observed in the saline wastewater nitrification process, but the effect of NaCl salinity on ammonia-oxidizing bacteria (AOB) activity and kinetic characterization has not been clear. In this study, AOB was enriched in a lab-scale SBR system with high concentration of ammonium wastewater, and the partial nitrification was successfully achieved. The fluorescence in situ hybridization (FISH) analysis showed that AOB accounted for (55 ± 7)% of total bacteria. The maximum specific ammonia oxidation rate was (0.92 ± 0.13)gN/(gVSS·d). The effect of NaCl salinity on AOB activity was investigated using this mixed culture. The kinetic parameters of AOB (KNH3、Ko) were also measured under NaCl salinity of 10g/L. Results showed that compared with NaCl salinity 0g/L, the activity of AOB decreased 37% under NaCl salinity of 15g/L and decreased 85% under NaCl salinity of 30g/L. When salinity was 10g/L,the maximum ammonia oxidation rate was (0.62 ± 0.03)gN(gVSS·d), the half-saturation constant for ammonia (KNH3) was(7.62±0.13)mg/L, the half-saturation constant for oxygen (Ko) was (0.39±0.04)mg/L. The KNH3value was higher than recommended value of ASM2model. NaCl salinity could reduce maximum specific ammonia oxidation rate, and also affects the substrate (ammonia) affinity of AOB.
activity;wastewater;kinetics;ammonia-oxidising bacteria;salinity
X703.1
A
1000-6923(2015)02-0465-06
张宇坤(1987-),男,黑龙江哈尔滨人,北京工业大学博士
2014-02-07
高等学校博士学科点专项科研基金(20111103130002);北京市科委科技创新平台项目
* 责任作者, 教授, wsy@bjut.edu.cn
研究生,主要从事污水生物处理方面的研究.
