盘式固相萃取-液相色谱-串联质谱法快速测定地表水中n-壬基酚、n-辛基酚和双酚A
2015-11-17张付海胡雅琴田丙正
赵 彬,张 敏,张付海,胡雅琴,田丙正,王 鑫
内分泌干扰物种类繁多,分布广泛,会通过食物链在动物和人体内富集。极低浓度的内分泌干扰物就可能对动物和人的生殖系统、神经系统和免疫系统造成严重的损害[1-3]。n-壬基酚(NP)、n-辛基酚(OP)和双酚A(BPA)作为典型酚类内分泌干扰物被广泛用作工业和家用洗涤剂、农药和印染乳化剂等,大量用于合成非离子型表面活性剂和聚碳酸醋塑料和环氧树脂[4]。欧盟、奥斯陆-巴黎公约OSPAR 也已将其列入优先环境控制污染物质名录[5]。为了更好地评价该类物质对生态环境的影响,建立这类物质的快速、灵敏和高效的分析方法就显得尤为重要。
目前测定该类化合物的方法主要有高效液相色谱法[5]、气相色谱法[6]、气相色谱-质谱联用法[7]、酶联免疫吸附法[8]和液相色谱-质谱联用法[9-11]等。气相色谱法测定该类物质需要衍生化处理样品,步骤繁琐。液相色谱法则由于环境水样基质复杂、背景干扰多等特点,不易定性,易出现假阳性。而免疫法往往只针对单一化合物进行分析,难以满足多组分同时检测的要求。而液相色谱-质谱串联法检测则能更好地应对基质复杂、背景干扰的样品监测要求。针对环境样品的前处理方法主要有液-液萃取[9-10]、固相小柱萃取[5,7,10]、加速溶剂萃取法[11]等,而盘式固相萃取的方法报道较少。盘式固相萃取法则能够快速萃取大体积水样,同时消耗有机试剂少,操作仪器化程度高,简单易操作。综上所述,本文采用盘式固相萃取-超高效液相色谱-串联质谱快速测定地表水中3 种内分泌干扰物(n-壬基酚、双酚A、n-辛基酚),并对巢湖入湖河流河口水样进行了研究调查。该方法快速、灵敏、准确,可有效应用于环境水样的实际监测检测。
1 实验部分
1.1 仪器和试剂
超高效液相色谱-串联质谱Waters TQ-S(美国);Masslynx4.1 工作站;膜盘萃取仪(Sepaths-6,美国);盘式固相萃取膜盘(C18,Φ47 mm 以下简称C18膜盘);定量平行浓缩仪(MultiVap-8,中国北京);超纯水制备仪(Millipore Milli-Q Integral15,美国);色谱柱(Waters BEH C18,50 mm ×2.1 mm,1.7 μm)。
n-壬基酚(NP,标准品纯度不低于99.9%);n-辛基酚(OP,标准品,纯度不低于99.9%);双酚A(BPA,标准品,纯度不低于99.9%);二氯甲烷、甲醇、乙腈(色谱纯);超纯水;无水硫酸镁(优级纯);0.22 μm 有机滤头。
1.2 样品的采集与保存
采集河流水样储存于5 L 棕色玻璃采样瓶中,用H3PO4调pH 至2,加入0.01 ~0.02 g 抗坏血酸除去残余氯。在4 ℃冷藏保存,24 h 内分析。
1.3 样品前处理
膜盘萃取:静置水样30 min 以上,使其自然沉降。然后取上层水样1 L 于萃取瓶中,加入2 mL甲醇,用C18膜盘萃取。萃取条件:用10 mL体积比1∶1 的甲醇/二氯甲烷润洗,10 mL 超纯水平衡5 min,水样流速约为100 mL/min,用10 mL甲醇/超纯水(体积比1∶10)净化,抽至近干后,用10 mL 甲醇/二氯甲烷(体积比1∶1)洗脱。加入0.5 g 无水硫酸镁除水。洗脱液用浓缩氮吹仪(40 ℃下),甲醇/水(体积比1∶1)分多次转换溶剂定容至1 mL。用0.22 μm 有机滤头过滤,待测。
1.4 色谱质谱条件
超高效液相色谱条件:色谱分离采用线性梯度洗脱。流动相A 为甲醇,流动相B 为超纯水-0.1%氨水。采用线性梯度洗脱条件(见表1)。进样量为10 μL,流速0.4 mL/min,样品温度10 ℃,色谱柱温40 ℃。
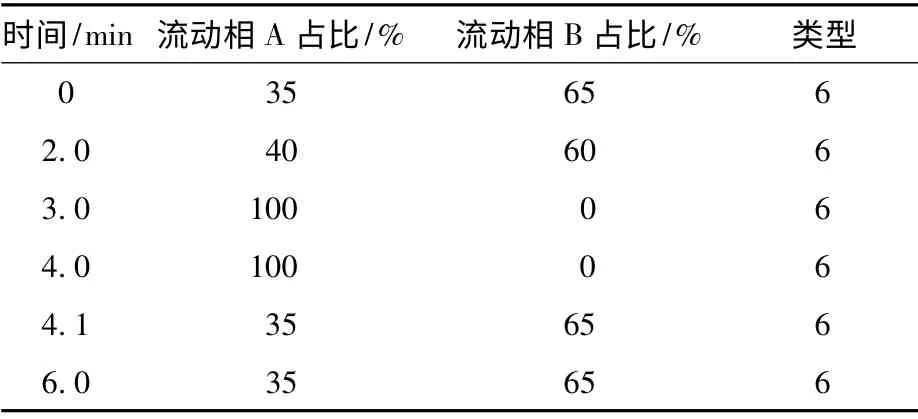
表1 液相色谱线性梯度洗脱条件
质谱条件:采用电喷雾离子源(ESI)负离子模式进行监测,监测模式为多级反应监测模式(MRM)。喷射电压2.8 kV,源温度为150 ℃,脱溶剂气温度为400 ℃,流量为900 L/h,锥孔气流速为150 L/h,锥孔电压和碰撞能经实验优化见表2。
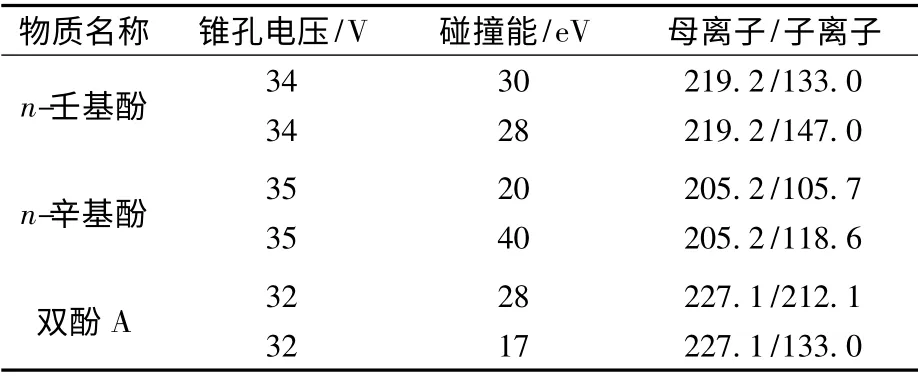
表2 MRM 分析条件
2 结果与讨论
2.1 样品前处理条件的优化
2.1.1 样品萃取方法的优化选择
目前关于环境水样的前处理方式,多采用液-液萃取[10-11]、固相小柱萃取[6,8,11]等方法。液-液萃取方法前处理操作过程繁琐,需要选择合适极性的溶剂,调节适合的pH。同时,环境样品基质复杂,背景干扰物众多,简单的液-液萃取方式难以有效除去杂质,影响了方法最终的检出限及准确性。固相小柱萃取方法是一种常用的样品前处理技术,是液-固萃取和液相色谱柱技术相结合的产物。它能很好地实现目标物与样品基体和干扰物的分离。但由于其小柱本身的特性,不能够实现大体积样品的快速上样、富集及净化。盘式固相萃取法的原理与固相小柱萃取类似。从图1可见,盘式固相萃取法的回收率及净化效果均与固相萃取小柱法一致。因此,选择了更适合环境水体样品大体积上样的盘式固相萃取技术。
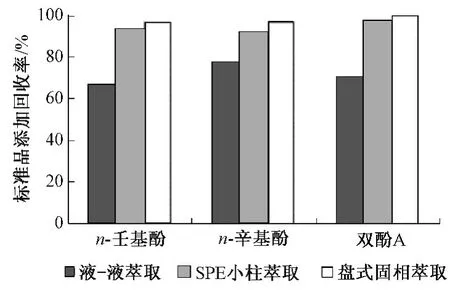
图1 不同萃取方法的比较
2.1.2 盘式固相萃取条件的优化
影响盘式固相萃取效果的主要因素有吸附剂类型及用量、样品溶液体积、洗脱剂类型等。对于复杂基质的样品,复合型吸附剂被广泛应用。本文比较了固相萃取小柱(C18、HLB、自制氧化铝小柱)与C18膜盘对目标化合物的净化和回收率效果。从图2可见,采用C18膜盘能取得较好的回收率,同时可实现快速分析。
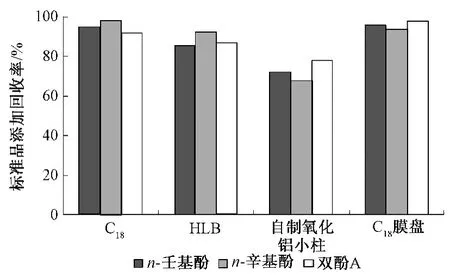
图2 不同净化方法的比较
2.1.3 萃取溶剂的优化选择
进一步考察了洗脱溶剂种类及其混合比例、用量对实验结果的影响。从图3可见,C18膜盘萃取的最佳实验条件:用10 mL 甲醇/二氯甲烷(体积比1∶1)润洗,10 mL 超纯水平衡5 min,水样流速约为100 mL/min,用10 mL 甲醇/超纯水(体积比1∶10)净化,抽至近干后,用10 mL 甲醇/二氯甲烷(体积比1∶1)洗脱。
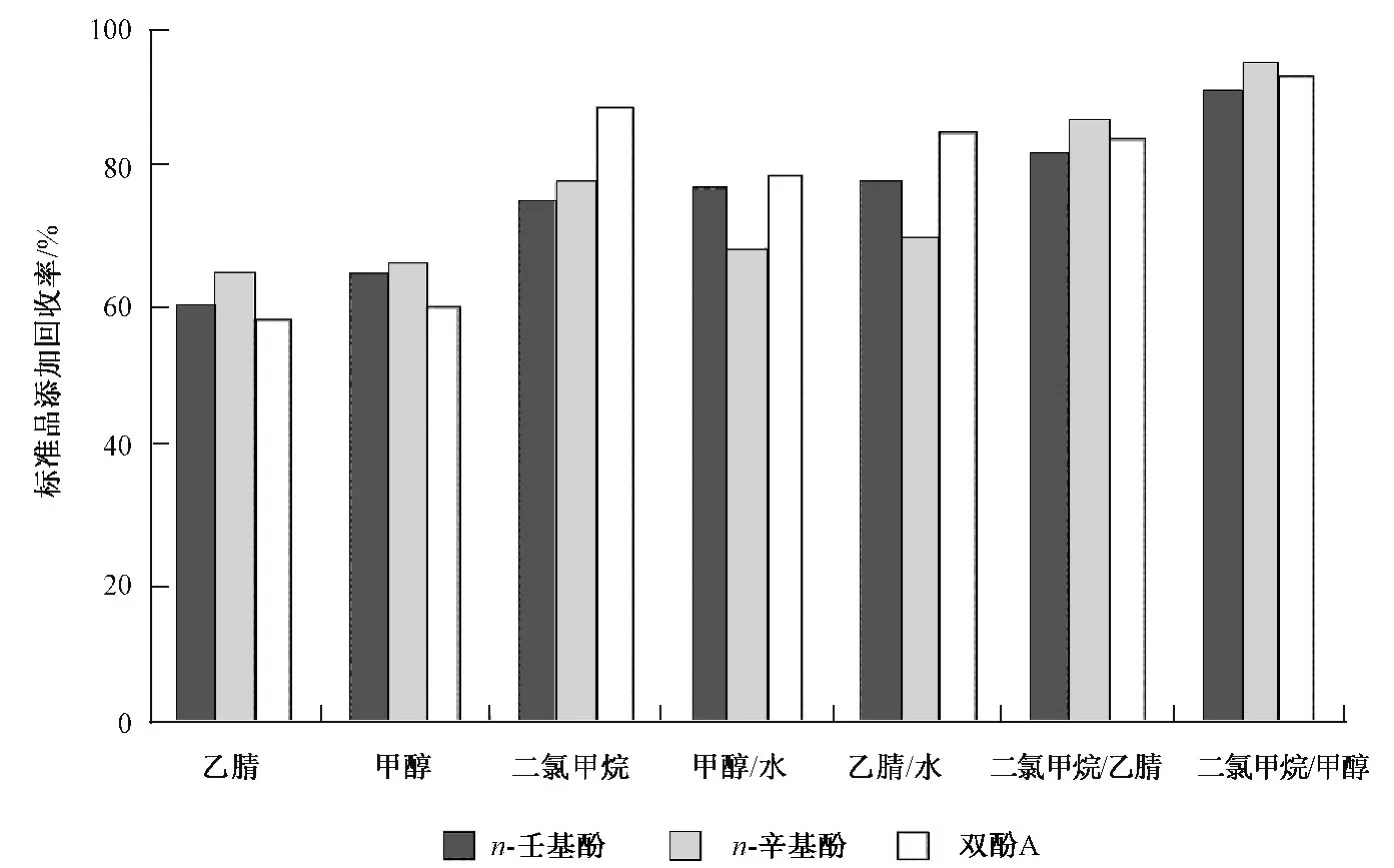
图3 不同溶剂的优化比较
2.2 色谱及质谱条件的优化
2.2.1 色谱条件的优化
分别比较了不同类型的反相色谱柱(Waters BEH C18,Waters HSS T3,Waters HSS C8)对待测物质的色谱分离效果。结果表明,n-辛基酚、n-壬基酚、双酚A 在Waters BEH C18色谱柱(50 mm×2.1 mm,1.7 μm)上获得了理想的分离效果。
甲醇和乙腈是液相色谱常用的流动相。在优化的色谱分离条件下,考察了甲醇-水和乙腈-水流动相体系对目标物离子化程度的影响。发现甲醇-水流动相的仪器响应值高于乙腈-水流动相。这可能是由于甲醇比乙腈更易电离,目标物离子化效率高,分析灵敏度高的原因。由于目标物都带有羟基,在负离子电离模式下溶液中能够电离出H+。所以,在流动相中适当加入碱性物质可以促进目标物的电离,从而获得较高的离子化效率。因此,选取0.1%氨水作为流动相进行实验,并获得了最佳实验结果。选择梯度洗脱方式,优化流动相梯度洗脱条件,在6 min 内实现了目标化合物的快速分离测定。
2.2.2 质谱条件的优化
根据酚类内分泌干扰物具有酚羟基的化学电离性质,选用负电离模式(ESI-),采用蠕动泵直接进样的方式进行质谱条件优化。通过仪器自带软件Masslynx4.1 的自动优化软件IntelliStart,对目标物的锥孔电压、碰撞能、定量离子和辅助定性离子进行了优化和确定。辛基酚、壬基酚和双酚A 的MRM 色谱图见图4。
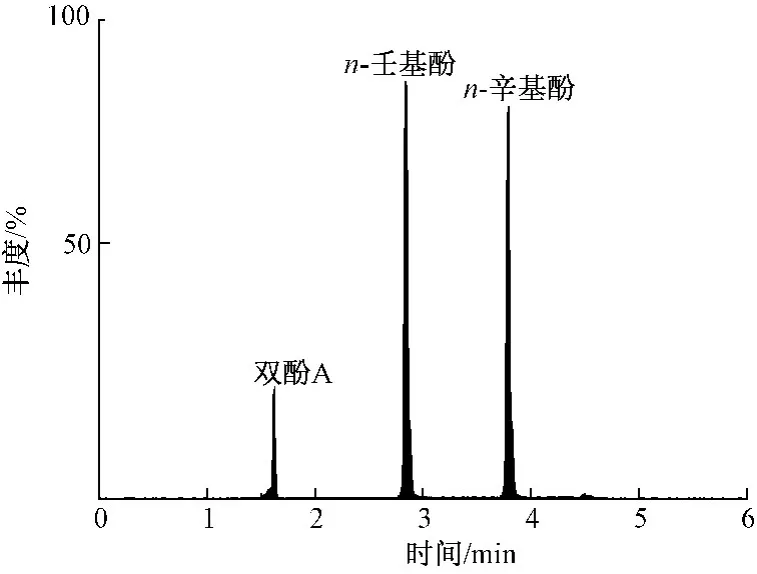
图4 n-辛基酚、n-壬基酚和双酚A 的MRM 色谱图
2.3 标准曲线、线性范围及检出限
将标准储备液用流动相梯度稀释成6 种不同浓度的标准溶液(1、5、10、50、100、400 μg/L)。然后上机测定,绘制标准曲线。以标准物的质量浓度为横坐标、对应峰面积为纵坐标进行线性回归分析,得线性回归方程及相关系数。并根据HJ 168—2010 中方法检出限的一般确定方法,依据公式MDL =t(n-1,0.99)×S,通过重复空白实验7次计算得各组分最低检测浓度,结果见表3。
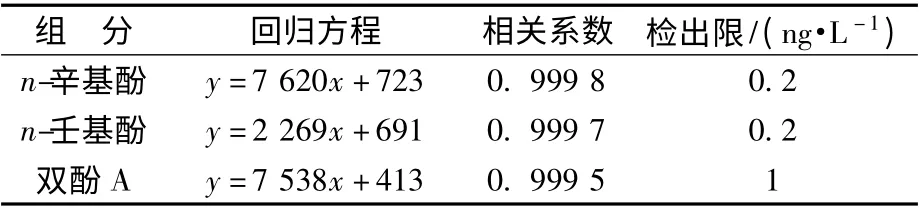
表3 标准曲线及检出限
2.4 方法的回收率与精密度
对一已知实际环境样品(未检出目标物)进行添加回收率和精密度实验,样品分别添加低、中、高(5、50、200 ng/L)3 种质量浓度的标准溶液(每个添加浓度平行测定6 次,并计算其相对标准偏差),用液相色谱-串联质谱进行测定。方法回收率及精密度结果见表4。
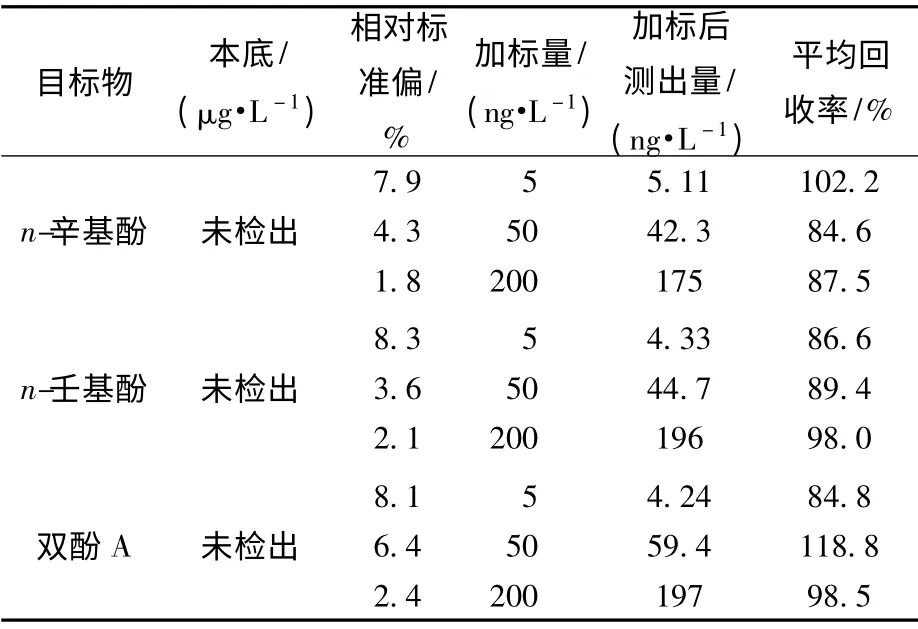
表4 3 种目标物的相对标准偏差和回收率(n=6)
2.5 样品的测定
应用该方法对环巢湖入湖河流河口水样共9条河流(8 进1 出)累计半年共计66 组(包含全程序空白、密码样和质控)水样进行了分析测定。分析结果表明,7 组样品中检出双酚A,含量为17.5 ~42.3 ng/L;12 组样品中检出n-壬基酚,含量为23.2 ~37.3 ng/L;9 组样品中检出n-辛基酚,含量为13.2 ~36.3 ng/L。3 种物质的检出率分别为10.6%、18.2%、13.6%。
3 结论
建立了盘式固相萃取-超高效液相色谱-串联质谱联用技术同时快速测定环境水体中n-壬基酚、n-辛基酚和双酚A 的方法。环境水样经膜盘萃取、超高效液相色谱分离、串联质谱(LC-MS/MS)多级离子监测(MRM)方式检测,外标法定量。结果表明,该方法具有较高的准确度和精密度,具有快速、灵敏、准确和操作简单等特点,可以作为环境水样中内分泌干扰物的监测方法,很好地应用于环境水样中n-辛基酚、双酚A 和n-壬基酚的含量分析。
[1]Lange I G,Daxenberger A,Schiffer B,et al.Sex hormones originating from different livestock production systems:fate and potential disrupting activity in the environment[J].Anal Chim Acta,2002,473(1/2):27-37.
[2]Jobling S,Sheahan D,Osborne J A,et al.Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss)exposed to estrogenic alkylphenolic chemicals[J].Environmental Toxicology and Chemistry,1996,15(2):194-202.
[3]Krishnan A V,Stathis P,Permuth S F,et al.Bisphenol-A: an estrogenic substance is released from polycarbonate flasks during autoclaving [J].Endocrinology,1993,132:2 279-2 286.
[4]吴永宁,江桂彬.重要有机污染物痕量与超痕量检测技术[M].北京:化学工业出版社,2007.
[5]侯绍刚,胡智弢,孙红文,等.固相萃取-高效液相色谱法测定生活污水中壬基酚聚氧乙烯醚及其降解产物[J].中国环境监测,2005,21(4):10-13.
[6]Quintana J B,Carpinteiro J,Rodriguez I.Determination of natural and synthetic estrogens in water by gas chromatography with mass spectrometric detection[J].Chromatogr A,2004,24(10):177-185.
[7]廖涛,吴晓翠,王少华,等.固相萃取-气象色谱/质谱联用法同时检测水体中9 种环境雌激素[J].分析化学研究简报,2013,41(3):422-426.
[8]Hintemann T,Schneider C,Scholer H F,et al.Field study using two immunoassays for the determination of estradiol and ethinylestradiol in the aquatic environment.Water Res,2006,40(6):2 287-2 294.
[9]张奎文,叶赛,那广水,等.高效液相色谱-串联质谱法测定环境水体中双酚A、辛基酚、壬基酚[J].分析实验室,2008,27(8):62-65.
[10]王静,潘荷芳,文莹,等.地表水中烷基酚类化合物的超高效液相色谱/串联质谱分析方法[J].中国环境监测,2008,24(5):8-11.
[11]马强,白桦,王超,等.液相色谱-串联质谱法同时测定纺织品和食品包装材料中的壬基酚、辛基酚和双酚A[J].分析化学研究报告,2010,38(2):197-201.
