猴头菌发酵液中抑制非酶糖基化反应物质的分离及分析
2015-11-11陶冠军丁重阳顾正华石贵阳
田 超,陶冠军,丁重阳,顾正华,张 梁,石贵阳
(1.江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;3.江南大学 食品科学与技术国家重点实验室,江苏 无锡214122)
猴头菌发酵液中抑制非酶糖基化反应物质的分离及分析
田 超1,2,陶冠军3,丁重阳1,2,顾正华2,张 梁2,石贵阳2
(1.江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;3.江南大学 食品科学与技术国家重点实验室,江苏 无锡214122)
以体外非酶糖基化反应抑制率为考察指标,对猴头菌发酵液中抑制非酶糖基化反应的高活性物质进行分离并纯化,通过发酵液浓缩、二步醇沉、提取物冷冻干燥、C18层析柱等步骤进行分离,获得1种对非酶糖基化反应具有良好抑制作用的物质组分HE35,经液相色谱-质谱(LC-MS)分析后发现,HE35的相对分子质量为294,2mg/mL的HE35对体外非酶糖基化抑制率达到92.17%,半抑制质量浓度IC50为0.65mg/mL。初步分析猴头菌发酵液中可能存在一种以上的活性物质,对体外非酶糖基化反应具有抑制作用。
猴头菌;非酶糖基化;液态发酵;抑制率
持续高血糖会引起机体多种蛋白质发生非酶糖基化(NEG)反应,所谓非酶糖基化,是指蛋白质、氨基酸等游离的氨基端与还原糖上的羰基通过一系列复杂的非酶促反应最终生成不可逆的糖基化终末产物(AGEs)的过程。持续高血糖引发的糖尿病常伴有白内障[1]、糖尿病肾病[2]和动脉粥样硬化[3]等慢性并发症,这些并发症的发病因素较多,其中蛋白质非酶糖基化是主要因素之一[4],也是组织器官老化的重要原因[5]。寻找能够抑制NEG反应的抑制剂是防治糖尿病及其并发症的方向之一,同时可以为开发治疗糖尿病药物提供先导化合物。
食药用真菌在自然界中来源丰富、分布广泛,含有多种对人体有益的天然产物,对多种疾病具有良好的防治和治疗效果,如灵芝中的三萜类物质灵芝酸,具有明显的抗肿瘤作用[6],灵芝多糖具有调节免疫、抗氧化损伤等功效[7],金耳菌丝体多糖和冬虫夏草多糖均有降血糖作用[8-9]。黄达明等[10]研究了猴头菌转化银杏叶粗提物(EGB),发酵液中非多糖提取物对非酶糖基化具有明显的抑制作用,但并未明确其物质的相对分子质量和具体化学结构。大型真菌中,担子菌的许多品种具有降血糖作用[11],猴头菌(Hericium erinaceus)就是其中代表之一,它含有丰富的生物活性物质,具有促进血液循环、降低血胆固醇、提高机体免疫力等多种功效[12-14]。目前,NEG反应的抑制剂主要为合成类药物,其毒副作用较大,且价格昂贵,对其使用有严格限制。猴头菌作为一种食药两用的真菌,与合成类药物相比,不但具有良好的疾病治疗效果,也是一种可以日常食用的佳肴美食。目前,对于分离和分析猴头菌中具有抑制NEG功能的物质,并利用猴头菌液态发酵生产具有抑制NEG反应的活性物质鲜有报道。
笔者以抑制体外蛋白质NEG反应为主要检测指标,对猴头菌发酵液进行初步分离和纯化,成功得到一种具有抑制NEG反应的活性物质,并对活性物质进行分析以鉴定此活性物质,为其进一步应用提供数据。
1 材料与方法
1.1 菌种与材料
猴头菌(Hericium erinaceus)保藏于江南大学粮食发酵工艺与技术国家工程实验室。
乙二醛、牛血清白蛋白(BSA)、氨基胍(AG)、叠氮化钠,国药集团化学试剂有限公司;甲醇为色谱纯,其余所用试剂均为国产分析纯。
1.2 培养基
斜面培养基(g/L):马铃薯200,葡萄糖20,琼脂条20~22。
种子培养基(g/L):葡萄糖20,玉米粉20,麸皮15,KH2PO42,MgSO4·7H2O 1,酵母膏3,VB10.015。
发酵培养基(g/L):葡萄糖20,玉米粉15,麸皮15,KH2PO42,MgSO4·7H2O 1。
1.3 仪器与设备
HITACHI 650-60型荧光分光光度计,日本Hitachi公司;台式高速离心机,Sigma公司;Waters 600型高效液相色谱仪、液相色谱串联四级杆飞行时间质谱仪、Masslynx4.1工作站,Waters公司;AKTA Purifier系统,Amersham Pharmacia Biotech公司。
1.4 方法
1.4.1 体外非酶糖基化反应抑制率的测定
NEG反应抑制率的测定方法参照文献[15]的方法并稍加修改。体外NEG反应体系反应液包含12mg/mL乙二醛、10mg/mL牛血清白蛋白和 2mg/mL叠氮化钠的pH为7.4的磷酸缓冲液。取1mL样品液与上述1mL反应体系液混合,以蒸馏水为空白样品,混匀后37℃避光反应15 d,反应结束后加蒸馏水定容至10mL,测定荧光强度。在激发波长370nm、狭长5nm、发射波长440nm、狭长6nm条件下利用荧光光度计测定荧光强度,重复3次,取平均值,计算体外NEG反应的抑制率,计算见式(1)。

式中:I为抑制率;a为空白样品荧光强度;b为待测样品荧光强度。
利用方差分析检验样品差异显著性,抑制率均以平均数(Mean)±标准差(SD)表示。
1.4.2 活性物质的粗提取
发酵得到的猴头菌发酵液经冷冻离心机8 000r/min离心10min去菌体取上清,采用30%(体积分数,下同)乙醇和70%乙醇二步醇沉,分离得到2个沉淀组分HE1和HE2,上清液经旋转蒸发仪除去乙醇,上清液浓缩后和乙酸乙酯1∶1(体积比)混合进行萃取,得到有机相HE3和水相HE4,两相组分分别经旋转蒸发仪除去含有的乙酸乙酯和残留的乙醇。将得到的4个组分冷冻干燥后用超纯水配制成一定浓度的溶液,取少量测定体外NEG反应抑制率,剩余样品4℃保存备用。
1.4.3 C18自制低压层析柱分离及C18制备柱纯化活性物质
采用自制低压层析柱(10 mm×50 cm,上海锦华层析设备厂制造)进行分离,C18填料,甲醇水梯度洗脱,流速为体积流量1.0mL/min,双紫外检测,按峰收集洗脱液。将洗脱液浓缩冻干,配制成质量浓度分别为0.5、1和2mg/mL溶液,测定体外NEG反应抑制率。
将C18自制低压层析柱分离得到的高抑制率活性组分通入制备柱(SunFire Prep C18 OBD Column,Waters公司)进行纯化,流动相为水(A)和甲醇(B),采用梯度洗脱:0~10min,B液5%~70%;10~40min,B液70%~100%;40.1min,B液回到5%并维持10min。流速为5mL/min,进样量1mL,254、299nm双紫外(UV)检测。按峰收集,将各样品浓缩冻干,4℃保存备用。
1.4.4 活性物质对体外NEG反应的抑制水平
称取活性物质样品50mg,溶于10mL水中,逐级稀释,配制成质量浓度为0.25、0.5、1.0、1.5、2.0、2.5、3.0、4.0和5.0mg/mL的溶液,分别测定不同浓度下对体外NEG反应的抑制率,绘制抑制水平曲线,分析活性物质对体外NEG反应的半抑制量IC50。
2 结果与讨论
2.1 猴头菌发酵液中抑制NEG反应活性组分的初步分离
为了研究猴头菌液态发酵后活性物质存在于胞内还是分泌到发酵液中,首先对发酵上清液和菌丝体抽提液进行抑制率的考察,结果见表1。由表1可知:猴头菌发酵上清液对体外NEG反应的抑制率远远高于菌丝体抽提液,表明猴头菌液态发酵后具有抑制NEG反应的活性物质被分泌到发酵液中。
将发酵得到的猴头菌发酵液经乙醇醇沉和乙酸乙酯萃取后,分别得到HE1、HE2、HE3和HE4共4个组分,测定4个组分不同浓度下对体外NEG反应的抑制率,结果见表2。由表2可知:HE3具有最高的抑制活性,而HE1和HE2的抑制率明显低于发酵上清液的抑制率。对二步醇沉淀得到的较低NEG反应抑制率的HE1和HE2进行分析后发现,两组物质分别为杂蛋白和杂多糖。HE4的抑制活性同样明显低于发酵液,表明乙酸乙酯萃取分离起到了较好的分离效果,将猴头菌中大部分抑制NEG反应的活性物质分离到有机相中。
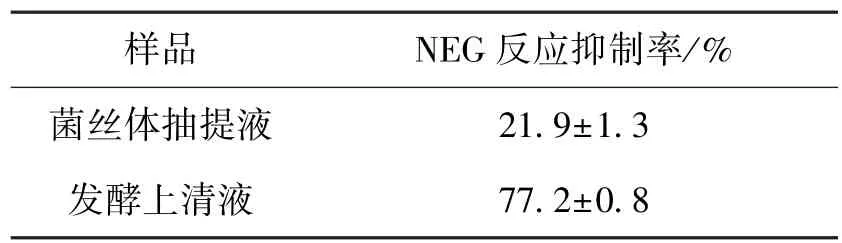
表1 猴头菌菌丝体抽提液与发酵液抑制体外NEG反应活性的比较Table 1 Comparison of NEG inhibition percentage between mycelium and fermentation broth from Hericium erinaceus
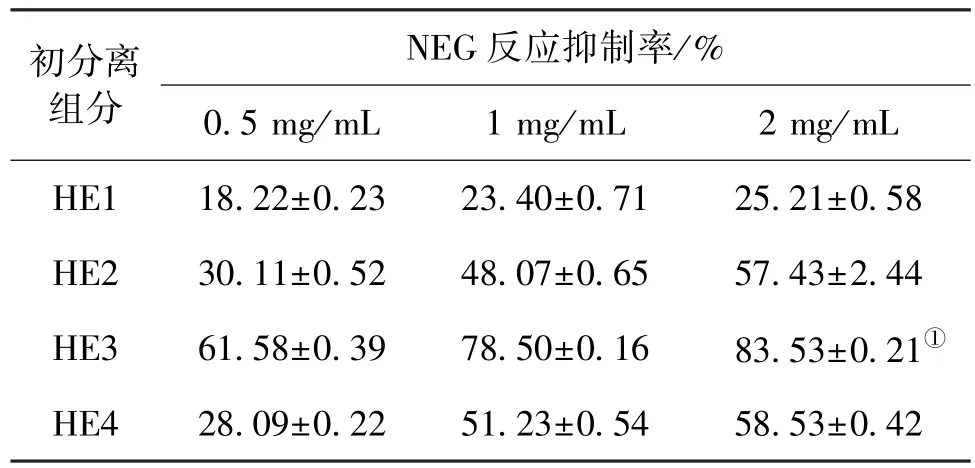
表2 猴头菌发酵液初分离组分对NEG反应抑制率的比较Table 2 Comparison of NEG inhibition percentage of four ingredients in fermentation broth
2.2 利用C18 SPE柱及自制C18低压层析柱分离活性物质
由于体外NEG反应需要在37℃孵育箱中避光反应15 d,致使抑制率的测定需在15 d后进行,周期相对较长,因此在对HE3进一步分离前需要建立一种较为方便的快速检测方法。通过初步的高压液相二极管阵列分析发现,C18 SPE小柱预分离得到的50%甲醇洗脱液的HPLC图谱中有4个比较明显的色谱峰,对各保留时间的色谱峰进行全波长扫描,显示在250nm和300nm左右均有明显的特征吸收带(图1、图2)。因此,进一步的分离过程中采用双紫外(UV)检测器,检测波长定为254nm和299nm,以此方法达到快速检测的目的。
参照C18 SPE小柱的预分离条件,用C18自制低压层析柱(10 mm×50 cm)进行分离,双紫外检测,分离图谱见图3。自动部分收集仪按峰收集洗脱液,20%、30%、40%、50%、60%、70%和100%甲醇洗脱得到7组不同的分离组分,分别命名为HE32、HE33、HE34、HE35、HE36、HE37和HE31,将各组分浓缩、冷冻干燥后测定NEG反应的抑制率,测定结果见表3。
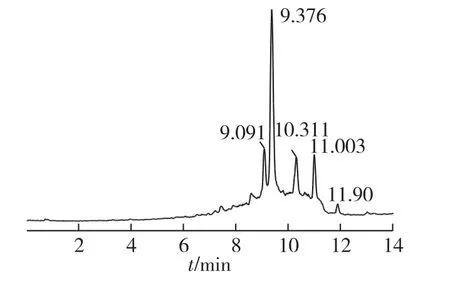
图1 50%甲醇洗脱样品HPLC图谱(总离子强度)Fig.1 HPLC chromatogram of 50%methanol elution sample(Total ions)
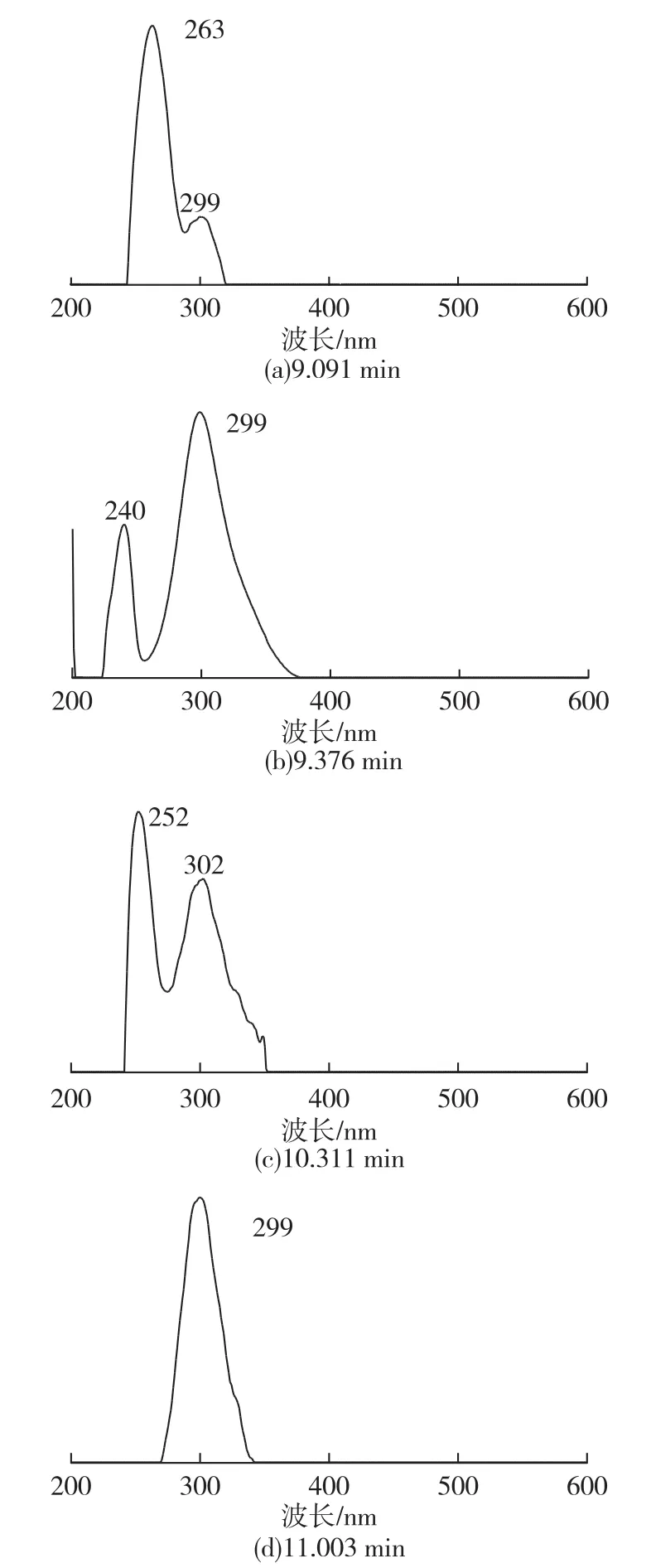
图2 图1中各峰保留时间全波长扫描Fig.2 Scan spectra from 200 to 600nm of HE3 in different retention time in Fig.1

图3 HE3 C18层析柱分离图谱Fig.3 C18 chromatogram for HE3 separation
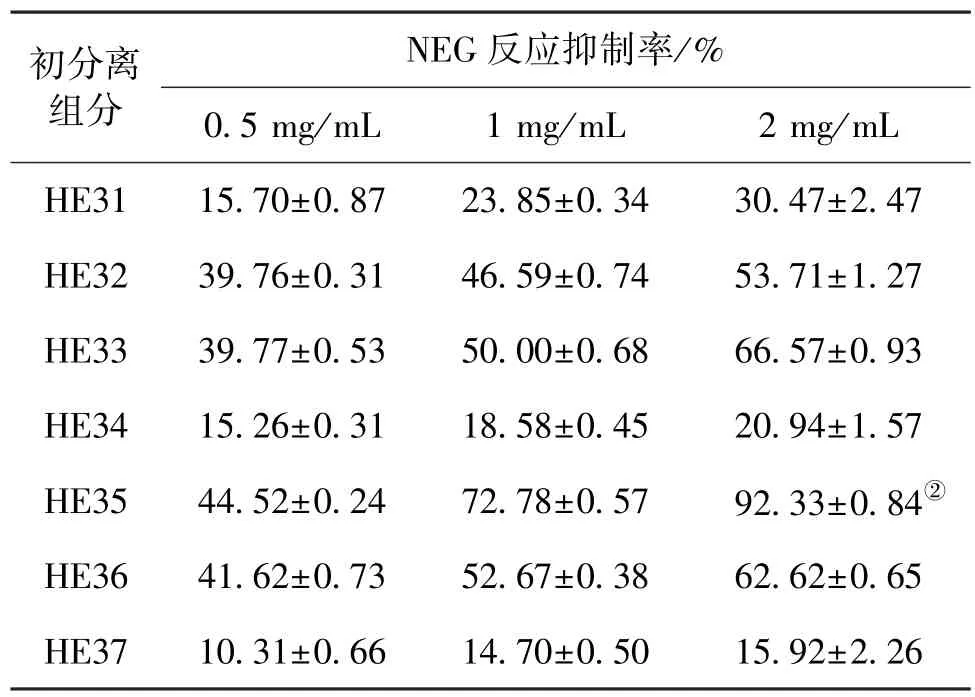
表3 猴头菌发酵液中HE3各分离组分对NEG反应抑制率的比较Table 3 Comparison of NEG inhibition rate of seven ingredients in HE3
由表3可知:HE3通过C18层析柱分离得到的7组组分中,50%甲醇洗脱样品HE35的体外NEG反应抑制率最高,在2mg/mL浓度下抑制率达到92.33%,远高于其他组分的抑制率,说明猴头菌发酵液中HE35是其发挥抑制作用的主要活性成分。同时HE33和HE36也有较好的抑制效果,表明猴头菌发酵液中可能存在多种物质,对NEG反应具有抑制作用。
将乙酸乙酯分离萃取得到的HE3组分经C18 SPE小柱(10g,60mL)预分离,利用甲醇-水梯度洗脱,收集各个梯度的洗脱液,对比后发现50%甲醇洗脱样品对NEG反应的抑制作用最为明显,表明C18柱可以将猴头菌发酵液中的活性物质进行有效的分离。
2.3 HE35制备液相纯化及LC-MS分析
在确定猴头菌发酵液中主要抑制成分后,为进一步提高主要活性物质HE35的纯度以进行结构方面的分析,需要对HE35进行高效液相制备,制备图谱见图4。由图4可知:在紫外检测波长254nm下无明显突出的单一洗脱峰,而检测波长300nm下有2个单一峰,保留时间分别为6.579和14.238min,通过单独收集2个单一洗脱峰,其他洗脱液合并收集,测定体外NEG反应抑制率发现,仅有保留时间14.238min收集的样品在2mg/mL质量浓度下抑制率达到92.17%,与制备前HE35的抑制率最为接近。
HE35通过液相的纯化后,将保留时间14.238min洗脱峰冻干样品进行LC-MS检测,结果见图5。由图5(a)可知,HE35的液相色谱图为近似单一对称峰,表明HE35分离纯化后基本达到色谱纯。对HE35进行质谱(图5(b))分析,发现其相对分子质量为294、588和882,为其二聚体和三聚体。
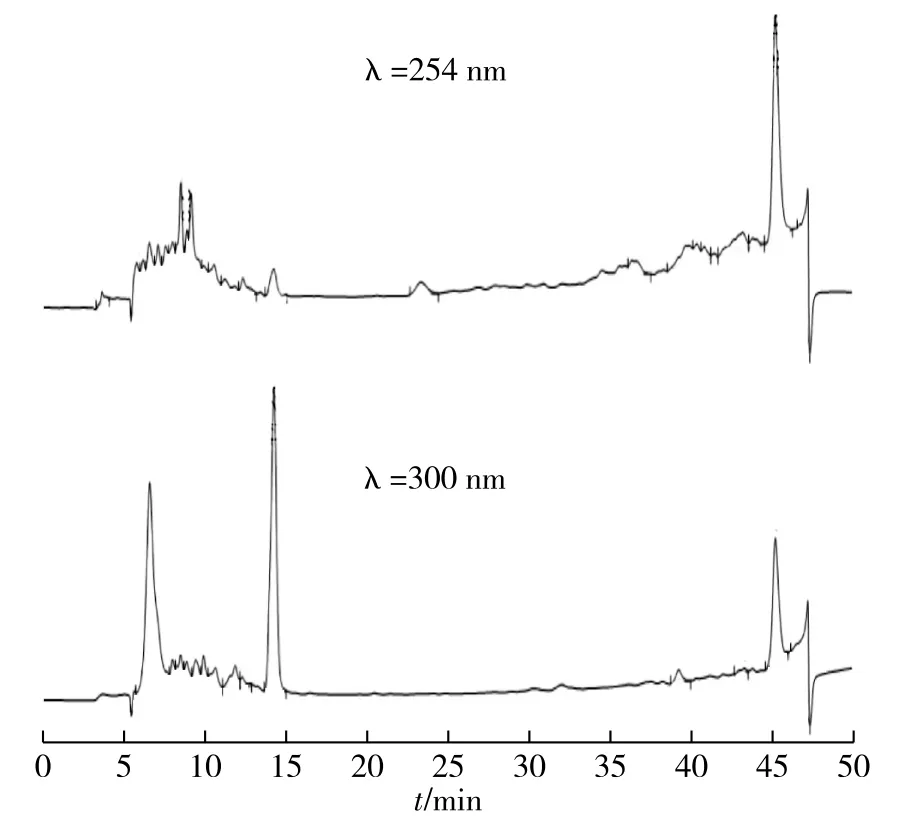
图4 HE35的HPLC图谱Fig.4 HPLC chromatogram of HE35
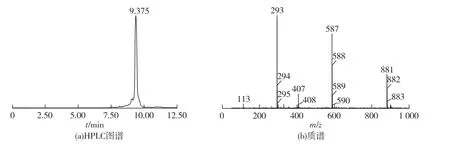
图5 HE35的HPLC图谱和保留时间9.375min样品的质谱Fig.5 HPLC chromatogram of HE35 and mass spectra at 9.375min
2.4 HE35的分子式分析
HE35物质呈黄色油状,在波长300nm和254nm下均具有较强的吸收峰,说明HE35的结构中含有苯环,据文献[16],此紫外吸收波长为共轭双键特性,且含有3个或3个以上共轭双键,属芳香族化合物。苯环上存在取代基时,在紫外区的1条吸收带会向长波移动且吸收强度增大,也验证了HE35为芳香族化合物,根据紫外吸收和高效液相分析初步推断HE35可能为黄酮类物质。然而紫外扫描只能反映分子中特定基团及附近的结构特征,无法反映整个分子的特性,在没有标准品对照情况下,HPLC分析也不能确定HE35的整个分子情况,因此需要进一步利用质谱与核磁进行检测,检测结果见图6和图7。
由图6可知HE35质谱碎片规律。图6(a)中ESI+:m/z=227[M+H]+结果表明主要有m/z=226和68这2个碎片脱落,碎片226为1分子HE35脱掉1分子异戊二烯(C5H8)产生的,因此,结合正离子质谱图分析,可判断HE35分子中除了含有苯环外,还含有1个异戊二烯基团;图6(b)ESI+:m/z=171[M+H]+结果说明主要有 m/z=170和124这2个碎片脱落,可能是HE35的母核结构发生断裂产生的2个片段;图6(c)中ESI+:m/z=277[M+H]+结果表明主要有m/z=276和18这2个碎片脱落,碎片276为HE35脱掉1分子H2O产生的,可判断HE35分子含有基团—OH;图6(d)中ESI+:m/z=119[M+H]+,说明主要有m/z=176和118这2个碎片脱落。
由图7可知:化学位移为10~11的峰为醛基上的质子,而化学位移为6~7的峰可能为酚羟基上的质子,化学位移为4~5的峰为异戊二烯基团双键上的质子。
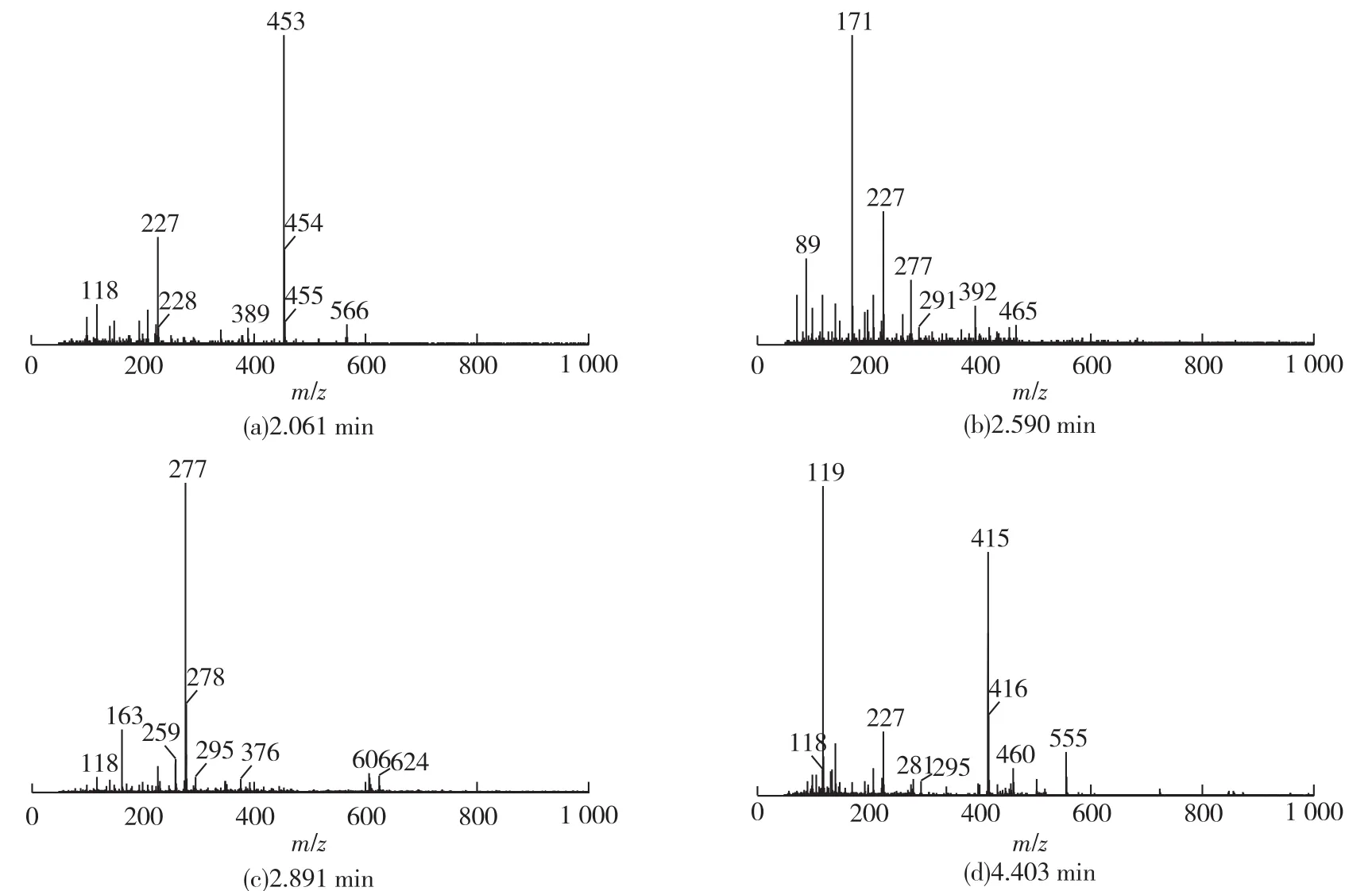
图6 HE35碎片不同保留时间质谱(ESI+)Fig.6 The mass spectrum of fragments at different retention time
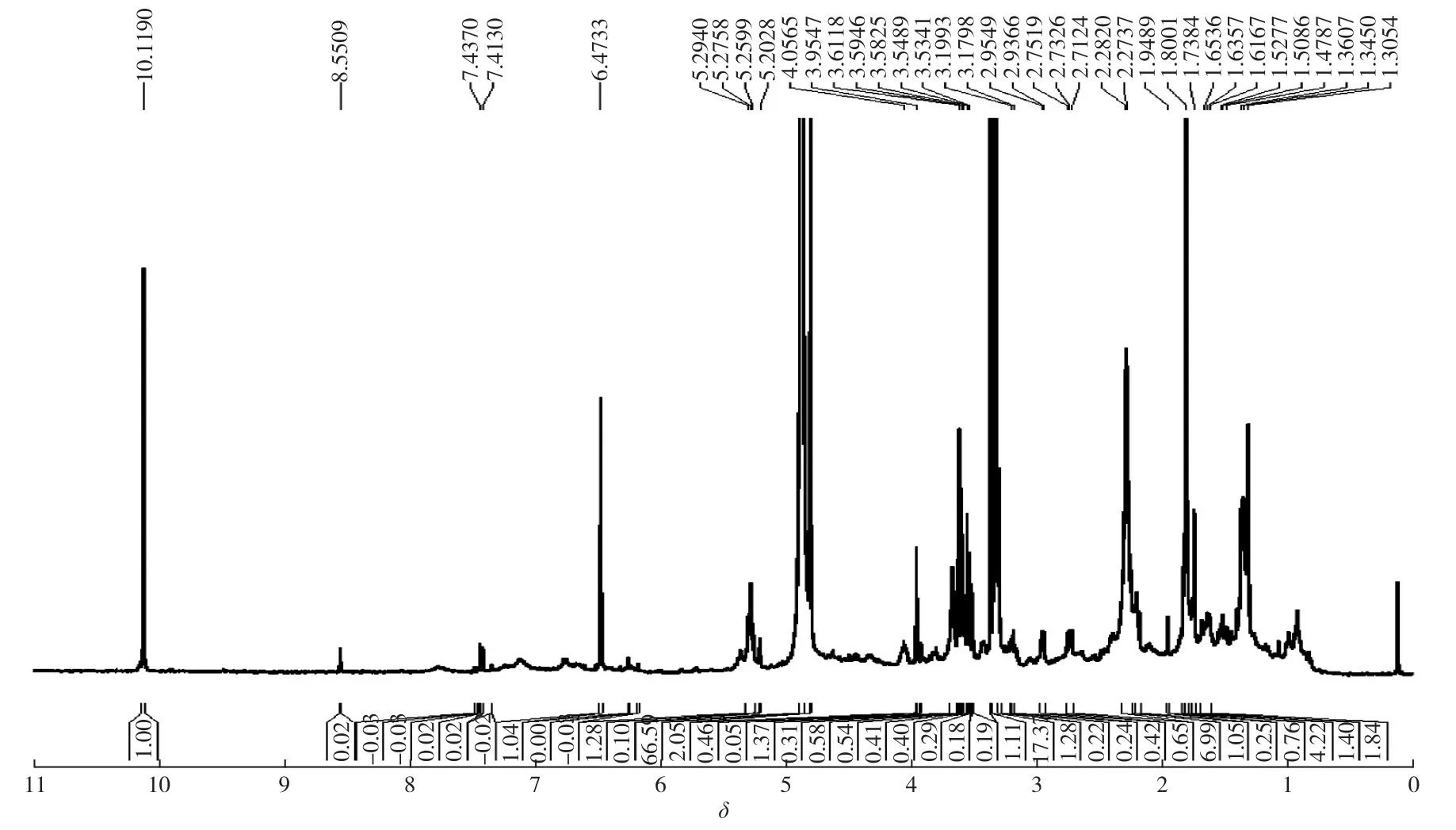
图7 HE35的1H核磁图谱Fig.71H NMR spectra of HE35
通过以上分析可知:HE35分子中可能含有2个苯环、1个—OH基团、1个异戊二烯基团和1个醛基,2个苯环以黄酮类物质母核结构C6—C3—C6形式存在,—OH可能位于苯环上,属于酚羟基,异戊二烯基团可能位于其中1个苯环的某一碳位上,且连接方式为C==C断开,取代苯环上的1个H,而醛基可能位于母核结构C6—C3—C6中的C3上,且醛基中的C原子可能为C3中1个C,因为根据相对分子质量294计算,已经不能再容纳更多的C原子,综上推断HE35的分子式为C20H22O2。确切的化学结构式有待于进一步的研究。
2.5 HE35体外NEG反应抑制水平分析
氨基胍(AG)是目前公认的最有临床应用前景的抑制NEG反应的药物,在欧洲一些国家已进入Ш期临床试验[17],为更好地研究HE35对非酶糖基化反应的抑制效果,选用AG作为阳性对照药物,结果见图8。

图8 HE35体外非酶糖基化反应的抑制水平Fig.8 Inhibitory effects of HE35 on NEG reaction in vitro
由图8可知:在0~2mg/mL时,随着HE35浓度的提高,对NEG反应的抑制率不断提高,HE35的抑制活性与其质量浓度呈现明显的正相关性,线性趋势线公式为y=76.4x,R2=0.980 8,半抑制质量浓度(IC50)为 0.65mg/mL。当质量浓度超过 2mg/mL时,HE35对NEG反应的抑制率趋于稳定,保持在90%以上。与AG相比,在低质量浓度(≤1.5mg/mL)范围内,HE35抑制效果略低于AG,超过一定质量浓度(≥1.5mg/mL)后,HE35的抑制效果优于AG,并维持在较高水平,从一定程度上也验证了合成类药物的治疗特点是时间短、作用迅速,活性物质平稳温和。然而,AG的毒副作用限制了HE35在降血糖方面的应用,HE35能否成为一种有效抑制NEG反应的替代新药或先导化合物,并进一步在治疗糖尿病方面发挥更大的价值还需要做更多的研究。
3 结论
采用液态发酵方法,以抑制NEG反应为检测指标,利用多种分析方法对具有抑制NEG反应活性的物质进行分离纯化和分析,结果发现,1种相对分子质量为294的小分子物质HE35对NEG反应具有良好的抑制作用,分析可能为黄酮类物质,初步推断分子式为C20H22O2,2mg/mL质量浓度下抑制率可达 92.17%,半抑制质量浓度(IC50)为 0.65mg/mL。其抑制机制和具体结构正在进一步研究中。
[1]Prabhakaram M,Katz M L,Ortwerth B J.Glycation mediated crosslinking between α-crystallin and MP26 in intactlens membranes[J].Mech Age Dev,1996,91(1):65-78.
[2]廉永昕,张嘉莉,李兢.糖尿病肾病发病机制研究进展[J].中国疗养医学,2012,21(6):515-516.
[3]李爱萍,田波,张瀚,等.晚期糖基化终产物在糖尿病诱发动脉粥样硬化中的作用[J].中国疗养医学,2011,20(10):913-915.
[4]Dan Q,Wong R,Chung S K,et al.Interaction between the polyol pathway and non-enzymatic glycation on aortic smooth muscle cell migration and monocyte adhesion[J].Life Sci,2004,76(4):445-459.
[5]Brownlee M,Vlassara H,Kooney A,et al.Aminoguanidine prevents diabetes-induced arterial wall protein cross-linking[J]. Science,1986,232:1629-1632.
[6]Lin S B,Li C H,Lee S S,et al.Triterpene-enriched extracts from Ganoderma lucidum inhibitgrowth ofhepatoma cells via suppressing protein kinase C,activating mitogen-activated protein kinases and G2-phase cell cycle arrest[J].Life Sci,2003,72(21):2381-2390.
[7]Li X L,Zhou A G,Li X M.Inhibition of Lycium barbarum polysaccharides and Ganoderma lucidum polysaccharides against oxidative injury induced by γ-irradiation in rat liver mitochondria[J].Carbohydr Polym,2007,69(1):172-178.
[8]张雯,赵旌旌,王捷思,等.金耳菌丝体多糖对实验性2型糖尿病大鼠的降血糖作用研究[J].天然产物研究与开发,2010,22(1):49-53.
[9]Li S P,Zhang G H,Zeng Q,et al.Hypoglycemic activity of polysaccharide,with antioxidation,isolated from cultured Cordyceps mycelia[J].Phytomedicine,2006,13(6):428-433.
[10]黄达明,常为众,张志才,等.猴头菌转化 EGB发酵液提取物抗氧化及抑制非酶糖基化活性研究[J].农业科学与技术:英文版,2008,9(2):10-13.
[11]Higaki M,Eguchi F,Watanabe Y.A stable culturing method and pharmacological effectsofthe Agaricusblazei[J].Nihon Yakurigaku Zasshi,1997,110:98P-103P.
[12]张鹏,图力古尔,包海鹰.猴头菌属真菌化学成分及药理活性研究概述[J].菌物研究,2011,9(1):54-62.
[13]杜志强,任大明,葛超,等.猴头菌丝多糖降血糖作用研究[J].生物技术,2007,16(6):40-41.
[14]杨焱,周昌艳.猴头菌多糖调节机体免疫功能的研究[J].食用菌学报,2000,7(1):19-22.
[15]Pampati P K,Suravajjala S,Dain J A.Monitoring nonenzymatic glycation of human immunoglobulin G by methylglyoxal and glyoxal:a spectroscopic study[J].Anal Biochem,2011,408(1):59-63.
[16]徐瑞秋,周政.基础有机化学[M].北京:人民教育出版社,1983.
[17]Williams M E.Clinical studies of advanced glycation end product inhibitors and diabetic kidney disease[J].Curr Diab Rep,2004,4(6):441-446.
(责任编辑 荀志金)
Separation and analysis of bioactive substances inhibiting non-enzymatic glycosylation from Hericium erinaceus fermentation broth
TIAN Chao1,2,TAO Guanjun3,DING Zhongyang1,2,GU Zhenghua2,ZHANG Liang2,SHI Guiyang2
(1.Key Laboratory of Industrial Biotechnology of the Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.National Engineering Laboratory for Cereal Technology,Jiangnan University,Wuxi 214122,China;3.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
The bioactive component inhibited non-enzymatic glycosylation(NEG)reaction in Hericium erinaceus culture broth was purified by detecting the inhibitory rate against NEG reaction.The purified procedure included the fermentation broth concentration,two-step ethanol precipitation,lyophilization of extracts and C18 chromatography,and the high inhibitory component of HE35 was obtained.Analyzing by liquid chromatography-mass spectrometry(LC-MS),the relative molecular mass was 294.In vitro experiment,the inhibition rate of HE35 at 2mg/mL against NEG reaction was 92.17%and its IC50was 0.65mg/mL.The purification results indicate that more than one component in H.erinaceus culture broth possess the inhibitory activity to NEG reaction.
Hericium erinaceus;non-enzymatic glycosylation;submerged fermentation;inhibition
TS201.2
A
1672-3678(2015)03-0047-08
10.3969/j.issn.1672-3678.2015.03.009
2014-04-01
江苏省自然科学基金(BK2011154)
田 超(1986—),男,河北保定人,硕士研究生,研究方向:生物化工;丁重阳(联系人),副教授,E-mail:zyding@jiangnan.edu.cn
