分析紫杉醇与三尖杉宁碱的简易方法
2015-11-11刘晓宁魏荣卿
黄 艳,刘晓宁,方 芳,徐 艳,魏荣卿,郑 涛
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.南京工业大学 生物能源研究所,江苏 南京 211800)
分析紫杉醇与三尖杉宁碱的简易方法
黄 艳1,刘晓宁1,方 芳1,徐 艳1,魏荣卿1,郑 涛2
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.南京工业大学 生物能源研究所,江苏 南京 211800)
以粒径单分散聚苯乙烯反相色谱填料为色谱柱固定相,即采用MKF-DK-RP型分析柱(300mm×7.8mm,8 μm),流动相为乙腈-水溶液,流速为1.0mL/min,检测波长为229 nm,建立了一种分析紫杉醇与三尖杉宁碱的简易方法。结果表明,本方法可使紫杉醇与三尖杉宁碱达到有效分离,且紫杉醇的检测浓度在0.062 5~2.0mg/mL范围内线性关系良好(r=0.999 9)。本方法简单,重复性好。
聚苯乙烯反相色谱填料;紫杉醇;三尖杉宁碱
紫杉醇(paclitaxel,商品名Taxol)是一种具有抗癌生物活性的抗肿瘤药物,属于三环二萜类化合物。该化合物最早是 Wani等[1]从短叶红豆杉(Taxus brevifolia)的树皮中分离得到。它具有独特的抗癌作用[2],对卵巢癌、乳腺癌、肝癌、肺癌以及白血病、黑色素瘤等恶性肿瘤都具有良好的疗效[3-4]。近年来,它已成为肿瘤治疗领域中的热点新药并得到了广泛关注,其市场需求量与日俱增[5]。
紫杉醇作为一种天然产物,在原料中的含量低微,平均含量约为0.015%(质量分数)。为此,人们探索和研究了红豆杉植物的栽培、紫杉醇的化学合成[6]、红豆杉植物的组织和细胞培养[7]以及微生物发酵[8]等技术。在上述方法中,通过植物的组织和细胞培养或微生物发酵来获取紫杉醇,它们耗时短、产量大且发酵液成分简单、易于紫杉醇的分离提取等。但是,在从培养的植物细胞以及微生物发酵液中获得紫杉醇,需涉及紫杉醇与紫杉烷类化合物的分离纯化问题,尤其是与三尖杉宁碱(仅C-13侧链末端的酰基基团)差2个碳原子的分离,难度较大[9-12]。因此,开发出一种高效、快捷、经济、实用的提取纯化方法,对紫杉醇的产量和质量有着积极的意义。
针对紫杉醇与三尖杉宁碱类紫杉烷类化合物的分析分离,国内外虽有相关报道,但大多数都采用的是以硅胶[13-15]基质为色谱柱的高效液相色谱法(HPLC),而硅胶的不可逆吸附使样品损失较大,且硅胶固定相只能使用一次,操作不便,价格昂贵。刘开录等[16]报道了一种用多孔型聚苯乙烯-二乙烯基苯高分子微球作固定相反相分离纯化紫杉醇的工艺,即先将紫杉烷类化合物富集在固体吸附剂上,再使用有机溶剂的水溶液进行洗脱,分步收集馏分,浓缩后再次进行柱分离。该工艺虽克服了正相色谱法中硅胶填料对样品的不可逆吸附而造成的回收率低以及柱寿命短等缺点,但该方法工艺过程繁琐,且分离条件未进行优化。
本研究中,笔者选用粒径均匀且耐压、耐酸碱的聚苯乙烯大孔吸附树脂填料装填的色谱柱,对含有三尖杉宁碱和紫杉醇的发酵液进行洗脱条件优化及分离纯化后的紫杉醇进行定量分析,并考察各流动相条件对分析效果的影响。
1 实验部分
1.1 仪器与试剂
高效液相色谱仪:美国戴安高效液相色谱系统,配备P680 HPLC泵、UVD-170U可变波长紫外检测器,AT-330柱温箱、8125型进样装置;MKFDK-RP型色谱柱(300mm×7.8mm,8 μm,南京麦科菲高效分离载体有限公司)。
发酵液(紫杉醇含量为33.3%、三尖杉宁碱含量为39.2%(以质量分数计)),南京麦科菲高效分离载体有限公司;紫杉醇标准品(纯度为93.7%)、三尖杉宁碱标准品(纯度为82.6%)、甲醇、乙腈(色谱纯),美国TEDIA公司;乙醇(分析纯),国药集团化学试剂有限公司);超纯水,自制。
1.2 溶液的配制
标准品储备液 精密称取20.0mg紫杉醇和三尖杉宁碱标准品置于10mL容量瓶中,用甲醇溶液定容。得到2.0mg/mL的紫杉醇和三尖杉宁碱标准品混合液,用甲醇溶液分别稀释成浓度为2.0、1.0、0.5、0.25、0.125和0.062 5mg/mL的一系列的标准工作溶液,绘制标准曲线。
供试品-1 移取发酵液0.5mL至20mL的容量瓶中,以甲醇溶液定容至20mL,用0.45 μm的有机滤膜过滤,待测(现用现配)。
供试品-2 精密称取三尖杉宁碱标准品10mg,以甲醇溶液定容至10mL,用0.45 μm的有机滤膜过滤,待测(现用现配)。
供试品-3 精密称取紫杉醇标准品10mg,以甲醇溶液定容至10mL,用0.45 μm的有机滤膜过滤,待测(现用现配)。
1.3 色谱条件
流动相为A(超纯水)、B(乙醇)、C(乙腈),流速为1.0mL/min,进样量为20 μL,检测温度为室温;检测波长为229 nm。
2 结果与讨论
2.1 流动相的选择
以供试品-1为研究对象,考察流动相种类及比例对紫杉醇和三尖杉宁碱分离纯化的影响。由文献可知,可用甲醇-水[17]、乙醇-水[18]或乙腈-水[19]体系对紫杉醇与三尖杉宁碱进行色谱分析。笔者分别对该3种流动相体系作了系统适应性实验,有机相浓度均为60%,结果见图1。

图1 不同流动相体系下样品的高效液相色谱图Fig.1 The test sample under different mobile phase systems by chromatograms of HPLC
由图1可知:甲醇-水作为洗脱溶剂,样品在60min还未出峰;乙醇-水体系的分析周期约为60min,分离度为1.26;乙腈-水体系的分析周期最短(25min),且分离度最好(1.67)。目前,文献中多以硅胶C18[20-22]分离纯化紫杉醇与三尖杉宁碱,但其分离度仅以1.2为标准来衡量。
采用该乙腈-水色谱条件,用紫杉醇和三尖杉宁碱的标准品对照定性,并对紫杉醇和三尖杉宁碱进行检测。供试品-1、供试品-2(三尖杉宁碱标准品)和供试品-3(紫杉醇标准品)的液相色谱图见图2。
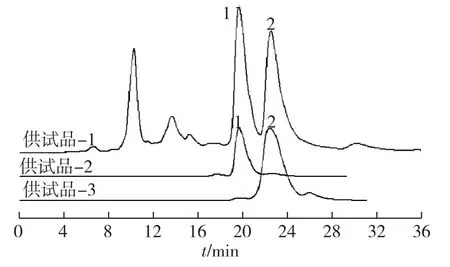
图2 供试品-1至-3样品的高效液相色谱Fig.2 The test samples of 1-3 by chromatograms of HPLC
由图2可知,在该色谱洗脱条件下,三尖杉宁碱和紫杉醇的保留时间分别为19.64min和22.34min。与药典中的检测方法相比,药典中采用梯度洗脱法,不仅洗脱程序复杂,且三尖杉宁碱和紫杉醇的保留时间分别为25.64min和27.44min,分析周期长且分离度(1.46)差。故乙腈-水色谱条件可用于后文紫杉醇纯品的检测。
2.2 标准曲线和线性范围
精密吸取不同质量浓度(2.0、1.0、0.5、0.25、0.125和0.062 5mg/mL)的紫杉醇和三尖杉宁碱溶液,采用2.1节乙腈-水色谱条件,进行检测。以紫杉醇和三尖杉宁碱的峰面积为纵坐标,浓度为横坐标,绘制紫杉醇和三尖杉宁碱的标准曲线并进行线性回归计算,得到回归方程和线性相关系数,结果见表1。由表1可知,紫杉醇和三尖杉宁碱标准品在0.062 5~2.0mg/mL范围内呈良好线性关系。

表1 紫杉醇和三尖杉宁碱的线性范围、回归方程和线性相关系数Table 1 Linear ranges,regression equation and correlation coefficient of paxlitaxel and cephalom
2.3 样品在乙腈-水体系中的洗脱规律探讨
以乙腈-水为流动相,对紫杉醇和三尖杉宁碱混合样进行色谱分析,通过改变流动相中有机相与水的比例实现紫杉醇与三尖杉宁碱的有效分离,并探索其中流动相与2种物质洗脱速率和分离度的规律。
2.3.1 乙腈洗脱浓度范围的确定
分别以40%、45%、55%和60%(乙腈体积分数)的乙腈-水为流动相,对供试品-1进行等度洗脱。由结果可知,在40%~60%乙腈浓度范围内,供试品-1都能被洗脱出来,说明该浓度范围的乙腈-水体系流动相能实现紫杉醇和三尖杉宁碱的洗脱;随着洗脱溶液中乙腈的含量增加,样品出峰趋快,分离度却变差,不能达到物质分离要求。因此,仅依赖于等度洗脱尚不能实现紫杉醇和三尖杉宁碱的有效分离。为此,接下来在40%~60%乙腈浓度范围内进行梯度洗脱优化,以期实现紫杉醇与三尖杉宁碱的更佳分离。
2.3.2 乙腈梯度洗脱条件优化
采用分段梯度洗脱法,分别对各阶段的洗脱时间和浓度进行优化,以实现紫杉醇与三尖杉宁碱的有效分离。将分离条件模式分为“前段”,即前段高浓度将样品较快地冲入色谱柱内;“中段”,即中段低浓度以延迟紫杉醇的出峰时间,提高分离度;“后段”,即后段高浓度将紫杉醇快速洗脱出来,以缩短分析周期。样品洗脱结果见图3和表2。

图3 乙腈梯度洗脱条件下的高效液相色谱Fig.3 HPLC chromatograms of sample
由梯度洗脱条件1和2比较可知,前段的洗脱条件相同,延长梯度变化(60%~50%)洗脱时间,条件1比2出峰时间晚,说明流动相洗脱浓度越低,出峰时间越晚;条件1和2中紫杉醇出峰时间相差不大,但条件1中的三尖杉宁碱出峰较晚,说明前段的乙腈洗脱浓度主要影响三尖杉宁碱的出峰时间;与条件1相比,条件2中的40%乙腈等度洗脱时间长,分离度得到改善,但三尖杉宁碱峰型拖尾严重,说明中段40%乙腈洗脱时间不宜过长。由梯度洗脱条件1和3比较可知,延长前段(3~5min)洗脱时间,条件3的梯度条件变化简单,即采用24min将乙腈浓度由45%升至60%的线性洗脱,出峰时间提前,分离度提高,说明中段洗脱采用线性梯度洗脱更有利于紫杉醇和三尖杉宁碱的分离。由梯度洗脱条件3和4比较可知,前段洗脱条件相同,而条件4中的线性洗脱,乙腈浓度由40%升至60%,出峰时间稍晚,但分离度提高,说明线性梯度洗脱,乙腈浓度由40%升至60%,能够实现紫杉醇和三尖杉宁碱的有效分离。

表2 乙腈梯度洗脱的分离参数Table 2 Separation parameters of different gradient elution of acetonitrile
2.4 紫杉醇的含量分析
收集梯度洗脱条件4下的紫杉醇峰物质样品(记为紫杉醇纯品),将其浓缩后在2.1节乙腈-水色谱条件下进行含量分析,结果见图4。
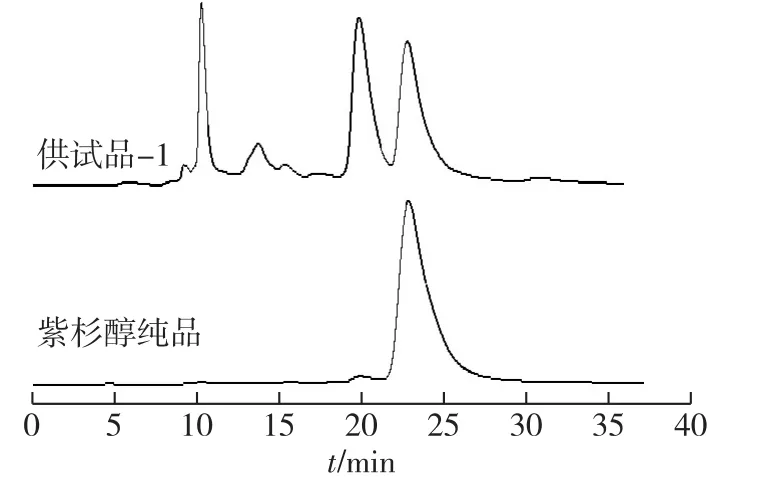
图4 供试品-1和紫杉醇纯品的高效液相色谱Fig.4 HPLC chromatograms of the test sample-1 and paclitaxel
由图4可知,经紫杉醇标准浓度曲线的定量,供试品-1中紫杉醇的纯度为33.32%,纯化后得到的紫杉醇纯品的纯度为98.65%,即除去了原料液中几乎全部的色素和绝大部分杂质。说明样品经乙腈-水流动相分段梯度洗脱后,三尖杉宁碱与紫杉醇达到了有效分离,且经定量分析,紫杉醇的回收率可达到86%。该法可为今后紫杉醇的工业化生产提供有力的实验和理论依据。
3 结论
采用聚苯乙烯基质色谱柱(MKF-DK-RP),以乙腈-水为流动相,对含有紫杉醇和三尖杉宁碱的发酵液样品进行洗脱条件优化并将分离纯化后的紫杉醇进行含量分析。经过对样品的洗脱条件优化后,采用分段梯度洗脱法,可将紫杉醇与三尖杉宁碱有效分离,且经标准浓度曲线的定量,得到纯度为98.65%的紫杉醇纯品,除去了原料液中几乎全部的色素和绝大部分杂质,这给紫杉醇的分离纯化向工业化方向发展提供了有力的理论和实验依据,具有重要的参考价值。
[1]Wani M C,Taylor H L,Wall M E,et al.Plant antitumor agents:VI.isolation and structure of taxol,a novel antileukemic and antitumor agent from Taxus brevifolia[J].J Am Chem Soc,1971,93(9):2325-2327.
[2]杨磊,樊红.紫杉类抗肿瘤药物的临床应用进展[J].中国医院用药评价与分析,2004,61(1):105-113.
[3]Guo W,Johnson J L,Khan S.Paclitaxel quantification in mouse plasma and tissues containing liposome-entrapped paclitaxel by liquid chromatography-tandem mass spectrometry:application to a pharmacokinetics study[J].Anal Biochem,2005,336(2):213-220.
[4]Navia-Osorio A,Garden H,Cusidó R M,et al.Taxol® and baccatin III production in suspension cultures of Taxus baccata and Taxus wallichiana in an airlift bioreactor[J].J Plant Physiol,2002,159(1):97-102
[5]施树云,钟世安,周春山.高效液相色谱测定湖南红豆杉中紫杉醇的含量[J].药物分析杂志,2004,24(5):552-553
[6]Mendoza A,Ishihara Y,Baran P S.Scalable enantioselective total synthesis of taxanes[J].Nature Chem,2012,4:21-25.
[7]Zhong J J.Plant cell culture for production of paclitaxel and other taxanes[J].J Biosci Bioeng,2002,94(6):591-599.
[8]Ji Y,Bi J N,Yan B,et al.Taxol-producing fungi:a new approach to industrial production of taxol[J].Chin J Biotechnol,2006,22(1):1-6.
[9]Zhang J,Yang C F,Yuan K.Simultaneous determination of 10-deacetylbaccatin,cephalomannine and taxol in different parts of Taxus media with different growth years by UPLC[J].Appl Mechan Mat,2012,108(12):326-330.
[10]Kang S H,Kim J H,Mun S.Optimal design of a tandem simulated moving bed process for separation of paclitaxel, 13-dehydroxybaccatin III,and 10-deacetylpaclitaxel[J].Process Biochem,2010,45(9):1468-1476.
[11]Dong H R,Lou L N,Bi P Y,et al.Determination of taxol,cephalomannine and 7-epi-taxol in Taxus by PRP-6 solid phase extraction and high performance liquid chromatography[J].Anal Lett,2005,38(6):929-937.
[12]Sim H A,Lee J Y,Kim J H.Evaluation of a high surface area acetone/pentane precipitation process for the purification of paclitaxel from plant cell cultures[J].Sep Purif Technol,2012,89(22):112-116.
[13]李志良,骆雪兰,谢维权,等.从中国红豆杉细胞培养物中分离鉴定紫杉醇[J].天然产物研究与开发,2003,15(5):433-440.
[14]雒丽娜,董慧茹,张建军,等.正相色谱和反相色谱法分离提纯东北红豆杉中紫杉醇和三尖杉宁碱[J].分析科学学报,2003,19(5):517-521.
[15]李智,韩静,吴娅征,等.RP-HPLC-凝胶分离法测定紫杉醇纳米微乳的包封率[J].药物分析杂志,2008,28(5):772-775.
[16]刘开录,杨雪峰.制备液相色谱法分离提取紫杉醇及其类似物:中国,1140170A[P].2011-07-06.
[17]赵芳,耿征,刘谦光,等.用反相高效液相色谱法测定南方红豆杉组织培养产物中的紫杉醇[J].分析化学,1997,25(8):941-943.
[18]Mun S,Linda Wang N H.Optimization of productivity in solvent gradient simulated moving bed for paclitaxel purification[J]. Process Biochem,2008,43(12):1407-1418.
[19]张静,廖海兵,金永春,等.UPLC法同时测定曼地亚红豆杉中3个有效成分的含量[J].药物分析杂志,2011,31(11):2073-2077.
[20]张志强,王云山,田桂莲,等.C18-硅胶的原位合成及其作为常压层析介质在紫杉醇分离纯化中的应用[J].化学反应工程与工艺,2000,16(3):281-285.
[21]Watchueng J,Kamnaing P,Gao J M,et al.Efficient purification of paclitaxelfrom yews using high-performance displacement chromatography technique[J].J Chromatogr A,2011,218(20):2929-2935.
[22]Wang Chuangui,Wu Jianyong,Mei Xingguo.Enhancement of Taxol production and excretion in Taxus chinensis cell culture by fungal elicitation and medium renewal[J].Appl Microbiol Biotechnol,2001,55:404-410.
(责任编辑 荀志金)
Simplified analysis and purification of paclitaxel and cephalomannine
HUANG Yan1,LIU Xiaoning1,FANG Fang1,XU Yan1,WEI Qongqing1,ZHENG Tao2,
(1.College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China;2.BioEnergy Institute,Nanjing Tech University,Nanjing 211800,China)
A simple analytical and purification method for paclitaxel and cephalomannine was developed using the MKF-DK-RP analytical column(300mm×7.8mm,8 μm particle size)with monodisperse polystyrene reverse-phase chromatography.The mobile phase was acetonitrile-water at a flow rate of 1.0mL/min.The detection wavelength was 229 nm.Paclitaxel and cephalomannine could be effectively purified.It could quantitatively analyze and purify paclitaxel in the range between 0.062 5 and 2.0mg/mL(r=0.999 9).The optimized process is easy to operate,and reproducible.
polystyrene reverse-phase chromatography packing;Paclitaxel;Cephalomannine
O652.63
A
1672-3678(2015)02-0081-05
10.3969/j.issn.1672-3678.2015.02.016
2013-12-10
国家重点基础研究发展计划(973计划)(2013CB733504);国家高技术研究发展计划(863计划)(2012AA021203)
黄 艳(1987—),女,江苏灌南人,硕士研究生,研究方向:生物化工;郑 涛(联系人),教授,E-mail:hellozheng@gmail.com
